Основы биохимии - А. А. Анисимов 1986
Углеводы
Взаимопревращения углеводов, ферментативный синтез и расщепление
6.6.1. Ферментативные взаимопревращения моносахаридов.
Первыми простейшими углеводами, образующимися в процессе фотосинтеза, являются фосфотриозы — глицеральдегид-3-фосфат, гидроксиацетонфосфат, которые дают начало всем моносахаридам и другим углеводам. Вступая в реакцию конденсации, осуществляемую альдолазой, они образуют фруктозо-1,6-бисфосфат. Последний, теряя частично или полностью свои фосфатные остатки, способен превращаться в другие гексозы (глюкоза, манноза, их фосфорные эфиры) или участвовать в синтезе сахарозы и крахмала.
Взаимопревращения моносахаридов происходят в результате действия соответствующих ферментов на уровне фосфорных эфиров и нуклеозидфосфатов сахаров. Глюкоза под действием гексо-киназы превращается в глюкозо-6-фосфат:
![]()
Аналогичные реакции известны и для других представителей углеводов. Само взаимопревращение моносахаридов осуществляется ферментами изомеразами. Например, фермент глюкозофосфат-изомераза катализирует обратимое превращение глюкозо-6-фосфата во фруктозо-6-фосфат, а маннозофосфат-изомераза — маннозо-6-фосфата во фруктозо-6-фосфат. Действие обоих ферментов происходит с образованием промежуточного ендиола; обе изомеразы стереоспецифичны.
Образование свободных моносахаридов из их фосфорных эфиров происходит под действием фосфатаз, которые чрезвычайно широко распространены в растениях, у микроорганизмов и животных.
В растениях содержатся изомеразы, катализирующие взаимные превращения уроновых кислот: УДФ-глюкуроновая кислота ⇄ УДФ-галактуроновая кислота; некоторых пентоз: УДФ-ксилоза⇄УДФ-арабиноза.
Галактоза превращается в глюкозо-1-фосфат по следующей схеме:
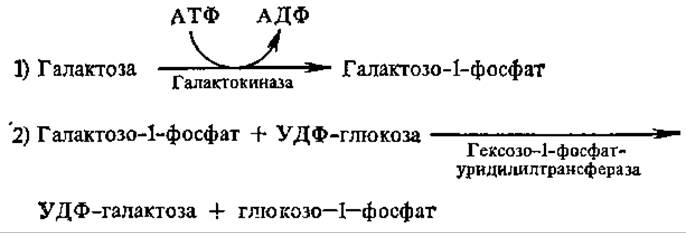
Реакции превращения галактозы в глюкозу привлекают к себе большое внимание в связи с наследственным заболеванием — галактоземаей, причиной которой является генетическая утрата гексозо-1-фосфат — уридилилтрансферазной активности, в результате чего организм1 ребенка лишается способности усваивать галактозу из лактозы молока. Активность другого фермента, найденного в печени взрослых людей, галактозо-1-фосфат — уридилилтрансферазы, непосредственно образующего УДФ-галактозу из УТФ и галактозо-1-фосфата, у детей обнаружена в следовых количествах, не обеспечивающих усвоение галактозы.
Обратный процесс превращения глюкозы в галактозу представляет большой интерес с точки зрения образования лактозы в молочной железе, поскольку в последнюю с кровью поступает только глюкоза. Он идет по схеме

Образование пентоз в клетке может происходить различными путями. Во многих случаях основным механизмом биосинтеза пентоз является пентозофосфатный путь окисления углеводов (см. разд. 6.9.3), а у растений, дополнительно к нему, фотосинтетический цикл Кальвина.
Кроме того, пентозы могут образовываться из УДФ-уроновых кислот при их декарбоксилировании. Так, ксилоза образуется из глюкуроновой кислоты, а арабиноза из галактуроновой. Для растений - характерны превращения по схеме
![]()
Известно, что у растений фермент альдолаза обладает широкой специфичностью и может катализировать как биосинтез гексоз (фруктоза), так и биосинтез пентоз, поскольку при ее участии дигидроксиацетонфосфат может конденсироваться не только с глицеральдегидом, но также с целым рядом других альдегидов (уксусный, гликолевый), в результате чего и образуются пентозы.
6.6.2. Биосинтез олиго- и полисахаридов. Роль нуклеозиддифосфатсахаров (НДФС) в биосинтезе полисахаридов. Поскольку гидролиз одной гликозидной связи в молекуле олиго- или полисахаридов сопровождается выделением — 16,8 кДж энергии, а для сахарозы даже 29,3 кДж, то образование гликозидной связи возможно только при поступлении требуемого количества энергии. Поэтому синтез олиго- и полисахаридов в живых клетках не может быть объяснен обращением действия соответствующих гидролаз в противоположную сторону.
Экспериментальное подтверждение получили те пути синтеза полисахаридов, в которых в реакцию вступают не свободные моносахариды, а их производные с повышенным уровнем свободной энергии, и реакции имеют характер замещения, переноса, а не присоединения молекул. При реакциях переноса, замещения одних групп в молекуле другими обычно существенных изменений свободной энергии не происходит, эти реакции идут легко в обоих направлениях. Именно этим объясняется обратимость в ряде случаев реакций фосфоролиза олиго- и полисахаридов; продукты расщепляющего действия гликозилтрансфераз — фосфорные эфиры сахаров обладают достаточно высокой свободной энергией эфирной связи ~15—20 кДж/моль.
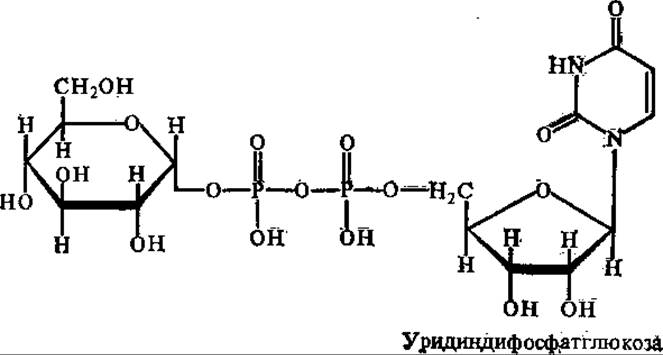
Работами аргентинского биохимика Л. Лелуара и его сотрудников в 60-х годах XX в. было установлено, что своеобразными донорами гликозильных остатков для синтеза полисахаридов являются НДФС: УДФ-глюкоза, АДФ-глюкоза, УДФ-глюкозамин, УДФ-ксилоза и т. д.
Свободная энергия связи между гликозильными остатками и нуклеозиддифосфатами (НДФ) относительно высокая, в УДФ-глюкозе, например, она составляет более 30 кДж/моль, что вполне достаточно для синтеза гликозидных связей в полисахаридах.
НДФС образуются из нуклеозид-5'-трифосфатов и сахар-1-фосфатов под действием ферментов, имеющих групповое название нуклеотидилтрансферазы.
Нуклеозидтрифосфат (НТФ) + Сахар-1-фосфат НДФС + Н4Р2О7
Существенных изменений свободной энергии в процессе этой реакции не происходит, однако вследствие гидролиза Н4Р2О7 неорганическими пирофосфатазами (которые практически всегда очень активны в клетках) она становится необратимой.
Дальнейший синтез полисахаридов идет по схеме НДФС + акцептор → НДФ + сахар-акцептор. Реакции этого типа катализируются ферментами подкласса гликозилтрансфераз, тривиальные названия которых образуются по синтезируемому углеводу: сахарозосинтаза, гликоген-синтаза и т. д. НДФС являются их коферментами. Если в качестве акцептора функционирует моносахарид, то синтезируется дисахарид, но акцептором может быть любой другой углевод, в результате взаимодействия с НДФС его молекула увеличивается на 1 гликозильный остаток. При многократном повторении реакции каждый раз молекула акцептора — «затравка» удлиняется на 1 гликозил.
Повторяемость реакции обеспечивается регенерацией НДФ до НДФС:
НДФ + АТФ → НТФ + АДФ
НТФ + Сахар-1-фосфат → НДФС + Н4Р207
В результате всей цепи реакций НДФС регенерируется, как компонент катализатора (фермента) он не расходуется, не входит в состав конечных продуктов — эти свойства всех катализаторов остаются ненарушенными.
В настоящее время считают, что рассмотренная система реакций с участием НДФС является основным путем биосинтеза олиго- и полисахаридов.
Биосинтез сахарозы. Биосинтез сахарозы осуществляется двумя основными путями.
1. УДФ-глюкоза +Фруктозо-6-фосфат → УДФ + Сахарозофосфат. Эта реакция катализируется сахарозофосфат-синтазой. Далее образовавшийся сахарозофосфат под действием фосфатазы дает сахарозу и Н3РО4.
2. УДФ-глюкоза +Фруктоза ⇄ УДФ +Сахароза. В данной реакции принимает участие другой фермент — сахарозосинтаза.
Установлено, что дезоксиуридиндифосфатглюкоза используется также эффективно, как и УДФ-глюкоза, а АДФ-глюкоза — значительно менее эффективно.
Физиологическая роль двух вышеуказанных ферментов различна: сахарозофосфат-синтаза свойственна хлорофиллоносным тканям, а сахарозосинтаза — нехлорофиллоносным, где она в большей степени проявляет активность, направленную на образование УДФ- глюкозы, чем сахарозы. Синтез сахарозы с участием сахарозофосфат-синтазы требует больших затрат энергии, поэтому эта реакция необратима. Энергия необходима для активации вступающих в реакцию глюкозы и фруктозы согласно следующей серии реакций:
АТФ + Глюкоза → Глюкозо-6-фосфат + АДФ
Глюкозо-6-фосфат ⇄ Глюкозо-1-фосфат УТФ + Глюкозо-1-фосфат → УДФ-Глюкоза + ФФН
АТФ + Фруктоза Фруктозо-6-фосфат + АДФ
Таким образом, для образования одной гликозидной связи сахарозы необходимы три макроэргические связи НТФ. С другой стороны, благодаря сильно экзергоническому характеру этой реакции возможно накопление в соке некоторых растений (сахарный тростник, сахарная свекла) высоких концентраций сахарозы при очень низком содержании ее предшественников. Установление факта участия УДФ-глюкозы в синтезе сахарозы имеет большое значение, так как именно она играет первостепенную роль и в процессе синтеза в растениях гликозидов вообще.
Некоторые бактерии содержат фермент сахарозоглюкозилтрансферазу (сахарозофосфорилаза), катализирующую обратимую реакцию:
Сахароза + Фн ⇄ Глюкозо-1-фосфат + Фруктоза
Если из реакционной среды быстро удаляется неорганический фосфат, то эта реакция может приводить к синтезу сахарозы, однако в условиях, существующих внутри клетки, обычно происходит распад сахарозы.
Биосинтез лактозы. Дисахарид лактоза образуется в молочной железе млекопитающих в результате следующей реакции: УДФ-галактоза + D-Глюкоза → УДФ + Лактоза. Фермент лактозо-синтаза, катализирующий эту реакцию, сложный и состоит из двух частей: белка А, обнаруженного кроме молочной железы в печени и тонком кишечнике, и белка В, который не обладает ферментативной активностью, но изменяет специфичность белка А таким образом, что в качестве акцептора галактозы белок А может использовать только D-глюкозу, а не N-ацетил-О-глюкозамин, как при отсутствии белка В.
Биосинтез гликогена и крахмала. Избыток сахаров, синтезированных в организме или поступивших с пищей, образует запасные отложения в основном в форме крахмала у растений и гликогена у животных.
Синтез крахмала в растениях катализируют несколько ферментов. Крахмал-синтаза (УДФГ- или АДФГ-а-глюкан — глюкозилтрансфераза) при участии АДФ-глюкозы (реже УДФ-глюкозы) и акцептора — затравки, состоящей из четырех и более остатков глюкозы (т. е. декстрина), синтезирует линейные цепи амилозы и неразветвленные участки амилопектина.
![]()
Л. Лелуар (1964) установил, что наиболее активным донором глюкозильных остатков для синтеза крахмала в запасающих органах растений является АДФ-глюкоза. Известно, что крахмал, накапливающийся в листьях при фотосинтезе, может очень легко превращаться в сахарозу — основную транспортную форму углеводов в растении. В таком виде образующиеся углеводы перетекают в семена, клубни, луковицы, где и откладываются в запас опять в виде крахмала или фруктозанов (инулин, левулезаны). В этом процессе амилазы не принимают участия, основная роль принадлежит реакциям трансгликозилирования при участии НДФС. Сахароза может превратиться в крахмал двумя путями:

Для синтеза крахмала по первому пути потребляется 4 моля АТФ, а по второму — только 2, что является более экономичным и более вероятным путем синтеза крахмала из сахарозы. Так же легко происходит превращение сахарозы в левулезаны. У бактерий аналогичным образом из сахарозы синтезируются различные декстраны (глкжозаны) и леваны (фруктозаны).
In vitro образование линейных цепей амилозы с а(1→4)-связями при наличии затравочного декстрина может происходить и путем обращения фосфоролиза по реакции: Глюкозо-1-фосфат + Акцептор ⇄ а(1→4)-Глюкозил-акцептор + Ортофосфат. Однако возможность такого синтеза in vivo с участием фермента фосфорилазы не доказана. Крахмал-фосфорилаза может катализировать у растений лишь синтез коротких цепей затравочных декстринов, которые затем достраиваются до молекул амилозы при действии АДФГ-a-глюкан — глюкозилтрансферазы (крахмал-синтаза).
Растительные фосфорилазы сильно отличаются от животных. Так, в отличие от фермента из мышц у фосфорилазы из картофеля отсутствует серинфосфат, для него не требуется АМФ в качестве кофактора. Ни крахмал-синтаза, ни фосфорилаза не способны катализировать образование а (1→6)-связей в амилопектине, характерных для точек ветвления. Эта реакция осуществляется под действием энзима Q (фактор ветвления), который представляет собой трансгликозилазу и переносит концевой олигосахарид амилозной цепи на шестой гидроксил глюкозы той же или другой молекулы амилозы, образуя ветвление (рис. 6.9).
В биосинтезе другого запасного полимера — гликогена — основная роль принадлежит также НДФС. У животных переносчиком гликозильных групп служит обычно уридиндифосфат, тогда как в клетках микроорганизмов эту функцию осуществляет АДФ, иногда ЦДФ и ГДФ. Реакция идет в несколько стадий. На первой стадии, катализируемой глюкозо-1-фосфат — уридилил-трансферазой образуется УДФ-глюкоза по реакции: а-Глюкозо-1-фосфат + УТФ⇄УДФ- Глюкоза + Пирофосфат.
На второй стадии глюкозильная группа УДФ-глюкозы переносится на концевой остаток амилозной цепи с нередуцирующего конца с образованием а(1→4) -связей. Эта реакция катализируется гликоген-синтазой (УДФГ-а-глюкан — глюкозилтрансфераза): УДФ-Глюкоза + (Глюкоза)n → УДФ + (Глюкоза)n+1. В реакции равновесие сдвинуто в сторону преимущественного синтеза гликогена.
В качестве акцептора для действия гликоген-синтазы необходима цепочка, состоящая не менее чем из четырех остатков глюкозы. С удлинением цепочки активность фермента увеличивается. Ветвление цепей гликогена осуществляет, как и в случае амилопектина, трансгликозилаза.
Биосинтез целлюлозы. Установлено, что в хлопчатнике — главном продуценте целлюлозы — биосинтез этого полисахарида осуществляется путем переноса глюкозных остатков из ГДФГ на акцептор-затравку. Выделен фермент, катализирующий такую реакцию. Аналогичные данные существуют и для синтеза клетчатки у одного из видов фасоли. Вместе с тем есть сведения, что в колеоптилях овса и у некоторых бактерий биосинтез целлюлозы идет с участием УДФГ. Не отрицается возможность функционирования УДФГ как донора глюкозных остатков при образовании клетчатки и у хлопчатника.
Биосинтез углеводных компонентов гликопротеинов. Для углеводных компонентов гликопротеинов характерно высокое содержание аминосахаров, ацетилглюкозамина и сиаловых кислот. У человека и большинства животных аминосахаpa образуются путем переноса амидной группы глутамина на фруктозо-6-фосфат с дальнейшим отщеплением Н3РO4 фосфатазой:
Фруктозо-6-фосфат + Глутамин → Глюкозамин-6-фосфат +
+ Глутаминовая кислота
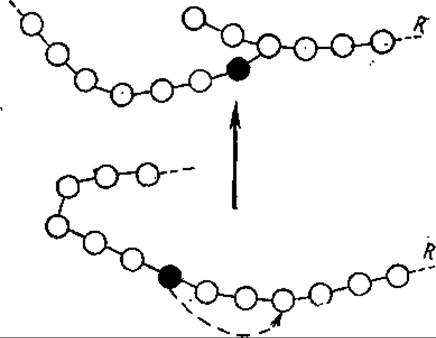
Рис. 6.9. Действие амило(1,4→1,6) - трансгликозилазы (фактор ветвления, Q-фермент).
Темным кружком обозначена глюкозная молекула, альдегидный углерод которой перенесен с образованием а(1—6)-связи в точке ветвления, R — фрагмент молекулы гликогена
У бактерий и насекомых, образующих из глюкозамина хитиновые покровы, вместо глутамина для синтеза глюкозамин-6-фосфата используется NH3. Ацетилглюкозамин образуется в результате переноса ацетил-группы с ацетил-КоА на глюкозамин-6-фосфат. Взаимодействие ацетилглюкозаминфосфата с УТФ дает УДФ-ацетил-глюкозамин (при этом выделяется пирофосфат), а изомеризация последнего — УДФ-ацетилманнозамин. В результате присоединения к ацетилманнозамину путем альдольной конденсации фосфоенолпирувата образуется фосфо-N-ацетилнейраминовая кислота, а из нее — N-ацетилнейраминовая.
Образование полимерных углеводных цепей гликопротеинов осуществляется, как и для всех полисахаридов, с участием НДФС. Так, при биосинтезе гиалуроновой кислоты донорами моносахаридных остатков являются УДФ-глюкуроновая кислота и УДФГ. В образовании гепарина и хондроитинсульфата важную роль играет УДФ-ксилоза, ибо связующим звеном комплекса этих углеводов с белками является как раз ксилоза. Синтез указанных углеводов начинается с перенесения ксилозы от УДФ-ксилозы на гидроксил серина в молекуле белка. Присоединение сульфатных остатков к компонентам гепарина и хондроитинсульфата катализирует особый фермент — мукополисахаридсульфотрансфераза, а донором сульфо-групп является 3-фосфоаденозин-5-фосфосульфат.
При биосинтезе тейхоевых кислот бактерий основная цепь строится путем переноса рибитфосфатных остатков от ЦДФ-рибита и ацетилглюкозаминных от УДФ-ацетилглюкозамина. Наращивание углеводного компонента происходит путем последовательного действия различных гликозилтрансфераз с их НДФС-коферментами: галактозилтрансферазы, фукозилтрансферазы, сиалилтрансферазы и т. д. Вопрос о механизме, определяющем порядок чередования моносахаридных остатков при синтезе, пока недостаточно ясен. Широкое участие НДФС в синтезе всех олиго- и полисахаридов сочетается с избирательной «специализацией» нуклеотидов-доноров. Так, донорами остатков галактозы, глюкозамина и мурамовой кислоты у животных являются УДФ-нуклеотиды, донорами L-фукозы и D-маннозы — ГДФ, глицерина и тивелозы — ЦДФ, N-ацетилнейраминовой кислоты — ЦМФ.
Участие полипренолфосфатов в биосинтезе полисахаридов. В 60—70-х годах XX в. был обнаружен и исследован новый тип переносчиков углеводных остатков при биосинтезе полисахаридов — полипренолфосфаты. Они имеют липидный характер, играют первостепенную роль при биосинтезе гликопротеинов, содержатся у всех живых организмов. Их открытие явилось крупнейшим событием в биохимии углеводов за последнее время.
Полипреноидные переносчики принимают углеводный остаток (моно- или олигосахаридный) от НДФС и передают его акцептору (например, бактериальному антигену). В ряде случаев синтез олигосахарида происходит на полипренолфосфате (ППФ).
В схеме процесс протекает следующим образом:
НДФС + ППФ → ППФ-сахар + НДФ
ППФ-сахар + Акцептор → ППФ + сахар-акцептор
По своему строению полипреноидные переносчики делятся на две группы: полипренолфосфаты и полипренолпирофосфаты. Группа полипренолпирофосфатов более многочисленна, они переносят в отличие от первых не только моносахаридные остатки, но и ди-, три-, тетрасахаридные. Обычная их функция — участие в биосинтезе олигосахаридных компонентов антигенов клеточной стенки бактерий.
Полипренолфосфаты имеют следующее схематическое строение:
![]()
Изопреновое звено, несущее гидроксил, через который идет присоединение фосфата, обычно гидрировано, насыщенно. У бактерий наиболее часто встречается ундекапренол (C55), имеющий 11 изопреновых остатков. Полипренолы высших растений содержат от 5 изопреновых остатков (древесина березы) до 16 (иглы хвойных). Еще более высокомолекулярны ППФ животных (n = 17—21). Наиболее распространенными из них являются долихолы, к ним относятся те полипренолы, у которых а-изопреновый остаток, несущий гидроксильную группу, насыщен:
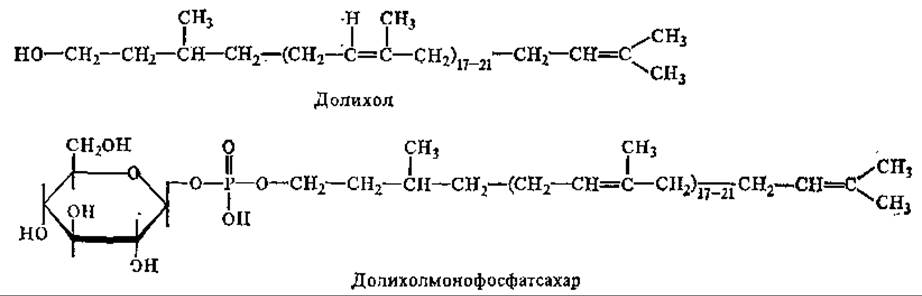
С участием долихолфосфатов происходит образование «ядра» (кор) олигосахарида и его встраивание в гликопротеины через N-гликозидные связи. Для ядер характерно высокое содержание маннозы и ацетилглюкозамина. Синтез олигосахарида завершается гликозилтрансферазами уже без участия долихолфосфата. Гликозилирование белков протекает в аппарате Гольджи. Если же белок синтезируется на свободных, а не на связанных с мембранами полисомах, то он, как правило, не подвергается гликозилированию.
Есть сведения, что функции переносчиков углеводных остатков, подобно полипренолам, могут выполнять витамины А и К.
6.6.3. Расщепление олиго- и полисахаридов. Расщепление олиго- и полисахаридов происходит путем гидролиза и фосфоролиза. Для ферментов гидролиза углеводов характерна стереоспецифичность. Так, гидролиз сахарозы осуществляет фермент ß-фруктофуранозидаза, или сахараза (инвертаза), который разрывает связь, находящуюся у ß-глюкозидного С-атома остатка фруктозы. Инвертаза содержится в высших растениях, микроорганизмах, в пищеварительных соках животных, особенно она активна в дрожжах. Расщепление сахарозы может происходить и под действием а-глюкозидазы, но в этом случае разрывается связь у а-глюкозидного С-атома остатка глюкозы:
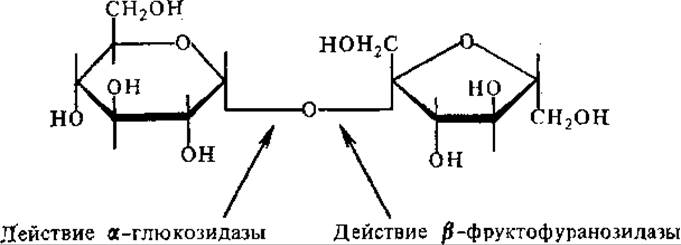
Расщепление сахарозы может также происходить под действием сахарозосинтазы в результате обращения реакции (см. с. 347). Именно таким, путем сахароза вовлекается в метаболизм корнеплода сахарной свеклы. Обратимость реакции обеспечивает экономное расходование сахарозы, так как в случае недостаточно быстрого использования продуктов ее расщепления тот же фермент переводит их избыток обратно в сахарозу, т. е. осуществляется принцип саморегулирования.
И, наконец, у микроорганизмов расщепление сахарозы может происходить путем фосфоролиза (реакция 3).
Гидролиз лактозы на глюкозу и галактозу происходит при участии лактазы (ß-галактозидаза). Она содержится в молочной железе животных, в лактозных дрожжах, вызывающих брожение различных молочных продуктов, у бактерий, плесневых грибов.
Дисахарид мальтоза подвергается гидролизу под действием фермента а-глюкозидазы, или мальтазы, которая содержится в тканях растений, в плесневых грибах, дрожжах, бактериях, в пищеварительном соке человека и животных. Особенно активна мальтаза в солоде. У бактерий возможно расщепление мальтозы мальтозофосфорилазой.
Гидролиз целлобиозы осуществляет ß-глюкозидаза.
Расщепление крахмала и гликогена также может быть гидролитическим и фосфоролитическим. Гидролиз происходит под действием ферментов амилаз.
В настоящее время установлено наличие трех амилаз: а-амилазы, ß-амилазы и глюкоамилазы, которые различаются по своим свойствам, распространению в природе и способу действия на крахмал (гликоген) (рис. 6.10).
а-Амилаза является эндоамилазой. Она беспорядочно разрывает а(1→4)-связи внутри цепей амилозы, амилопектина и гликогена. В качестве продуктов реакции образуется большое количество декстринов различной молекулярной массы. Среди конечных продуктов реакции образуется также небольшое количество мальтозы, мальтотриозы и глюкозы. а-Амилаза содержится в слюне, соке поджелудочной железы, в проросших семенах злаков, в плесневых грибах и бактериях. В непроросших семенах а-амилаза обнаруживается крайне редко. Она чувствительна к подкислению, но термостабильна.
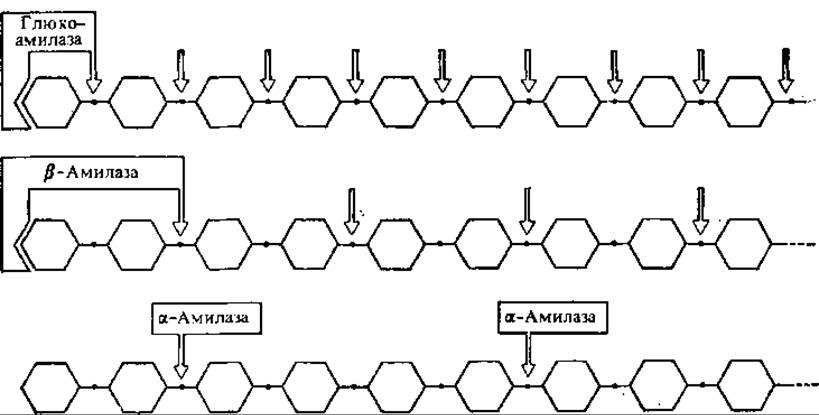
Рис. 6.10. Действие различных амилаз на линейные участки крахмала
ß-Амилаза гидролизует амилозу, амилопектин и гликоген с нередуцирующего конца, отщепляя остатки мальтозы. Под действием ß-амилазы амилоза на 100% превращается в мальтозу. У амилопектина и гликогена она атакует только наружные цепи, в результате чего образуются мальтоза и ß-конечный декстрин. ß-Амилаза содержится в непроросших семенах пшеницы, ржи, ячменя.
Гидролиз крахмала под действием амилаз имеет большое значение в технологии хлебопечения, пивоварения, производства спирта, текстильной промышленности.
Глюкоамилаза гидролизует крахмал с образованием глюкозы и небольшого количества декстринов. Препараты глюкоамилазы выделяют из плесневых грибов и используют для получения из крахмала глюкозной патоки и кристаллической глюкозы.
Ни одна из перечисленных выше амилаз не способна разрывать а (1→6)-связи. Расщепление этих связей осуществляет изоамилаза (R-фермент).
Вторым путем расщепления крахмала и гликогена является фосфоролиз.
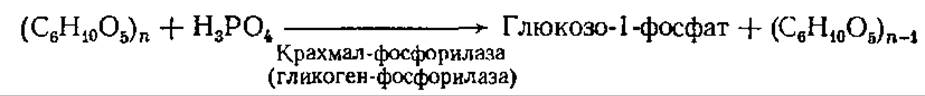
В этой реакции от нередуцирующего конца отщепляется один остаток глюкозы и соединяется с фосфорной кислотой, образуя глюкозо-1-фосфат. Процесс повторяется многократно, пока вся молекула крахмала или гликогена не будет расщеплена до точек ветвления. Этот путь диссимиляции является энергетически более выгодным, чем гидролиз, так как глюкоза оказывается уже в активированной форме (глюкозо-1-фосфат) и легко вступает в различные реакции. Действию а-глюканфосфорилазы подвергаются только а(1→4)-связи и реакция останавливается, как только фермент дойдет до точки ветвления. Образуется остаточный декстрин. Для того чтобы расщепление возобновилось, необходим другой фермент — изоамилаза, разрывающий 1,6-связи и тем самым открывающий для действия крахмал (гликоген)-фосфорилаэы новый участок полисахаридной цепи.
Гидролитическое расщепление клетчатки (целлюлозы) с образованием целлобиозы осуществляет фермент целлюлаза. Последний представляет собой комплекс двух ферментов — эндоглюканазы и экзоглкжаназы. Они содержатся в проросшем зерне, в некоторых бактериях и плесневых грибах, растущих на древесине.
В прорастающих семенах и плесневых грибах найдены гемицеллюлазы — ферменты, гидролизующие различные гемицеллюлозы до отдельных моносахаридов. Например, плесневый гриб Aspergillus niger содержит ксиланазу, расщепляющую ксиланы до ксилозы.
Кроме перечисленных известен ряд других гликозидаз, катализирующих расщепление О-, N- или S-гликозидных связей в различных гликозидах и углеводсодержащих соединениях (гликопротеины, гликолипиды, протеогликаны).
В тканях человека и животных гликозидазы содержатся в основном в лизосомах. При отсутствии или частичной недостаточности какой-либо лизосомной гликозидазы или одной из ее молекулярных форм развиваются гликозидозы (лизосомные болезни накопления) — группа наследственных болезней, связанных с нарушением распада углеводсодержащих соединений.