Основы биохимии - А. А. Анисимов 1986
Белки
Строение белковой молекулы
2.4.1. Полипептидное строение белков. Первые белковые вещества выделили более 250 лет назад, а во второй половине XVIII — начале XIX вв. уже неоднократно описывали белковые вещества растений и животных.
В настоящее время хорошо известен химический элементарный состав белков. Они обычно содержат 50—55% С, 21—23% O2, 15—17% Na, около 7% Н2, от 0 до 3% S. В сложные белки, кроме того, могут входить Р и некоторые металлы.
Значительно более сложным является вопрос структуры белковых молекул. Глубокие и очень интересные для своего времени исследования структуры белков были проведены выдающимся русским биохимиком, одним из основоположников отечественной биохимии А. Я. Данилевским (1838—1923) в 80-х годах прошлого столетия. Исследуя продукты расщепления белков под влиянием слабых щелочей, особенности биуретовой реакции, типичной для белков и некоторых продуктов их распада, он высказал ряд интересных идей по поводу строения белковой молекулы. Молекула белка, по А. Я. Данилевскому, состоит из достаточно похожих по строению цепей, в которых чередуются атомы С и N («углеазотные цепи», «элементарные ряды»), с которыми соединены аминокислоты.
А. Я. Данилевский впервые в науке указал на полимерный характер строения белков. Большой интерес представляло его утверждение, что расщепление белка имеет гидратационный характер, т. е. идет путем гидролиза. Эти идеи А. Я. Данилевского несомненно были еще очень далеки от современной теории строения белков, но они уже представляли собой ее начало.
Решающий шаг в создании полипептидной теории строения белковой молекулы сделал крупнейший немецкий химик-органик и биохимик Э. Фишер (1852—1919). Гидролизуя белки соляной кислотой и ферментами, а затем исследуя продукты расщепления, он пришел к заключению, что белковая молекула образована большим числом аминокислотных остатков. Чтобы определить, каким образом они соединены между собой, Э. Фишер пошел по пути искусственного синтеза белковоподобных молекул из аминокислот. Так как свободные аминокислоты при сливании их растворов не взаимодействуют, он использовал их галогенацилпроизводные в качестве исходного материала для синтеза. Условия синтеза были таковы, что аминогруппа одной аминокислоты реагировала с карбоксилом другой, образуя пептидную связь —СО—NH— (на присутствие в белковой молекуле такого типа связей указывал еще А. Я. Данилевский, называя их биуретовыми). Таким путем ему удалось объединить в одну молекулу до 19 аминокислотных остатков. Сравнение свойств этих искусственно синтезированных соединений с пептидами — продуктами неполного расщепления природных белков — показало большое сходство. Это доказывало, что и в природных белках аминокислоты соединены друг с другом пептидными связями.
По современным данным, наиболее часто в составе различных белков обнаруживают 20 видов аминокислот. Именно для 20 аминокислот существует генетический код в виде триплетов (тройки нуклеотидов в ДНК). Иногда в белках присутствуют и другие аминокислоты, они образуются в результате модификации белков уже после их биосинтеза, являются некодируемыми (цистин, гидроксипролин, гидроксилизин и некоторые другие). В составе белков обнаружены только а-аминокислоты, в подавляющем большинстве в L-конфигурации.
Аминокислоты соединяются друг с другом ковалентной пептидной или амидной связью. Образование ее происходит за счет аминогруппы (—NH2) одной аминокислоты и карбоксильной группы (-СООН) другой с выделением молекулы воды.
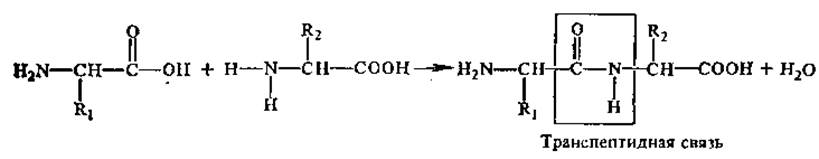
Наиболее распространена в природе транс-пептидная связь, реже встречается менее устойчивая цис-пептидная связь. Пептидная связь является частично двойной, частично одинарной, между этими структурами есть взаимный переход. Время жизни одинарной связи несколько больше, чем двойной (6:4), можно сказать, что пептидная связь на 60% одинарна и на 40% двойная.
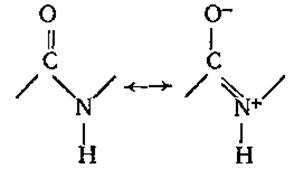
В результате явления резонанса образуется флуктуирующая, динамическая связь, которую невозможно описать на основе одной валентной структуры. Так как вращение вокруг двойной связи заторможено, все атомы пептидной связи оказываются расположенными примерно в одной плоскости, т. е. она планарна, только вокруг атома азота связи отчасти сохраняют пирамидальный характер. К настоящему времени установлены все валентные углы и длины связей в пептидных группировках (рис. 2.7).
Образованные аминокислотами полимеры называют пептидами или белками в зависимости от числа входящих в них структурных единиц. Условно принято, что пептиды, содержащие до 20 аминокислотных остатков, относятся к олигопептидам, среди них различают ди-, три-, тетрапептиды и т. д. Полипептиды имеют в молекуле от 20 до 50 аминокислотных остатков. Пептидные цепи, объединяющие более 50 аминокислот и имеющие молекулярную массу свыше 6 тыс., относятся к белкам.
Самый низкомолекулярный белок — гормон инсулин, состоящий из 51 аминокислотного остатка. Число аминокислотных звеньев в белке может доходить до нескольких сотен и даже тысяч. Количество видов белков в природе огромно, их разнообразие связано с различным набором аминокислот, входящих в белок, и порядком их чередования в молекуле. Так, уже из трех аминокислот можно получить 6 различных трипептидов, из четырех — 24 тетрапептида, пяти — 120 пента пептидов, из 11—40 млн. изомеров, а из 20 разных аминокислот, каждая из которых встречается только один раз, теоретически может образовываться астрономическое число (2⋅1018) изомеров. Однако в живой природе реализуется только малая доля возможных изомеров.
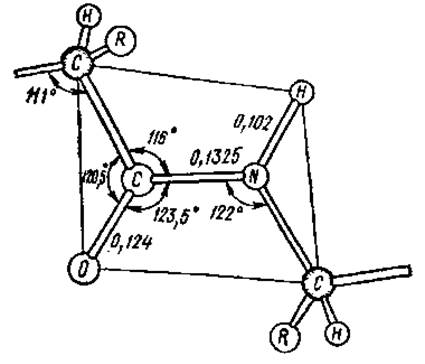
Рис. 2.7. Межатомные расстояния (нм) и углы в пептидной связи. Все атомы внутри рамки находятся примерно в одной плоскости
Для описания строения белковых молекул были введены понятия о первичной, вторичной, третичной и четвертичной структурах. В последние годы добавлены еще два уровня: сверхвторичная структура и домены, которые занимают место между вторичной и третичной структурами.
2.4.2. Первичная структура. Под первичной структурой белковой молекулы понимают порядок чередования аминокислот в полипептидной цепи (или цепях) и местоположение. дисульфидных связей. Полипептидная цепь содержит на одном конце свободную аминогруппу (N-конец), на другом — карбоксильную группу (С-конец). За начало цепи принимается ее N-конец, именно отсюда начинается отсчет аминокислот. Это совпадает с направлением синтеза полипептидной цепи на рибосоме, которое в свою очередь отвечает направлению 5'→3' мРНК (см. разд. 4.4.3).
Аминогруппа на N-конце полипептидной цепи может быть иногда ацетилированной, присоединившей остаток уксусной кислоты (СН3—СО—NH—...), как например, в цитохроме с1, овальбумине, лактатдегидрогеназе, актине, миозине. Блокированные за счет ацетилирования N-концы характерны также для белков оболочки многих растительных вирусов, некоторых вирусов животных и бактерий. Формилирование а-аминогруппы обнаружено в пчелином яде мелиттине, гемоглобине миноги, метилирование — в рибосомных белках Е. coli. В ряде белков (гормоны, легкая и тяжелая цепи иммуноглобулинов) N-концевым является остаток пирролидонкарбоновой кислоты (пироглутаминовой кислоты), не содержащей свободной аминогруппы.
На С-конце встречается либо свободная карбоксильная группа (у большинства белков), либо амидированная (некоторые гормоны, пчелиный яд). Модификации С-конца более редки по сравнению с N-концевыми модификациями.
Названия отдельных пептидов образуются в соответствии с составляющими их аминокислотными остатками, начиная с N-конца. При этом в названиях всех аминокислот, за исключением последней, меняется окончание на «ил». Например, L-аланил-L-цистеил-L-метионин. Полная аминокислотная последовательность белков указывается в виде сокращенных названий аминокислот. Принято трехбуквенное и однобуквенное обозначение аминокислот (табл. 2.3).
Таблица 2.3. Обозначения аминокислотных остатков, входящих в состав пептидов и белков
Полное название аминокислоты |
Сокращенное название |
|
трехбуквенное |
однобуквенное |
|
Глицин |
Гли, Gly |
G |
Аланин |
Ала, Ala |
А |
Валин |
Вал, Val |
V |
Лейцин |
Лей, Leu |
L |
Изолейцин |
Иле, Не |
I |
Пролин |
Про, Pro |
p |
Фенилаланин |
Фен, Phe |
F |
Тирозин |
Тир, Туr |
Y |
Триптофан |
Tpu, Тrр |
W |
Серин |
Сер, Ser |
S |
Треонин |
Тре, Thr |
T |
Аспарагиновая кислота |
Асп, Asp |
D |
Глутаминовая кислота |
Глу, Glu |
E |
Аспарагин1 |
Асн, Asn |
N |
Глутамин1 |
Глн, Gln |
Q |
Цистеин |
Цис, Cys |
c |
Метионин |
Mem, Met |
M |
Гистидин |
Гис, His |
H |
Лизин |
Лиз, Lys |
к |
Аргинин |
Арг, Arg |
R |
1 Если неизвестно, аминокислота или ее амид имеется в цепи белка, используют следующие обозначения: Асх (Аsx) или В и Глх (Glx) или Z.
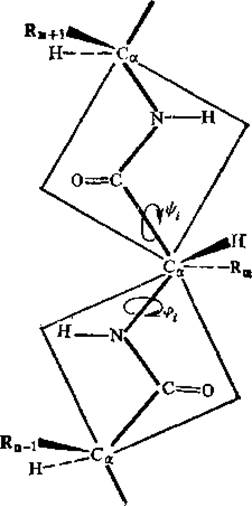
Рис. 2.8. Торсионные углы у а-углеродного атома в пептидной цепи
Основная связь первичной. структуры белков — (пептидная связь). Эта связь достаточно жесткая и поэтому конформационная подвижность ее ограничена. Однако в каждом аминокислотном звене есть а- углеродный атом, который обусловливает присутствие в этом звене двух одинарных связей; вокруг этих связей возможно вращение. Углы вращения одинарных связей называются торсионными и обозначаются через φ (N — Са) и φ (С — Са) (рис. 2.8). Число возможных комбинаций торсионных углов велико, и многие из них реализуются в белках. Исключение составляют такие пары углов, которые стерически невозможны вследствие близкого пространственного расположения атомов соседних пептидных групп и боковых радикалов аминокислотных остатков.
В настоящее время с помощью вычислительных машин и молекулярных моделей просматривают всю область возможных значений φ и ψ, результаты такого анализа представляют в виде графиков зависимости φ от ψ, которые получили название конформационных карт или графиков Раманандрана.
На сегодня задача установления аминокислотной последовательности решена примерно для 2000 белков: цитохромов, ферредоксинов, иммуноглобулинов, белков рибосом, гемоглобинов, большого числа ферментов. Первым был расшифрован инсулин быка (Ф. Сэнгер, 1951 —1953), за эти работы была присуждена Нобелевская премия. Одним из крупных белков, для которого установлена первичная структура, является фермент аспартатаминотранс- фераза (М 93 000). Одна полипептидная цепь этого фермента — димера состоит из 412 аминокислотных остатков. Его структура расшифрована в совместной работе двух лабораторий, руководимых Ю. А. Овчинниковым и А. Е. Браунштейном, в 1971 г.
Последовательность изучения первичной структуры белков такова. 1. Расщепление полипептидной цепи белка на более короткие фрагменты по определенным положениям в его последовательности. 2. Установление порядка чередования аминокислот в полученных фрагментах-пептидах. 3. Определение расположения пептидов с известной аминокислотной последовательностью в белковой молекуле.
Расщеплению полипептидной цепи на фрагменты должен предшествовать разрыв дисульфидных мостиков и модификация остатков цистеина. Для расщепления белков на фрагменты применяют селективный гидролиз с помощью протеолитических ферментов (трипсин, химотрипсин и др.), разрывающих пептидные связи, которые образованы определенными аминокислотами, или химических агентов, также обладающих избирательностью действия. Трипсин расщепляет пептидные связи, карбонильная группа которых принадлежит лиз или гар, а химотрипсин гидролизует пептидные связи, в образовании которых принимает участие карбоксильная группа ароматических аминокислот — тир, фен и три.
Протеолитические ферменты, применяющиеся для селективного гидролиза, обычно предварительно иммобилизуют, т. е. связывают с нерастворимой матрицей, чтобы облегчить последующее отделение ферментов от продуктов гидролиза.
Среди химических реагентов, применяющихся для избирательного гидролиза, наиболее удачными являются бромциан, расщепляющий пептидные связи, карбонильная группа которых принадлежит остаткам мет, а также N-бромсукцинимид, разрывающий связи после три.
В результате селективного гидролиза получается набор пептидов, из которого затем каждый пептид должен быть получен в индивидуальном виде. Для фракционирования пептидов используют преимущественно высоковольтный (до 10 000 В) электрофорез и хроматографию (в основном, ионообменную, распределительную, молекулярно-ситовую) или сочетание указанных методов, например метод пептидных карт, или «отпечатков пальцев». Последний метод заключается в том, что смесь пептидов наносят на лист хроматографической бумаги и проводят в одном направлении распределительную хроматографию, а в другом, перпендикулярном первому, — электрофорез.
Для установления порядка чередования аминокислот в пептидах разработан ряд методов, позволяющих исследовать аминокислотную последовательность как с N-, так и с С-конца молекулы. Одним из самых распространенных реагентов, используемых для N-концевого анализа пептидов, является фенилизотиоцианат (ФИТЦ), впервые примененный П. Эдманом. В результате реакции ФИТЦ с NH2-гpyппoй пептидов образуется продукт — фенилтиокарбамильное производное аминокислоты, или ФТК-производное. В кислой среде продукт циклизуется, что приводит к разрыву пептидной связи и отделению от остального пептида фенилтиогидантоинового производного N-концевой аминокислоты (ФТГ-производное). Полученные ФТГ-производные идентифицируют с использованием различных вариантов метода хроматографии, и таким образом устанавливают первую аминокислоту в пептиде. Повторяя обработку ФИТЦ укороченного пептида, определяют следующий аминокислотный остаток и т. д. Реакции, лежащие в основе метода Эдмана, таковы:
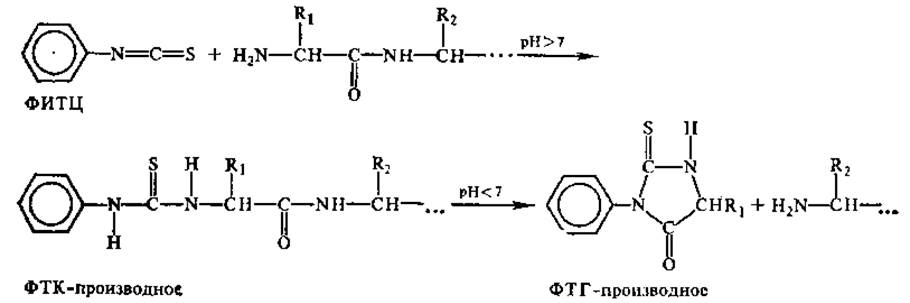
Принцип метода Эдмана используют в приборах — секвенаторах, позволяющих автоматически определять последовательность аминокислот в пептиде, включающем несколько десятков остатков. Специфическим реагентом на свободные NH2-гpyппы в белках является и динитрофторбензол (ДНФБ), использованный впервые Ф. Сэнгером и примененный им для установления N-концевых аминокислот в пептидах. Реакция протекает следующим образом:
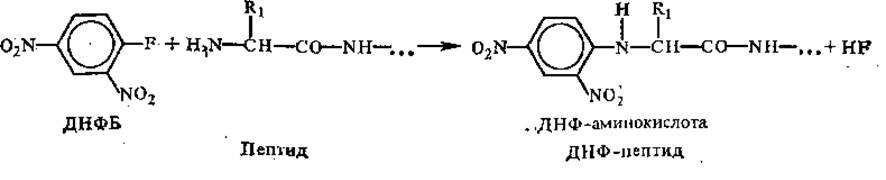
Кислотный гидролиз динитрофенилированного пептида приводит к разрыву всех пептидных связей в молекуле и высвобождению динитрофенилированной N-концевой аминокислоты, которую идентифицируют хроматографическими методами с применением метчиков: ДНФ-аминокислот.
Для расшифровки аминокислотной последовательности пептидов с N-конца могут быть применены ферменты аминопептидазы, последовательно отщепляющие аминокислоты со свободной аминогруппой. Используя хроматографические методы, идентифицируют аминокислоты и определяют скорость их накопления в гидролизате, на основании чего получают представление о чередовании аминокислот на N-конце пептида.
Аналогичный подход используют при расшифровке С-концевой последовательности аминокислот с применением ферментов карбоксипептидаз, отщепляющих аминокислоты со свободной карбоксильной группой. Информацию о С-концевой аминокислоте можно получить, расщепляя пептидные связи в белках путем гидразинолиза. Этот метод, предложенный С. Акабори, основан на реакции полипептида с гидразином в безводной среде при 100°С.
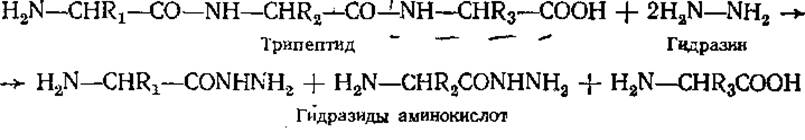
В гидразиды аминокислот превращаются все аминокислотные остатки, за исключением несущего свободную карбоксильную группу. Он получается в виде свободной аминокислоты, выделяется и идентифицируется хроматографически.
Для анализа последовательности аминокислот как с N-, так и С-конца в предварительно модифицированных олигопептидах применяют метод масс-спектрометрии.
Для установления полной аминокислотной последовательности в белках необходимо знать порядок чередования пептидов в молекуле. Это решается логическим методом, получившим название метода «перекрывающихся пептидов». Он может быть применен в том случае, если известна первичная структура пептидов, полученных после гидролиза белка, по меньшей мере, с использованием двух различных видов селективного гидролиза. По «перекрывающимся» фрагментам определяют порядок следования пептидов.
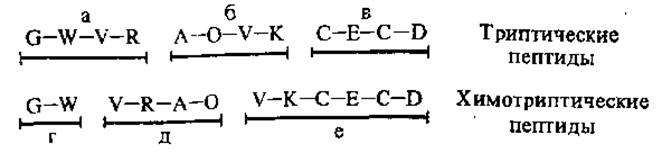
Например, пептид а триптического гидролизата содержит полную последовательность пептида г и часть пептида д химотрипти-
ческого гидролизата. Следовательно, в белковой молекуле пептид д следует непосредственно за пептидом г. Аналогично устанавливается относительное расположение остальных пептидов (G, W. и т. д. — сокращенные названия аминокислот).
Первичная структура белка может быть установлена косвенно, по строению кодирующего его гена: по чередованию в нем нуклеотидов. С помощью этого приема в сочетании с указанными выше методами установления порядка чередования аминокислот в белках группа советских ученых во главе с Ю. А. Овчинниковым расшифровала первичную структуру РНК-полимеразы — крупного белка, состоящего приблизительно из 4000 аминокислот.
Расшифровка первичной структуры белков включает также определение аминокислотного состава и установление мест локализации дисульфидных связей. Качественный и количественный аминокислотный состав белков устанавливают после их гидролиза до мономеров и применения специальных приборов — автоматических анализаторов аминокислот. В этих приборах на колонках с ионообменными смолами аминокислоты разделяются, последовательно вымываются и количественно анализируются с помощью нингидрина или более чувствительного реагента — флуорескамина, образующего с аминокислотами флуоресцирующие продукты.
Установление мест локализации дисульфидных мостиков в белке проводят в процессе выяснения полной аминокислотной последовательности. Для этого перед проведением селективного гидролиза в белке модифицируют все свободные SH-группы. Пептиды, содержащие S—S-связи, выделяют и обрабатывают реагентами, вызывающими разрыв дисульфидных мостиков. Образовавшиеся пептиды разделяют и определяют аминокислотную последовательность каждого с помощью указанных выше методов.
Заканчивая рассмотрение основных этапов и методов, применяющихся при изучении первичной структуры белков, необходимо подчеркнуть, что самой начальной процедурой является определение числа полипептидных нитей в белковой молекуле — протомеров, Заключение об этом обычно делают на основании числа NH2- концевых остатков, приходящихся на молекулу белка. Если в белке более одной полипептидной цепи, то их отделяют друг от друга, например, с помощью детергентов, а затем разделяют и очищают путем электрофореза или хроматографии.
Результаты расшифровки первичной структуры, полученные в настоящее время для большого числа белков, уже позволяют сделать некоторые обобщения. Несмотря на большое разнообразие свойств отдельных белков и различия в первичной структуре, есть некоторое сходство в количественном составе аминокислот. Для преобладающего числа белков характерно присутствие всех 20 видов аминокислот, из которых особенно много обычно глицина, аланина, аспарагиновой и глутаминовой кислот, мало — триптофана, гистидина, метионина, аргинина. Аминокислоты с углеводородными боковыми группами составляют обычно 30—40% от общего числа аминокислот. Исключением из этой обобщенной характеристики количественного состава аминокислот разных белков являются лишь некоторые группы белков: гистоны, протамины и протеиноиды. У них могут отсутствовать некоторые виды аминокислот, количественно преобладать определенные аминокислоты (аргинин — у гистонов и протаминов, гидроксипролин — у протеиноидов).
Анализ большого числа белков с изученной первичной структурой показал, что в глобулярных белках отсутствуют какие-либо общие закономерности чередования аминокислот (нельзя, например, сказать, что за аминокислотой X во всех белках следует аминокислота Z, у каждого белка свой характер чередования). Вместе с тем природа, видимо, не пошла по пути реализации существования всего того колоссального разнообразия белков, которое теоретически может быть образовано двадцатью видами аминокислот. Как указывает Ф. Шорм (Чехословакия), даже у далеких по биологической активности белков — гормона инсулина и фермента рибонуклеази — имеются одинаковые небольшие фрагменты молекул: три тождественных трипептида, один тождественный тетрапептид, пять аналогичных трипептидов, отличающихся только одной аминокислотой, при этом отличающиеся аминокислоты близки по строению (например, вместо ала — вал, вместо асп — глу).
Расположение аминокислот в белках, так же как и образующаяся на его основе пространственная структура, закреплены генетически и приспособлены к выполнению определенной биологической функции. Аминокислотная последовательность белков, ответственных за одну и ту же биологическую функцию, часто близка для разных видов. Такие белки, одинаковые или сходные по строению и выполняющие у разных организмов одинаковые функции, называются гомологичными. Так, все инсулины позвоночных состоят из двух цепей (А и В), включающих 51 аминокислотный остаток. В A-цепи инсулинов разных животных единичные различия в аминокислотной последовательности имеют место, в основном, в положениях 4, 8, 9, 10, 13, 14, 15 и 18. Эти аминокислоты называются вариабельными, другие аминокислоты, как правило, не подвергаются заменам. В цитохромах с 35 остатков из 104 одинаковы у всех видов, причем число аминокислотных замен находится в прямой зависимости от их филогенетического родства. В то время как цитохромы с позвоночных животных и дрожжей различаются между собой по 43—48 аминокислотам, цитохромы с человека и обезьяны имеют только одну замену, а молекулы этого белка у курицы и индейки идентичны.
Изучение первичной структуры гомологичных белков, выделенных из различных видов живых организмов, является одним из методов современной таксономии.
Различия в структуре гомологичных белков также дают ценную информацию о роли отдельных аминокислотных остатков в функционировании молекулы. Остатки, находящиеся в активных участках или определяющие конформацию полипептидной цепи, не могут быть изменены генетически или путем химической модификации без влияния на функцию. Так, известные в настоящее время вариации первичной структуры в цитохроме с разных видов живых организмов не связаны со значительными изменениями функциональных свойств белка, поскольку наименее изменяемыми являются участки вблизи связывания гема, а также участки, ответственные за пространственную укладку цепи.
Большинство аминокислотных замен, делений или вставок обычно происходит на поверхности белковой глобулы, поскольку наружные остатки менее существенны для стабильности белка. Однако эти изменения обычно наблюдаются на участках, менее существенных для проявления функциональных свойств. По вариабельности аминокислотного остатка в гомологичных белках можно судить о местонахождении данного остатка — на поверхности или внутри белка.
На ряде ферментов показано, что по отношению к некоторым заменам, делениям и вставкам аминокислот функции белков устойчивы. В белках есть фрагменты полипептидной цепи, которые можно удалить, и при этом функция не нарушится. Малосущественными заменами в большинстве случаев являются замены одних аминокислотных остатков на другие с близкими свойствами, например, взаимозамена алифатических гидрофобных остатков (иле на вал или лей, мет и т. д.), полярных (арг на лиз, глу на асп, глн на асн). Замещение на остаток с другим типом боковой цепи очень существенно, если происходит в области молекулы, ответственной за проявление функции и конформацию.
Возможность замен в первичной структуре гомологичных белков не является общим правилом для всех белков. Существуют и консервативные белки, к ним, например, относится гистон Н4, отличающийся у растений и животных лишь двумя аминокислотными остатками из 102. Очевидно, каждый остаток в гистоне Н4 критичен для его функции, а эволюция этого «древнего» белка закончилась на раннем этапе существования организмов.
Наряду с явлением дивергенции (по первичной структуре) белков, выполняющих одинаковые функции у различных организмов, в биохимии известно и явление конвергенции, когда белки с аналогичными функциями не гомологичны по структуре. Например, гидролиз пептидной связи осуществляют ферменты разных типов, отличающиеся по структуре активного центра и механизму катализа. Панкреатические протеиназы (трипсин, химотрипсин и др.) и субтилизин (протеиназа из Вас. subtilis) имеют различные первичные структуры и конформации, но близкий механизм реакции.
Установление чередования аминокислот в белках показало также, что в процессе эволюции происходило удвоение и слияние генов. С дупликации соответствующих генов обычно начинается дифференциация белков. Продукты этих генов постепенно могут выполнять различные функции. Аналогичные последовательности и пространственную структуру имеют, например, а-лактальбумин и лизоцим, являющиеся ярким примером дифференциации белков.
Таким образом, изучение первичной структуры белков дает нам ценную информацию о ходе эволюции, помогает в установлении филогенетических взаимоотношений между отдельными видами живых организмов, а также доказывает непрерывность эволюционного процесса. Последний вывод может быть сделан на основании того, что аминокислотные последовательности определенного белка не всегда полностью идентичны у каждой особи данного вида. Такой полиморфизм является результатом непрерывно происходящих мутаций в геноме данного вида. Полезные для вида мутации закрепляются в потомстве. Мутации, вызывающие нарушение функций белка, приводят к появлению наследственных болезней.
2.4.3. Роль слабых взаимодействий в образовании пространственной структуры биополимеров. Пространственная организация макромолекул и клеточных структур осуществляется в основном при помощи химических связей, значительно более слабых, чем ковалентные. Атомы, связанные ковалентно, способны к дополнительным слабым взаимодействиям с другими атомами как в пределах одной молекулы, так и с атомами близлежащих молекул. Слабые взаимодействия участвуют в образовании формы молекул сложных биополимеров (белков, нуклеиновых кислот), их пространственной структуры, а также определяют степень прочности последней.
К слабым взаимодействиям, иногда их называют вторичными связями, относят: водородные и ионные связи, ван-дер-ваальсовы силы, гидрофобные взаимодействия. Прочность химической связи может быть охарактеризована изменением свободной энергии, ∆G (см. разд. 1.3.2), которое происходит при ее образовании. Для слабых взаимодействий она находится в пределах 4—30 кДж/моль, в то время как ковалентные связи очень прочные, свободная энергия их образования составляет 200—450 кДж/моль. Прочность связи коррелирует с расстоянием между атомами: чем прочнее связь, тем меньше это расстояние. Ковалентные связи самые короткие — 0,10—0,18 нм, при слабых взаимодействиях межатомное расстояние составляет 0,20—0,45 нм.
Важную роль в образовании структуры биологических макромолекул играют водородные связи. Они возникают между двумя электроотрицательными атомами, когда протон водорода, ковалентно связанный с одним из этих атомов, располагается между ними. Электроотрицательными (т. е. обладающими повышенной способностью притягивать электроны) являются атомы О, N, F, реже в образовании водородных связей участвуют Сl и S. Атом водорода содержит единственный электрон, и когда последний уходит на образование ковалентной связи, ядро остается без электронных слоев. Такой водород, т. е. протон, не отталкивается, естественно, электронными облаками соседних атомов, а наоборот, притягивается ими, образуя водородную связь.
Обязательное условие образования водородной связи — наличие у электроотрицательного атома хотя бы одной свободной пары электронов, к которым будет притягиваться атом водорода. Электроотрицательные атомы обладают повышенным сродством к электронам, поэтому они заполняют электронами весь внешний слой (8 электронов), как бы перегружаясь отрицательными зарядами. При этом если возникает пара свободных электронов, она взаимодействует с протоном. Ниже приведен пример водородной связи, где δ+ — избыток положительного или отрицательного заряда, а пунктиром обозначены водородные связи:
![]()
Водородные связи характеризуются низкой энергией образования (около 20 кДж/моль), они длиннее ковалентных (0,26— 0,31 нм). Атом водорода, образующий водородную связь, находится не на равном расстоянии от электроотрицательных атомов, а ближе к тому атому, с которым образована ковалентная связь.
Водородные связи имеют направленный характер. В наиболее прочных водородных связях атом водорода расположен по прямой, соединяющей донорные и акцепторные атомы. Если же водородная связь располагается под углом к ковалентной, то ее энергия выражается меньшей величиной. Белковая молекула имеет два вида водородных связей; между группами пептидных связей и между боковыми радикалами аминокислот.
Водородные связи могут быть внутримолекулярными и межмолекулярными. Целый ряд жидкостей (вода, органические кислоты, спирты и др.) являются ассоциированными благодаря образованию межмолекулярных водородных связей. Углерод не способен к образованию водородных связей, потому что его электроотрицательность значительно меньше, чем у О или N, она довольно близка к Н. Поэтому углеводородные цепи гидрофобны, они с трудом проникают в воду, так как не могут разорвать ее водородные связи.
У соединений с группами —ОН, —NH2, —СООН, ![]() хорошо выражена способность к образованию водородных связей, они гидрофильны. Молекулы воды, находящейся в состоянии льда, связаны друг с другом водородными связями. При этом каждые шесть молекул образуют кольцеобразную шестичленную структуру. В жидкой воде также, видимо, имеются льдоподобные кластеры (группировки, ассоциации), которые непрерывно распадаются и вновь возникают. Молекулы воды образуют водородные связи не только между собой, но и с полярными группами растворенных соединений. Полярность молекулы воды, способность образовывать водородные связи очень важны в ее роли биологического растворителя — основной среды живых клеток.
хорошо выражена способность к образованию водородных связей, они гидрофильны. Молекулы воды, находящейся в состоянии льда, связаны друг с другом водородными связями. При этом каждые шесть молекул образуют кольцеобразную шестичленную структуру. В жидкой воде также, видимо, имеются льдоподобные кластеры (группировки, ассоциации), которые непрерывно распадаются и вновь возникают. Молекулы воды образуют водородные связи не только между собой, но и с полярными группами растворенных соединений. Полярность молекулы воды, способность образовывать водородные связи очень важны в ее роли биологического растворителя — основной среды живых клеток.
Единичные водородные связи, образованные в водном растворе, очень слабы, что объясняется конкуренцией молекул воды с молекулами растворенного вещества за образование водородных связей. Однако если в макромолекуле существует большое число водородных связей, возникает очень большая их суммарная прочность. Это явление называют кооперативностью водородных связей.
Не менее важны в стабилизации структуры биополимеров и их функционировании гидрофобные взаимодействия. Молекулы воды, стремясь образовывать между собой водородные связи, выталкивают гидрофобные группы и молекулы, находящиеся в воде, заставляя их скучиваться, образовывать ассоциаты. Этот процесс идет самопроизвольно, свободная энергия системы при этом уменьшается, так как слой воды у поверхности гидрофобных групп по сравнению с остальной массой воды имеют большую степень структурированности, меньшую энтропию (мера неупорядоченности), а при объединении гидрофобных групп их общая поверхность уменьшается. При этом никаких особенных связей между гидрофобными группами или молекулами не образуется (возможно только возникновение ван-дер-ваальсовых сил притяжения), вследствие чего чаще говорят о гидрофобных взаимодействиях, а не связях.
Наиболее слабые связи между молекулами обусловлены дисперсионными силами ван-дер-ваальсова притяжения (иногда их называют ван-дер-ваальсовыми связями). Они возникают только на достаточно малом расстоянии между молекулами и имеют в основе кулоновские силы электростатического притяжения. Ядра внутри электронных оболочек атомов находятся в постоянном колебательном движении, поэтому возможно временное смещение электронных орбит относительно ядра, что ведет к образованию диполя. Последние существуют короткое время, но оно достаточно для возникновения согласованной ориентации между молекулами.
Следует иметь в виду, что в направлении, противоположном дисперсионным силам притяжения, действует взаимное отталкивание электронных оболочек валентно-несвязанных атомов. С другой стороны, поскольку ковалентные связи между разными типами атомов приводят к асимметричному распределению валентных электронов, большинство атомов молекулы несет парциальные заряды. Так как суммарный заряд нейтральной молекулы равен нулю, она может приближенно рассматриваться как набор диполей или мультиполей, между которыми возникают электростатические взаимодействия.
Для удобства вычислений обычно объединяют три перечисленные невалентные силы (ван-дер-ваальсово притяжение, отталкивание электронных оболочек и электростатические взаимодействия) в одно силовое поле — потенциал Ван-дер-Ваальса. Такого рода потенциалы позволяют определить возможные контактные расстояния пар атомов — ван-дер-ваальсовы радиусы. Принято считать, что силы ван-дер-ваальсовых взаимодействий обратно пропорциональны шестой степени расстояния между взаимодействующими группами. Энергия этих взаимодействий находится в пределах 4—8 кДж/моль, возможная длина таких связей — 0,33— 0,45 нм (самая большая из всех типов слабых взаимодействий). Ван-дер-ваальсовы силы имеют большое биологическое значение, так как они играют определенную роль в процессах самосборки биологических макромолекул и структур, при взаимодействии между белками и другими биополимерами, в стабилизации третичной и четвертичной структур биополимеров.
В результате взаимодействия резко отличающихся по свойствам атомов (например, металлов и металлоидов) образуются ионные связи. При этом один атом (катион) отдает электрон другому атому, так что образовавшаяся пара электронов принадлежит только ему (аниону). Наиболее легко отдают электроны атомы щелочных металлов, максимальное сродство к электронам проявляют атомы галогенов. В основе ионной связи лежит электростатическое взаимодействие. Средняя энергия ионной связи в водных растворах составляет около 21 кДж/моль, длина колеблется в пределах 0,20—0,33 нм.
Ионные силы очень важны при взаимодействиях между молекулами. Например, притяжение между группами —COO- и —NН3+ имеет большое значение в процессе взаимодействия между молекулами белка. Катион Са2+, обладающий двойным зарядом, может играть роль «мостика», соединяющего две карбоксильные группы.
Существенным аспектом всех ионных взаимодействий в водных растворах является гидратация ионов. Каждый ион в воде окружен диполями воды, строго ориентированными по отношению к нему. Гидратация ионов оказывает большое влияние на их взаимодействие в растворе, определяет наряду с другими факторами силу кислот и оснований, прочность связи катионов металлов с отрицательно заряженными группами и др.
Известно, что во многих случаях заряд ионизированной органической молекулы нейтрализуется или неорганическими катионами (Na+, К+, Mg2+ и др.), или неорганическими анионами (Сl-, SO2-4 и др.). В водных растворах такие нейтрализующие ионы не могут занимать фиксированное положение вследствие своей гидратированности. Поэтому в водных растворах ионные взаимодействия с гидратированными неорганическими ионами обычно не играют существенной роли при определении конфигурации органических молекул.
Важнейшая особенность и вместе с тем достоинство перечисленных слабых взаимодействий состоит в том, что их энергия (4— 30 кДж/моль) не превышает значительно кинетическую энергию теплового движения (2,5 кДж/моль). Этого небольшого превышения вполне достаточно, чтобы при физиологических температурах возникали относительно прочные вторичные связи между молекулами. Однако поскольку разница между энергией слабых взаимодействий и кинетической энергией теплового движения невелика, их разрушение и образование происходят без участия ферментов.
Так как в распределении кинетической энергии молекул наблюдается большой разброс, при физиологических температурах всегда существуют молекулы, кинетическая энергия которых достаточна для разрушения слабых связей. Это придает межмолекулярным взаимодействиям определенную лабильность. В противном случае клетка имела бы жесткую структуру типа кристаллической, скорость диффузии была бы очень низкой, а это несовместимо с существованием живой клетки, В частности, удивительно высокая активность ферментативного катализа, в известной мере, связана с тем, что фермент-субстратные комплексы образуются с участием слабых взаимодействий, поэтому эти комплексы возникают и распадаются быстро даже под влиянием беспорядочного теплового движения.
2.4.4. Вторичная структура. Вторичная структура — это упорядоченное пространственное расположение отдельных участков полипептидной цепи без учета типа и конформации боковых радикалов аминокислот. Она образуется за счет замыкания водородных связей между пептидными группами. Вторичная структура представлена в основном такими регулярными структурами как а-спираль, складчатые слои (ß-структура), ß-изгиб. Часть полипептидной цепи не имеет упорядоченного строения, такие участки называют аморфными или бесструктурными областями.
В а-спиральных участках и участках с ß-складчатой структурой все последовательно расположенные пептидные звенья полипептидной цепи имеют идентичные взаимные ориентации, поскольку все торсионные углы φ и все углы ψ у Са одинаковы. В таком случае участок полипептидной цепи имеет линейную структуру, которая формируется из линейных групп.
Линейная группа представляет собой виток спирали, параметры которой (смещение вдоль оси, приходящееся на повторяющийся элемент, число элементов на виток, радиус и др.) зависят от величины углов φ и ψ. Спираль с числом элементов в витке менее двух невозможна. В белках обнаружено несколько типов линейных групп, не имеющих стерических затруднений; они стабилизированы водородными связями либо в пределах одного участка полипептидной цепи (спираль), либо между соседними участками (ß-складчатая структура). Когда торсионные углы близки к —60, —45°, вторичная структура представлена правыми а-спиралями. Этот тип спирали, описанный Л. Полингом, обладает наименьшей свободной энергией, наиболее «выгоден» с учетом ограничений, налагаемых геометрией пептидной связи и допустимыми изменениями углов φ и ψ.
В а-спирали все водородные связи примерно параллельны оси спирали и коллинеарны друг другу, что отвечает минимуму свободной энергии; каждая карбонильная группа образует водородную связь с четвертой по ходу цепи NH-группой.
![]()
При образовании а-спиралей замыкается максимально возможное число водородных связей, что придает прочность этой структуре. а-Спираль характеризуется следующими параметрами: число аминокислотных остатков на виток спирали — 3,6; число атомов в витке, замыкаемом водородной связью, — 13; формула спирали 3,6131; диаметр спирали ∽0,5 им; шаг спирали ∽0,54 нм; трансляция одного аминокислотного остатка вдоль оси спирали (проекция остатка на оси) ~0,15 нм (рис. 2.9).
В природных белках обнаружены только правые а-спирали. Боковые радикалы аминокислот в а-спирали обращены наружу и расположены по разные стороны от ее оси. Неполярные боковые радикалы аминокислот обычно группируются на одной стороне а-спирали, образуя неполярные дуги; это создает условия для сближения разных спиральных участков.
Кроме а-спирали описаны и другие типы спиральных структур, некоторые их параметры приведены в табл. 2.4.
Из табл. 2.4 видно, что кроме а-спирали в белках обнаружены и другие типы спиралей, например 310 и п-спираль, которые встречаются редко, в основном на коротких участках, образуя на концах а- спирали 1—2 витка.
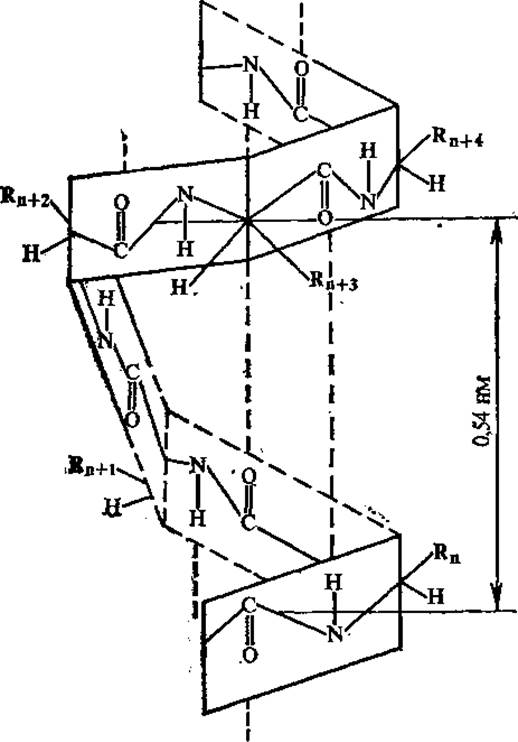
Рис. 2.9. Участок а-спиральной структуры белка
Таблица 2.4. Спиральные конфигурации белков
Название |
Формула |
Радиус, нм |
Проекция остатка на ось, нм |
Примечание |
310 |
310 |
0,19 |
0,20 |
Напряженная структура, встречается редко в виде 1—2 витков на концах а-спирали |
а-Спираль |
3,613 |
0,23 |
0,15 |
Универсальная конфигурация |
п-Спираль |
4,416 |
0,28 |
0,11 |
Встречается редко в виде 1—2 витков на концах а-спирали |
1 В последние годы вводится новая система обозначений. В соответствии с ней запись NМ расшифровывается следующим образом; М — минимальное число витков, на которых укладывается целое число N остатков; при такой форме записи а-спираль обозначается как 185.
Складчатые структуры полипептидной цепи образуются в том случае, когда торсионные углы φ и ψ близки к —120, + 135°. Следует оговориться, что хотя при описании вторичной структуры белков складчатые структуры отличают от спиральных, и те и другие фактически являются спиральными; только в случае складчатых структур эта спираль сильно вытянута. В складчатых цепях число остатков на «виток» равно 2 (в плоском складчатом слое) или 2,3 (в слегка скрученном слое), проекция остатка на ось — 0,33 нм, радиус «спирали» — 0,1 нм. Складчатые участки полипептидной цепи проявляют кооперативные свойства, т. е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные и антипараллельные ß-складчатые слои, или листы, которые укрепляются благодаря водородным связям между складчатыми участками цепи (рис. 2.10, 2.11).
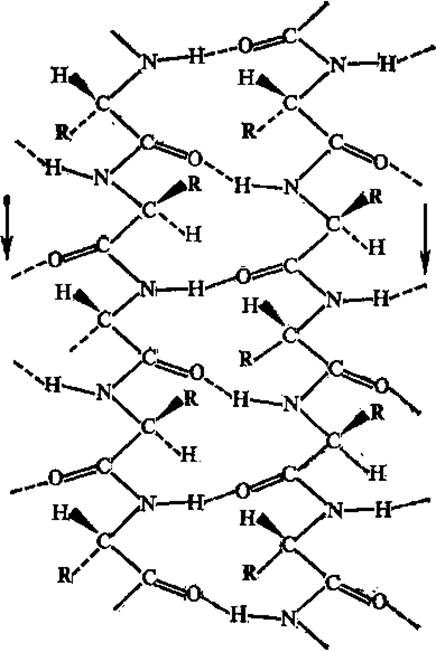
Рис. 2.10. Параллельная ß-структура белка
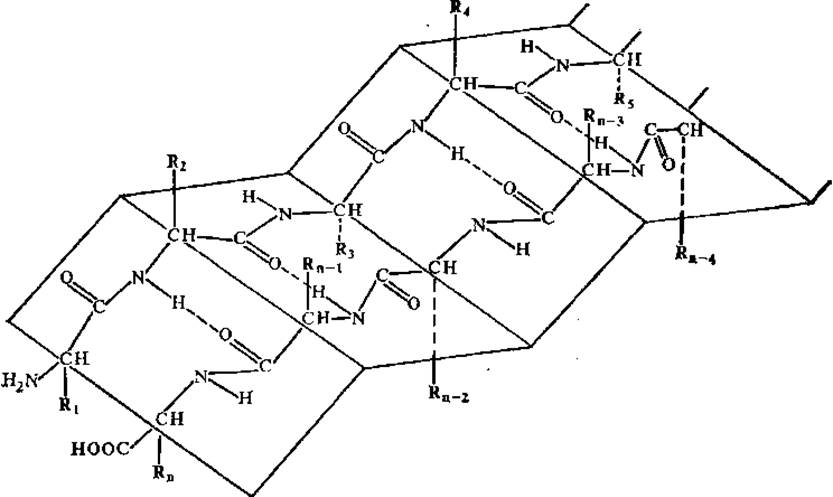
Рис. 2.11. Антипараллельная ß-структура белка
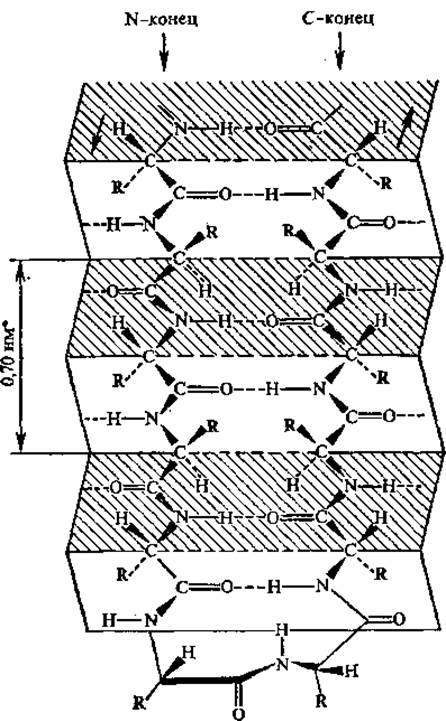
Рис. 2.12. Антипараллельная ß-структура и ß-изгиб
Антипараллельная ß-структура образуется, в том случае, если складчатая цепь делает поворот назад и идет вдоль самой себя, т. е. в обратном направлении; в месте поворота образуется ß-изгиб (рис. 2.12). В ß-изгиб входят четыре последовательно расположенных аминокислотных остатка. Параллельная ß-структура складывается участками из полипептидной цепи, направления которых совпадают. Антипараллельность цепей создает наиболее благоприятные условия для возникновения водородных связей между ними при участии пептидных групп. В случае параллельного расположения цепей в структуре складчатого ß-слоя водородные связи между цепями менее прочны. Боковые радикалы аминокислотных остатков (точнее связи Са — Cß) приблизительно перпендикулярны плоскости ß-складчатых слоев, причем боковые цепи аминокислот ориентированы поочередно то по одну, то по другую сторону этой плоскости.
Складчатые слои могут образовываться не только одной полипептидной цепью (при ЭТОМ водородные связи будут внутри данной цепи), но и группой близко расположенных полипептидных цепей в молекуле (водородные связи будут замыкаться между цепями). ß-Структура второго типа характерна для таких фибриллярных белков, как фиброин шелка, кератин волос, состоящих из нескольких полипептидных цепей. У глобулярных белков в формировании ß-складчатой структуры принимает участие обычно около 15% аминокислотных остатков полипептидной цепи. Большинство складчатых слоев содержит менее шести цепей. Как правило, складчатые слои не являются плоскими, для них характерна небольшая левая закрученность.
На некоторых участках белковой цепи встречается нерегулярная укладка аминокислотных остатков в пространстве, которая также удерживается благодаря водородным связям и гидрофобным взаимодействиям. Такие области в белковой молекуле называются неупорядоченными, бесструктурными или аморфными.
Короткие а-спирали и ß-структуры формируются в различных по длине полипептидной цепи участках, между этими упорядоченными типами структур находятся бесструктурные области
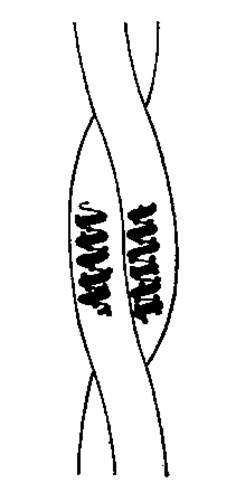
Рис. 2.13. Общий вид левой двухцепочечной суперспирали
2.4.5. Сверхвторичная структура и домены. а-Спиральные и ß-структурные участки в белках могут взаимодействовать друг с другом и между собой, образуя ансамбли. Пространственное строение таких ансамблей вторичной структуры называют сверхвторичной структурой белковой молекулы. Встречающиеся в нативных белках сверхвторичные структуры — энергетически наиболее предпочтительны.
Пример сверхвторичной структуры — суперспирализованная а-спираль, в которой две а-спирали скручены друг относительно друга, образуя левую суперспираль (рис. 2.13). Короткие участки этой сверхвторичной структуры встречаются в глобулярных белках (бактериородопсин, гемэритрин), а чаще и в наиболее упорядоченной форме — в фибриллярных белках. Суперспирализация выгодна энергетически, так как между боковыми радикалами аминокислот, принадлежащих разным а-спиралям, образуются дополнительные нековалентные контакты (ван-дер-ваальсовые).
Сверхспираль могут образовывать а-спирали, расположенные как параллельно, так и антипараллельно.
Другим возможным элементом сверхвторичной структуры является ßxß-звено (рис. 2.14), состоящее из двух параллельных ß-слоев с сочленением между ними в виде неупорядоченного клубка (ßcß), а-спирали (ßaß), ß-структуры (ßßß). Два последовательно соединенных участка ßaß называются укладкой цепи по Россману (ßaßaß-звено). Этот тип сверхвторичной структуры найден в НАД+-связывающем домене дегидрогеназ.
Сверхвторичная структура в виде антипараллельной трехцепочечной ß-структуры (ßßß) называется ß-зигзагом. Она довольно широко распространена в белках, например в стафилококковой нуклеазе, лактатдегидрогеназе, Т4-лизоциме и ряде других белков.
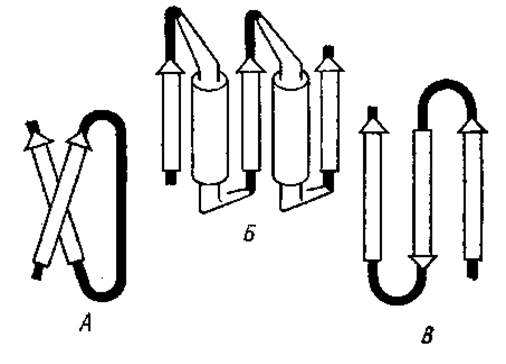
Рис. 2.14. Сверхвторичные структуры белков. А — ßcß-звено; Б — укладка цепи по Россману (два последовательно соединенных участка ßaß); В — ß-зигзаг: стрелками обозначены ß-складчатые слон, цилиндрами — а-спирали, аморфные области зачернены
Следующим уровнем организации, присущим крупным глобулярным белкам, являются домены. Они представляют собой структурно и функционально обособленные области (субобласти) молекулы, соединенные друг с другом короткими участками полипептидной цепи, которые называются шарнирными участками. Функциональные домены могут состоять из одного или нескольких структурных доменов. Вероятнее всего, функциональные домены, у которых молекулярная масса выше 20 000, содержат несколько структурных доменов.
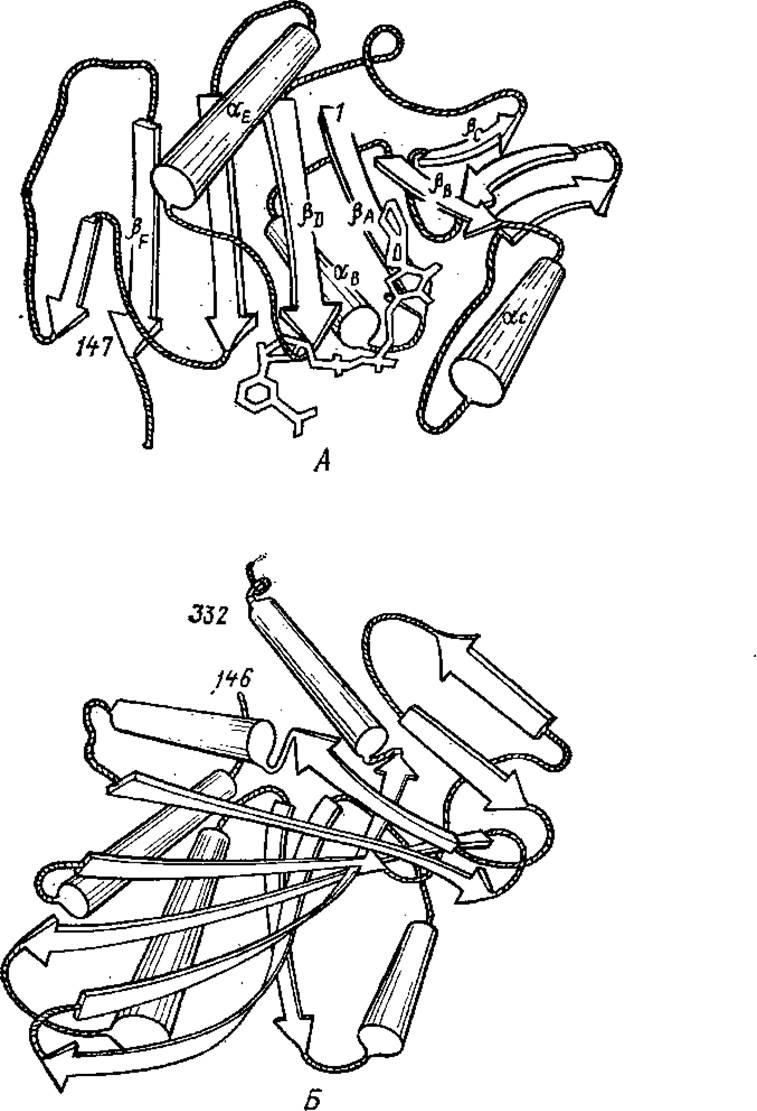
Рис. 2.15. Домены глицеральдегидфосфатдегидрогеназы из мышц омара. А — НАД+-связывающий домен; Б — каталитический домен.
цифрами обозначены аминокислотные остатки, остальные обозначения те же, что в рис. 2.14
Большинство крупных глобулярных белков можно разделить на несколько структурных доменов, содержащих 100—150 аминокислотных остатков и имеющих диаметр около 2,5 нм. Структурные домены обнаружены, например, у фермента глутатионредуктазы, катализирующего переход окисленного глутатиона в восстановленный (трипептид глу-цис-гли). Этот фермент является димером, т. е. его молекула построена из двух полипептидных цепей — субъединиц. Каждая из субъединиц, в свою очередь, состоит из трех структурных доменов, выполняющих свою определенную функцию при действии фермента.
Для ряда ферментов показано, что в углублении между доменами располагается активный центр. Так, в глицеральдегидфосфатдегидрогеназе выделяют два функциональных домена: НАД+-связывающий и каталитический, формирующие активный центр (рис. 2.15).
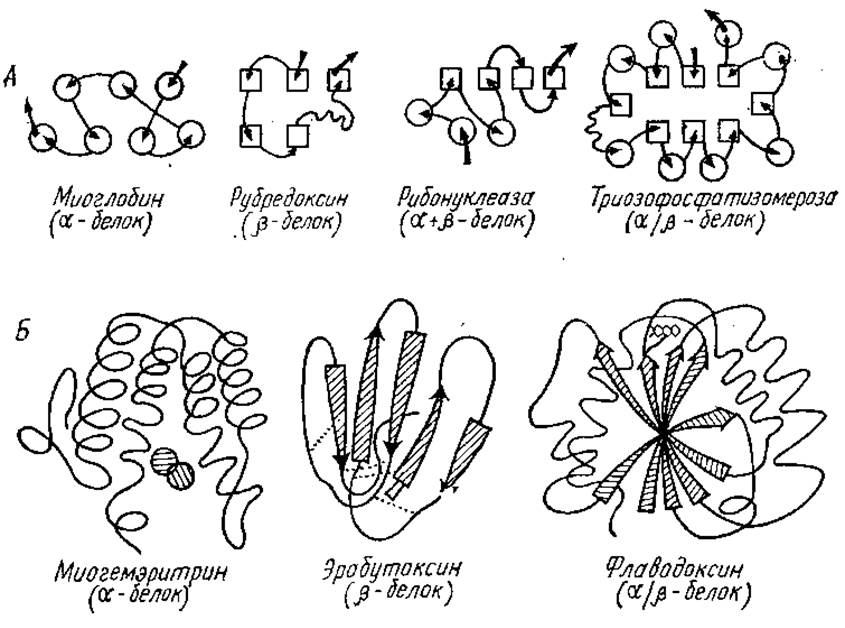
Рис. 2.16. Классификация глобулярных белков в соответствии с представительством и расположением в их молекулах а- и ß-структур (по Ю. Б. Филипповичу, 1985):
А — расположение а- и ß-структур (обозначены кружками и прямоугольниками соответственно) в a-, ß-, (а+ß)- и a/ß-белках; стрелками указан ход поли пептидной цепи от N-конца к С-концу молекулы;
Б — строение трех представителей а-. ß- и a/ß-белков; где a-структура представлена в виде спирали, ß-структура — в виде стрелок. У миогемэритрина заштрихованными кружками показаны два атома железа, у эрабутоксина пунктиром — четыре дисульфидных мостика; у флаводоксина группировка, ответственная за передачу атомов водорода, изображена вверху в виде трех конденсированных шестичленных колец
В некоторых глобулярных белках (сериновые протеиназы, иммуноглобулины) структурные домены в молекуле очень сходны, что наводит на мысль о дупликации генов. Сходные структурные домены могут встречаться и в разных белках, например, НАД+-связывающий домен в дегидрогеназах.
Во всех глобулярных белках, состоящих из доменов, существует высокая степень сродства между близко расположенными по цепи аминокислотными остатками. На основании этого предполагают, что домены формируются независимо друг от друга, что упрощает процесс укладки макромолекул.
Структурные домены и белки по организации вторичной структуры полипептидной цепи, т. е. по количеству а-спиралей и ß-структур, характеру их расположения в доменах предложено разделять на пять классов или групп (рис. 2.16).
Первая группа (а-белки) включает те белки, в которых преобладают а- спирали. Сюда, в частности, относятся гемоглобин, миоглобин, кальцийсвязывающие белки.
Вторая группа (ß-белки) содержит белки, построенные в основном из антипараллельных ß-слоев, например конканавалин А — лектин из канавалии мечевидной, рубредоксин — простейший железосерный белок, переносчик электронов, химотрипсин.
К третьей группе принадлежат а- + ß-белки, у них имеются участки, целиком построенные из а-спиралей, и участки, целиком состоящие из ß-слоев, в основном антипараллельных. Примерами такого типа белков являются: папаин — протеолитический фермент из плодов дынного дерева, термолизин, инсулин, цитохром b5, рибонуклеаза, лизоцим.
Четвертая группа — это a/ß белки, в них a-спирали и ß-структуры чередуются по ходу цепи. Большинство ß-структур, преимущественно параллельных, оказывается локализованным в центральной части молекулы, где эти структуры изгибаются в виде пропеллера («твиста-структуры), образуя жесткую «основу», с которой связаны остальные участки молекулы (рис. 2.17). К белкам четвертой группы принадлежат карбоксипептидаза, гексокиназа, фосфоглицераткиназа, триозофосфатизомераза, субтилизин, лактатдегидрогеназа, малатдегидрогеназа.
В пятую группу входят домены без выраженной вторичной структуры. Пространственная структура белка значительно более консервативна, чем его аминокислотный состав. Тип свертывания полипептидной цепи иногда позволяет устанавливать такие родственные связи между белками, которые не улавливаются при аминокислотном анализе.

Рис. 2.17. Укладка полипептидной цепи флаводоксина в пространстве.
Стрелками показан ход цепи от N-конца к С-концу в области «твист» структуры
2.4.6. Третичная структура. Третичная структура характеризует пространственное расположение упорядоченных и аморфных участков в полипептидной цепи в целом, которое достигается за счет взаимодействия боковых радикалов и зависит от их типа и конформации. Таким образом, третичная структура описывает пространственную укладку всей молекулы белка, если она образована одной полипептидной цепью. Третичная структура имеет прямое отношение к форме молекул белка, которая может быть различной: от шарообразной до нитевидной. Форма белковой молекулы характеризуется таким показателем, как степень асимметрии (отношение длинной оси молекулы к короткой). К нитевидным, или фибриллярным, белкам относят белки, имеющие степень асимметрии 80 и выше, это фиброин шелка, кератин волос, рогов, копыт, коллаген соединительной ткани и некоторые другие белки. При степени асимметрии менее 80 белки относят к глобулярным; большинство из них имеет степень асимметрии 3—5. Таким образом, у глобулярных белков третичная структура характеризуется достаточно плотной упаковкой полипептидной цепи в виде клубкообразной молекулы, приближающейся по форме к шару.
В поддержании третичной структуры глобулярных белков, ее закреплении принимают участие различные типы связей (рис. 2.18): ковалентные, ионные, или солевые, водородные и гидрофобные взаимодействия (указаны в порядке убывания энергии связи). Преимущественную роль в формировании третичной структуры отводят гидрофобным взаимодействиям, возникающим между неполярными боковыми радикалами аминокислот.
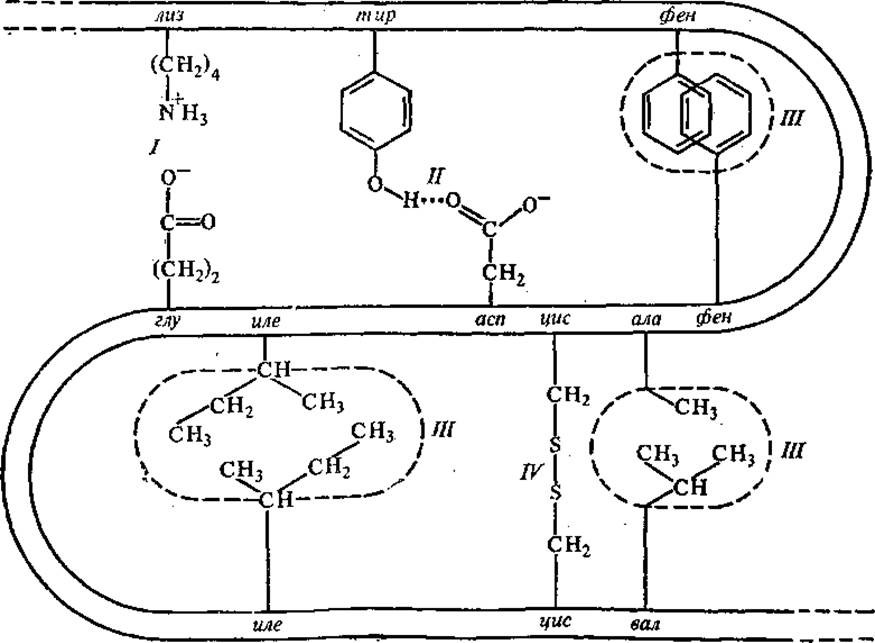
Рис. 2.18. Связи, стабилизирующие третичную структуру белковой молекулы:
I — ионная связь, II — водородная связь, III — гидрофобные взаимодействия, IV — ковалентная связь
Ковалентные связи, участвующие в поддержании третичной структуры белка, представлены дисульфидными и пептидными связями, последние образованы за счет амино- и карбоксильных групп боковых радикалов аминокислот. Дисульфидные связи возникают между двумя близко расположенными SH-группами боковых цепей цистеина. К замыканию ковалентных дисульфидных связей (—S—S—) приводит окисление сульфгидрильных (тиольных) групп в присутствии кислорода или некоторых других реагентов. In vivo эти связи образуются самопроизвольно, еслитиольные группы в результате пространственной укладки полипептидной цепи оказываются расположенными рядом, т. е. дисульфидные связи стабилизируют конформацию молекулы, но не определяют характер свертывания полипептидной цепи. В рибонуклеазе и лизоциме, содержащих четыре дисульфидные связи, теоретически возможно образование 44 = 256 вариантов S—S-связей, однако реализуется в нативной конформации только четыре.
Дисульфидные связи наиболее часто встречаются в секретируемых белках (змеиные яды, пептидные гормоны, пищеварительные ферменты, белки молока и др.). Наличием большого числа дисульфидных мостиков в фибриллярных белках (например, кератине), способных к взаимному превращению с сульфгидрильными группами, т. е. к временному разрыву и образованию заново, отчасти объясняются свойства вязкости и эластичности этих белков. Дисульфидные мостики никогда не образуются между соседними остатками цистеина.
Солевые, или ионные, связи возникают между группами белков, имеющими противоположные заряды, т. е. между боковыми радикалами аминокислот, диссоциированными по кислотному и основному типам. В качестве основных групп могут выступать с-аминогруппа лиз, гуанидиновая группа арг, имидазольная группа гис (один из его атомов азота обладает основными свойствами, другой — кислотными). Помимо гистидина кислотными группами в белках могут быть ß-карбоксильная группа асп и у-карбоксильная — злу.
Группы, способные к ионизации, и полярные группы аминокислот (см. разд. 2.3.3) обычно находятся на поверхности белковой глобулы и реже встречаются внутри. Так, на поверхности химотрипсина расположены 4 остатка арг и 14 лиз, которые обусловливают суммарный заряд 18 (+), а также, остатков асg и 5 глу, определяющие суммарный заряд 12 (—). Заряженные группы на поверхности белковой глобулы обычно сольватированы и окружены противоионами, что увеличивает растворимость белков в водной среде. Полярные боковые радикалы аминокислот, находящиеся внутри белковой молекулы, обычно образует водородные связи между собой или с полипептидным остовом.
Нахождение заряженных групп внутри глобулы энергетически невыгодно, поэтому они там встречаются редко. Если все-таки заряженные группы локализуются внутри глобулы, то они образуют солевые мостики.
Гидрофобные боковые радикалы, не имеющие сродства к воде, оказываются компактно упакованными, в основном, внутри глобулы, образуя гидрофобные области, стабилизирующие третичную структуру молекулы. В связи с этим диэлектрическая проницаемость (ε) внутри белковой глобулы значительно меньше, чем у воды. Гидрофобные области (ядра) в центре белковой глобулы имеют высокую плотность упаковки, характерную для многих кристаллов. Более низкая плотность упаковки получена для поверхностных участков молекулы, например, активных центров ферментов, что согласуется с предположением о подвижности центров. В среднем плотность упаковки белковой молекулы тоже достаточно высока, что свидетельствует об эффективном использовании нековалентных сил при организации пространственной структуры белковой молекулы. Небольшая часть неполярных радикалов может находиться на поверхности молекулы, и, скапливаясь, образовывать гидрофобные кластеры. Таким образом, в целом поверхность белковой глобулы мозаична в основном гидрофильна, но содержит и небольшие неполярные участки.
Только после приобретения белком нативной третичной структуры он проявляет свою специфическую функциональную активность. Пространственной структурой белка и взаимным расположением отдельных групп определяются биологические функции белковой молекулы в организме. Активные центры ферментов, центры, связывающие лиганды, ответственные за встраивание данного белка в мультиферментный комплекс и самосборку надмолекулярных структур, а также антигенные детерминанты белка образуются из пространственно сближенных групп при формировании третичной структуры. Например, сходная биологическая функция гемоглобина и миоглобина, обусловленная их способностью обратимо связывать кислород, объясняется сходством третичной структуры их полипептидных цепей. Активные центры у мономерных ферментов формируются в процессе свертывания полипептидной цепи, причем у мультидоменных ферментов активные центры включают участки всех структурных доменов данного глобулярного белка, в результате чего активный центр оказывается расположенным между ними.
Фибриллярные белки выполняют в организме, в основном, структурную функцию. Это плохо растворимые или нерастворимые белки, отличающиеся высоким содержанием неполярных аминокислот. К ним принадлежат, например, белки соединительных и сократительных тканей, волос, кожи, некоторые белки клеточных оболочек растений, водорослей и ряд других белков. Молекулы фибриллярных белков построены чаще всего из нескольких полипептидных нитей, имеющих структуру а-спирали (а-кератины, миозин), ß-складчатых слоев (ß-кератины, фиброин) или скрученных в особый вид спирали (коллагены).
Образование полипептидными нитями длинных, вытянутых по форме молекул и будет в целом характеризовать третичную структуру фибриллярных белков. Коллаген входит в состав соединительной ткани животных и человека, где образует так называемые нити или коллагеновые волокна. Они построены из фибрилл, структурной единицей которых, в свою очередь, является тропоколлаген.
Молекула тропоколлагена (М 300 000) состоит из трех полипептидных нитей, каждая из которых скручена в плотную левую спираль с тремя аминокислотными остатками в витке. Три цепи вместе слегка закручены в правую спираль и образуют молекулу тропоколлагена диаметром 1,5 нм и длиной 300 нм. Взаиморасположение пептидных цепей в молекуле стабилизируется водородными связями между пептидными группами соседних цепей и ковалентными связями между лизином, гидроксилизином, аллизином и гидроксиаллизином (последние две аминокислоты образуются в результате окисления ε-NH2-гpyпп до альдегидных). При взаимодействии указанных аминокислотных остатков получаются шиффовы основания и альдоли.
Для тропоколлагена характерно высокое содержание глицина (Уз аминокислотных остатков) и иминокислот (пролин, гидроксипролин — 21%); в большом количестве встречается аланин (11%). В составе коллагенов в небольшом количестве обнаружен 5-гидроксилизин, редко встречающийся в других белках. Описано несколько типов коллагенов, отличающихся друг от друга набором полипептидных цепей, аминокислотным составом. Например, тройная спираль коллагена большинства позвоночных состоит из двух а1-цепей и гомологичной а2-цепи а1- и а2-цепи имеют небольшие отличия в аминокислотном составе. Фибриллы коллагена образуются из молекул тропоколлагена при их соединении «конец к концу» и «бок о бок». В кипящей воде коллаген частично растворяется, образуя раствор желатины, который при охлаждении переходит в гель.
Белки волос, рогов, кожи, перьев (а-кератины) состоят из 3—7 полипептидных цепей, включающих приблизительно 100 аминокислотных остатков и имеющих а-спиральную конфигурацию. Полипептидные цепи, связанные дисульфидными мостиками, скручиваясь вместе, образуют левую суперспираль; из суперспиральных структур формируются микрофибриллы диаметром около 2 нм. При обработке а-кератинов горячим паром нарушается система внутрицепочечных водородных связей в каждой полипептидной нити, и при их растягивании они переходят в состояние ß-складчатых слоев (β-кератин). В ß-кератине водородные связи образуются между отдельными полипептидными нитями. Повторяющейся единицей кератинов является последовательность: — цис — цис — глу — про — сер —, Сходную с ß-кератином пространственную структуру имеет фиброин шелка. Этот белок богат глицином, серином и аланином. В фиброине соседние цепи антипараллельны: С- и N-концы у них не совпадают; S—S-связи между цепями отсутствуют. Фиброин шелка состоит, в основном, из следующей периодически повторяющейся последовательности: —гли—сер—гли—ала—гли—ала—. При образовании складчатой структуры все боковые группы ала и сер оказываются по одну сторону цепи, а гли — по другую. Структура, сходная с а-кератином, лежит в основе мышечных белков миозина и тропомиозина.
Волокнистый фибриллярный белок обнаружен в опорных структурах у диатомовых водорослей, он наряду с SiО2 принимает участие в образовании скелета диатомей. Этот белок помимо гидроксипролина содержит дигидроксипролин, а также ε-N-триметилгидроксилизин и некоторые другие редкие аминокислоты. В опорных белках кораллов, губок, медуз обнаружены бромтирозин, иодтирозин. В состав первичной клеточной стенки высших растений входит фибриллярный белок экстенсин, очень богатый гидроксипролином (до 33%). Экстенсин существует в виде жестко закрученной левой спирали. Этот белок связан с гемицеллюлозой клеточных стенок за счет гликозидной связи между арабинозой или галактозой и гидроксипролином.
В наружном скелете насекомых обнаружен белок ресилин, богатый гли и ала. Он не содержит гидроксипролина и серосодержащих аминокислот, чем напоминает фиброин шелка.
Наиболее информативным методом изучения пространственной структуры белковых молекул (вторичной, сверхвторичной, третичной) является метод рентгеноструктурного анализа (РСА). С его помощью устанавливают распределение электронной плотности в кристалле и тем самым пространственное строение молекул, образующих кристалл. Результаты исследования белков методом РСА позволяют построить пространственную модель молекулы: определить расположение полипептидной цепи в пространстве, найти участки, образующие регулярные структуры, изгибы цепи и др., выявить пространственное расположение аминокислотных остатков и контакт их с другими остатками, места присоединения небелковых частей (в случае сложных белков, двухкомпонентных ферментов). Сведения о наличии упорядоченных структур в белке, их типе и общей доле в цепи, конформационных изменениях белков в растворах дают оптические методы — ДОВ, КД, ИК-спектроскопии и др., а также метод ядерного магнитного резонанса (ЯМР).
В настоящее время применяют расчетные, теоретические методы для определения характера укладки полипептидной цепи на основе данных о первичной структуре. Это направление работ широко представлено в Институте белка АН СССР.
2.4.7 Четвертичная структура. Четвертичную структуру имеют те белки, молекула которых состоит из двух и более полипептидных цепей, связанных нековалентно. Четвертичная структура характерна, как правило, для белков, относительная молекулярная масса которых больше 50 000—100 000. Белки, имеющие четвертичную структуру, называются олигомерными.
Под четвертичной структурой понимают способ взаимного расположения в пространстве отдельных полипептидных цепей в молекуле, характер связей между ними. Каждая отдельная полипептидная цепь в составе молекулы белка с четвертичной структурой называется протомером или субъединицей. Термин субъединица некоторые авторы используют только по отношению к части молекулы, обладающей функциональной активностью. Она может быть представлена как одним протомером, так и несколькими. К белкам с четвертичной структурой относят иногда и сложные надмолекулярные белковые структуры, в которых объединяются до нескольких сотен субъединиц, например, жгутики бактерий, головки вирусов и т. д. Такие белки предлагают также называть мультимерными. Объединение протомеров в любом неопределенном количестве, не ведущее к появлению новых биологических свойств белка, называют в отличие от четвертичной структуры агрегированным состоянием.
Большинство внутриклеточных белков является олигомерными, внеклеточные белки — мономеры с небольшой молекулярной массой, белки плазмы крови — крупные мономеры. Такая взаимосвязь в строении и локализации белков, очевидно, не случайна. Мономерность внеклеточных белков, например ферментов пищеварительного тракта, лизоцима слюны, связывается с неопределенностью судьбы молекул и, как следствие, целесообразностью существования большого числа независимых единиц. Большая молекулярная масса белков — мономеров плазмы крови (>60 000) — препятствует их фильтрации и выделению почками, легкому проникновению во внешнее пространство. Примером такого белка служит сывороточный альбумин, содержащий несколько функциональных доменов.
Присутствие большого числа различных олигомерных белков внутри клетки снижает осмотическое давление в ней, вязкость, кроме того, олигомерные белки хорошо регулируются эффекторами (см. разд. 12.5). Биологический смысл олигомерности белков связан также с тем, что для их кодирования требуется меньше генетического материала в том случае, если все или некоторые субъединицы белковой молекулы идентичны. У таких олигомеров существует меньшая вероятность возникновения дефектных молекул, чем у крупных мономеров с той же молекулярной массой. Дефектные субъединицы в процессе диссоциации и реассоциации устраняются. Наиболее часто в олигомерной белковой молекуле насчитывается две или четыре субъединицы, реже 6, 8 и больше или нечетное число. Взаимное расположение отдельных субъединиц в молекулах белков с четвертичной структурой, а также в надмолекулярных белковых структурах может быть различным, оно зависит от формы субъединиц, их числа и отвечает минимуму свободной энергии. Различают изологические и гетерологические взаимодействия между субъединицами в макромолекуле. В случае гетерологического взаимодействия каждая из субъединиц одного типа имеет взаимно комплементарные участки а и b (рис. 2.19). При соединений двух таких субъединиц у одной остается свободный участок а, а у другой — b. К этим участкам могут присоединяться аналогичные субъединицы, причем в одних случаях образуются длинные цепи, в других — кольцо или спираль. Кольца, образованные только за счет гетерологических взаимодействий обладают циклической симметрией: при повороте вокруг оси симметрии на определенный угол каждая субъединица может быть совмещена со следующей. В зависимости от геометрии субъединиц их число в кольце может быть различным.
Если углы, возникающие между двумя субъединицами, не приводят к замыканию кольца, образуется спираль. В этом случае кроме гетерологических контактов типа ab могут возникать дополнительные взаимодействия при наличии других комплементарных участков. Спиральные структуры разных типов из белковых субъединиц представляют собой нити актина мышечного волокна, вирионы некоторых вирусов, жгутики бактерий и др.
Если две одинаковые субъединицы белка образуют пару идентичных связей типа ab, такое взаимодействие называется изологическим (рис. 2.20). Подобная структура обладает осью симметрии второго порядка, т. е. каждая точка одной субъединицы может быть совмещена с такой же точкой другой субъединицы при повороте вокруг оси симметрии на 360°/2=180°. При наложении двух изологических димеров друг на друга между ними могут возникать дополнительные изологические связи, при этом образуются тетрамерные структуры с диэдрической симметрией. Примерами таких структур могут быть фермент лактатдегидрогеназа и растительный агглютинин конканавалин А.
В крупных белковых структурах существуют два типа контактов — гетерологические и изологические. При этом обычно возникают олигомеры разных форм с кубической симметрией (многогранники типа тетраэдра куба, икосаэдра). Структуры с кубической симметрией обладают более чем одной осью симметрии, порядок которой выше двух. Кубическая симметрия характерна для капсид некоторых вирионов — бактериофаг φХ174, вирус SV40, папилломы человека, аденовирусы, вирус гриппа и т. д.
Четвертичная структура многих белков и надмолекулярных белковых структур формируется из протомеров двух или большего числа типов. Так, гемоглобин — тетрамер, построенный из двух похожих, но неидентичных субъединиц а и ß (a2β2), фермент acпapтат-карбомоилтрансфераза из 12 субъединиц (два тримера — каталитические субъединицы и три димера — регуляторные субъединицы). Чехлы некоторых вирусов также построены из протомеров двух и большего числа типов. Для структур, сформированных из неидентичных субъединиц, тоже характерно симметричное их расположение.
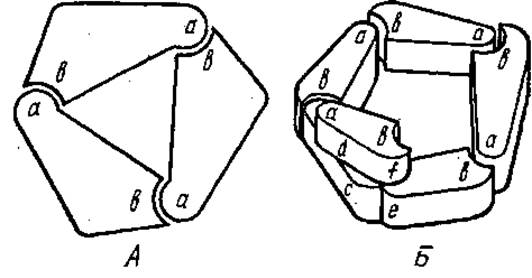
Рис. 2.19. Гетерологическое связывание субъединиц. А — кольцо; Б — спираль
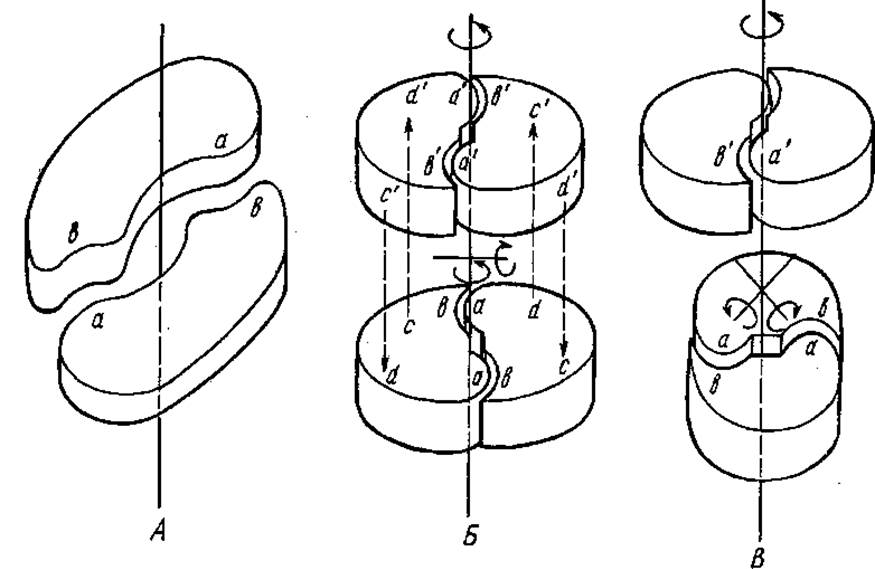
Рис. 2.20. Изологическое связывание субъединиц (объяснение см. в тексте)
Между субъединицами, составляющими молекулу белка с четвертичной структурой, могут возникать связи различных типов: гидрофобные взаимодействия, ионные и водородные связи. Контактные поверхности субъединиц, формирующих четвертичную структуру, комплементарны, что вносит свой вклад в упрочение молекул белка. Специфичность ассоциации достигается комплементарностью профилей контактных поверхностей, а также оптимальным взаиморасположением доноров и акцепторов водородных связей и заряженных остатков. Однако основными связями, закрепляющими четвертичную структуру, являются гидрофобные. Имеются гидрофобные участки («липкие» пятна) на контактирующих поверхностях протомеров, которые мешают воде образовывать межмолекулярные связи, иммобилизуют ее. В соответствии со вторым законом термодинамики стремление системы, содержащей молекулы воды, к максимальной энтропии, когда между молекулами есть водородные связи, заставляет протомеры так сблизиться, чтобы между ними не было воды. Гидрофобные участки «слипаются», комплементарная электрозаряженность отдельных точек усиливает скрепление протомеров, субъединиц. Поскольку отдельные протомеры в молекуле связаны нековалентно, вполне закономерен вопрос — одна ли это молекула. Так как все протомеры четвертичной структуры прочно связаны друг с другом (пусть нековалентно) и только будучи объединенными выполняют возникающую при этом биологическую функцию, всю систему следует считать одной молекулой.
Одним из методов анализа четвертичной структуры является электронная микроскопия; этот метод может дать полезную информацию, если белок достаточно велик, имеет молекулярную массу более 200 000.
Заключение о наличии четвертичной структуры можно-сделать и на основе определения молекулярных масс в различных условиях: близких к нативным и в присутствии денатурирующих химических агентов, диссоциирующих молекулу на отдельные протомеры (гуанидингидрохлорид, додецилсульфат натрия, мочевина нейтральные соли в высоких концентрациях). Если в обоих случаях получают одно и то же значение молекулярной массы, то белок не имеет четвертичной структуры и построен из одной полипептидной цепи.
В том случае, когда белок является олигомером, построенным из одинаковых по величине субъединиц, получающаяся в присутствии химических агентов молекулярная масса должна быть кратна таковой нативной молекулы белка. Например, если белок содержит два протомера, то молекулярная масса после денатурации равняется половине нативной и т. д. Присутствие в белке субъединиц различных размеров устанавливается с помощью электрофореза в полиакриламидном геле или гель-фильтрацией на колонке с молекулярными ситами, например сефадексами. В таком случае обработка олигомерных белков додецилсульфатом натрия приводит к диссоциации молекул на субъединицы и появлению двух и более фракций, отличающихся от исходной по величине молекулярной массы.
Четвертичной структуре принадлежит большая роль в регуляции биологической активности белков, ибо она очень чувствительна к внешним условиям: небольшие их отклонения могут вызывать изменение взаиморасположения субъединиц и в связи с этим изменение биологической активности белка. Это явление представляет собой один из основных механизмов регуляции метаболизма, поскольку многие ферменты и некоторые другие метаболически активные белки имеют четвертичную структуру.
2.4.8. Взаимосвязь отдельных уровней структуры, упорядоченность и относительная динамичность белковой молекулы. Подробное изучение строения глобулярных и фибриллярных белков показало, что для каждого индивидуального белка характерна своя пространственная структура — конформация. В ее формировании ведущая роль принадлежит первичной структуре, т. е. генетически детерминируемой аминокислотной, последовательности. Об этом свидетельствует, в частности, способность полипептидных цепей к самопроизвольной укладке в пространстве с образованием той конформации, которая соответствует первичной структуре данного полипептида.
Предложена классификация аминокислотных остатков по их способности к образованию тех или иных регулярных структур. Образованию а-спирали способствуют такие аминокислоты, как глу, ала, лей, в то время как мет, вал, иле чаще встречаются в составе ß-структуры, а гли, про, асн — в местах изгиба цепи (они дестабилизируют а-спираль). В том случае, если на каком-то участке оказываются рядом по ходу цепи несколько остатков, способствующих образованию спирали, имеет место формирование этой структуры. Считается, что шесть сгруппированных остатков, четыре из которых способствуют образованию спирали, можно рассматривать как центр спирализации. От этого центра идет рост спиралей в обоих направлениях до участка — тетрапептида, состоящего из остатков, которые препятствуют образованию этих спиралей. При формировании ß-слоя роль затравок выполняют три аминокислотных остатка из пяти, способствующие образованию ß-структуры.
Подтверждением положения о ведущей роли первичной структуры при образовании нативной конформации являются также опыты по ренатурации белков. Устранение денатурирующих воздействий приводит в ряде случаев к самопроизвольной ренатурации, результатом чего является восстановление нативной конформации и специфической биологической функции. Так. К. Б. Анфинсену (1975) удалось подобрать условия ренатурации РНКазы, при которых она может после денатурации возвращаться к исходному нативному состоянию.
Первичная структура субъединиц белков определяет и их четвертичную структуру, что доказывается данными рентгеноструктурного анализа и фактами реконструкции биологически активных белков из диссоциированных субъединиц. Так в ацетоне при кислом pH происходит денатурация глобиновой части гемоглобина, отделение гема и диссоциация на субъединицы. Нейтрализация pH приводит к объединению гема с глобином и ассоциации субъединиц с образованием нативного гемоглобина.
Предполагают, что первичная структура белков определяет не только их конформацию, но и пути, порядок ее достижения. В молекуле белка, видимо, есть достаточно автономные «узлы», «блоки», которые осуществляют укладку своей конформации независимо друг от друга. Такими «блоками» могут быть те а-спирали и ß-структуры, которым свойственна высокая степень сродства к близким с ними по цепи остаткам аминокислот. Это облегчает процесс укладки белковой цепи в пространстве и увеличивает его скорость. В процессе формирования пространственной структуры белка наблюдаются и промежуточные состояния, не входящие в нативную конформацию. Укладка белков, имеющих дисульфидные связи, происходит значительно медленнее по сравнению с белками, лишенными S—S-связей. Структурные блоки затем укладываются в 2—3 больших домена, а последние объединяются, «досворачиваются» до целой молекулы. В заключение следует, однако, отметить, что последовательность чередования аминокислот является основным, решающим фактором в образовании конформации белковой молекулы, но не единственным; некоторое влияние оказывают и другие факторы ограничения, корректировки. Так, образование вторичной структуры в каком-либо участке полипептидной цепи зависит не только от его аминокислотной последовательности, но и от влияния других участков, удаленных от данного.
Специфическая конформация полипептидной цепи начинает формироваться еще во время синтеза белка на рибосоме. Это доказано опытами с рибосомами, которые выделяли с синтезируемыми на них молекулами фермента. Хотя рибосомы выделяли до завершения синтеза фермента, молекулы которого были еще связаны с рибосомой, каталитическая активность фермента уже обнаруживалась, что возможно лишь при почти окончательном сформировании третичной структуры. Полностью организация нативной структуры завершается по окончании синтеза полипептидной цепи и посттрансляционной модификации последней при участии различных ферментов, а в случае олигомерных белков — организации четвертичной структуры. Складывающаяся уникальная структура белковой молекулы очень специфично приспособлена к выполнению белком определенной биологической функции в клетке: каталитической, гормональной, транспортной и т. д.
Нативные конформации белков отобраны в процессе эволюции и представляют собой наиболее энергетически выгодные состояния, обладающие наименьшей свободной энергией. Такие относительно стабильные пространственные структуры молекул обусловливают специфические биологические функции белка. Нативные белковые молекулы с определенной трехмерной структурой имеют большую степень упорядоченности по сравнению с развернутой полипептидной нитью и, следовательно, должны характеризоваться более низкой энтропией, чем неупорядоченные белковые структуры. Исходя из этого можно было бы ожидать, что термодинамически более выгодным должен являться процесс образования неупорядоченной белковой структуры из упорядоченной. Однако поскольку белки всегда находятся в клетке в водном окружении, то должна рассматриваться не изолированная белковая система, а система белок + вода. В том случае, когда белок имеет упорядоченную трехмерную структуру, для воды характерна максимальная энтропия, и в целом энтропия системы (белок + вода) при формировании третичной структуры белка либо остается постоянной, либо возрастает. Именно поэтому возможно самопроизвольное образование упорядоченных структур со специфической биологической функцией. При образовании четвертичной структуры белков в результате ассоциации субъединиц действуют те же законы, что и при свертывании индивидуальной полипептидной цепи в процессе формирования ее нативной конформации.
Однако упорядоченность пространственной структуры белков является не статичной, а динамичной. Значительной свободой движения обладают, например, боковые радикалы аминокислот, расположенные на поверхности молекулы. В белковых макромолекулах спонтанно и обратимо происходят различные конформационные переходы, в результате чего каждому макросостоянию белка соответствует много микросостояний. Последние обусловлены как мелкомасштабными тепловыми движениями групп около положения равновесия, так и локальными трансконформациями, движениями доменов. В физиологических условиях доминируют мелкомасштабные тепловые движения и среднемасштабные локальные трансконформации. Их вероятность зависит от различных функциональных воздействий на белок, хотя его статистическая макроконформация может при этом меняться крайне мало.
В процессе функционирования белковые молекулы претерпевают небольшие конформационные изменения (флуктуации). Такие флуктуации наблюдаются, например, при соединении белковой части ферментативной молекулы с коферментом при образовании фермент-субстратного комплекса. Б. Ф. Поглазовым (1967) обнаружено, что сокращение хвостового чехла бактериофага Т4 сопровождается сильным (до 50% от общего содержания) уменьшением числа а-спиралей белков чехла и эквивалентным нарастанием ß-структур.
На конформацию белков существенное влияние оказывают условия среды (pH, ионный состав, температура и др.). Изменение параметров среды приводит к перезарядке отдельных точек белковой молекулы, перестройке системы ионных, водородных связей и гидрофобных взаимодействий между боковыми радикалами аминокислот, т. е. к изменению конформации белка и его биологической активности.
2.4.9. Самоорганизация надмолекулярных белковых структур. Та информация, которая содержится в аминокислотной последовательности, реализуется и при так называемой самоорганизации (или самосборке) надмолекулярных структур, протекающих без участия матрицы и генетического контроля. Под самосборкой понимают наряду с самоорганизацией третичной структуры, способность белковых молекул к спонтанной и упорядоченной ассоциации между собой и с другими биополимерами, приводящей к образованию биологически активных структур.
Одной из первых in vitro была осуществлена самосборка-реконструкция вируса табачной мозаики (ВТМ) в 1955 г. У этого вируса, имеющего цилиндрическую форму, спираль РНК образует как бы ось, вокруг которой располагаются более 2000 субъединиц белка. Защелачивание среды или обработка детергентами приводит к диссоциации такой белковой оболочки до отдельных субъединиц — полипептидов. При закислении раствора происходит самосборка вирусных частиц, реассоциация белковых субъединиц вокруг РНК. Такие частицы сохраняют инфекционность, что свидетельствует об их сходстве с исходным нативным вирусом. Это подтвердило и сравнение физических свойств.
В дальнейшем аналогичная искусственная сборка биологических структур из субъединиц была осуществлена с отростком бактериофага Т4, мембранными структурами, микротрубочками и другими объектами. Сборка отростка фага Т4 начинается с образования из специальных белков «втулки», являющейся центром базальной пластинки. Затем вокруг «втулки» собираются другие белки, формируя шестиугольную базальную пластинку (рис. 2.21). Активирование базальной пластинки в результате присоединения специфических белков приводит к началу сборки из структурных единиц стержня, а затем и чехла отростка. На следующем этапе к отростку подходят белки головки фага, происходит ее формирование, и далее прикрепляются к базальной пластинке готовые нити отростка. Микротрубочки — элементы цитоплазмы, участвующие в ее движении, внутриклеточном транспорте, формируются из молекул глобулярного гликопротеина (тубулин), укладывающихся в спираль. Процесс самосборки микротрубочек инициируется активацией белка за счет энергии ГТФ. Сборка и разборка этих структур, постоянно происходящие в клетке, регулируются внутриклеточной концентрацией ионов кальция.
Рис. 2.21. Последовательные стадии процесса сборки отростка бактериофага Т4:
а — базальная пластинка с шипами, б — стержень, s — субъединицы чехла
Формирование мембран происходит также в результате самосборки ее компонентов: белков, липидов, углеводов и др. Для образования мембраны, различных органелл клетки не нужен генетический код, органеллы возникают в результате взаимодействия молекул определенной химической структуры. Эта концепция доказывается многочисленными опытами. Например, добавление в суспензию мембранных фосфоглицеридов интегрального белка приводит к образованию пузырьков, в которых все молекулы белка погружены в липид и определенным образом ориентированы.
Большие и интересные исследования по самосборке жгутиков бактерий проведены Б. Ф. Поглазовым (1967). В опытах А. С. Спирина (1968) была осуществлена «разборка» рибосом (с помощью высоких концентраций CsCl и других хлоридов одновалентных катионов), а затем их самосборка (при высокой концентрации Mg2+ и нагревании до 37°С).
Образование комплексов фермент-субстрат, антиген-антитело также можно рассматривать как проявление самосборки, самоорганизации.
При самосборке надмолекулярных структур аналогично образованию нативной конформации белков система стремится к состоянию с минимальной свободной энергией и максимальной энтропией. Окружающая вода повышает свою энтропию на величину, достаточную для компенсации снижения энтропии, обусловленной ассоциацией молекул при самосборке.
В процессе агрегации биомолекул большая роль отводится ионным взаимодействиям как наиболее дальнодействующим (до 0,7 нм) и включающимся в первую очередь. Затем между молекулами возникают более короткодействующие (на расстоянии до 0,2 нм) связи: водородные, гидрофобные, ван-дер-ваальсовы. Для того чтобы эти силы могли возникать и действовать, необходимо прежде всего стерическое, пространственное соответствие (комплементарность) взаимодействующих поверхностей. Иначе говоря, должна существовать возможность сближения этих поверхностей на короткое расстояние, при котором возможно образование перечисленных связей. Необходима также комплементарность по распределению зарядов противоположного знака (для возникновения электростатических сил), гидрофобных областей и групп, способных к образованию водородных связей. Таким образом, в процессе самосборки важнейшую роль играет явление «узнавания», наличие стерической и химической комплементарности.
Самосборку можно рассматривать как простейший этап биологического морфогенеза на молекулярном уровне. При формировании элементарных биологических структур самосборка является, по существу, единственной основой процесса (при содействии ряда второстепенных моментов). Более сложные биологические образования требуют уже дополнительного участия ряда регулирующих и корректирующих факторов. Можно предполагать, что особенно большое значение самосборка биологических структур имела на заре возникновения жизни, при переходе от неживой материи к живой.