Основы биохимии - А. А. Анисимов 1986
Белки
Классификация, характеристика, представители
Все белки принято делить на две группы: простые, или протеины (состоят только из аминокислот), и сложные1 (в их молекуле помимо белковой части содержится и небелковая, простетическая часть). Внутри каждой из этих групп существует деление на подгруппы. Простые белки подразделяют в соответствии с их растворимостью в различных веществах, а сложные белки классифицируют по химизму небелковой части молекулы. Следует сразу заметить, что классификация простых белков весьма условна и несовершенна, так как основана на сравнении относительно несущественных признаков. Многие белки, ранее отнесенные в группу простых белков (например, глобулины крови), по результатам исследований строения их молекул оказались двухкомпонентными. В природе в свободном виде существуют также пептиды, молекулы которых содержат, как указывалось ранее, не более 50 аминокислотных остатков.
1 Длительное время все сложные белки называли протеидами (хромопротеиды, липопротеиды, нуклеопротеиды и т. д.). В последние годы все более общепринятыми становятся названия сложных белков с окончанием — ины (хромопротеины, липопротеины, нуклеопротеины и т. д.). Объясняется это в основном тем, что термин протеиды означает белковоподобные вещества.
2.5.1. Природные пептиды. В живых организмах обнаружено несколько сотен свободных пептидов. К ним принадлежат некоторые гормоны, токсины, антибиотики, нейропептиды, а также ряд других биологически активных веществ.
Глутатион (у-глутаминилцистеинилглицин, глу-цис-гли G-SH).
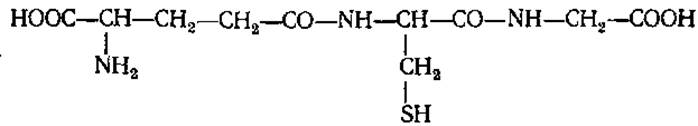
Обнаружен в клетках животных и человека (особенно его много в мозге, хрусталике глаза), бактериях, дрожжах, грибах, зеленых растениях. Принимает активное участие в окислительно-восстановительных процессах:
![]()
Основная функция глутатиона в клетках заключается в защите сульфгидрильных групп белков от окисления. Он служит также коферментом в ряде ферментативных реакций (см. разд. 3.4.3). У животных и человека глутатион принимает участие в разложении Н2О2, образующегося в эритроцитах в результате обменных процессов или аутоокисления лекарственных препаратов. Он участвует в детоксикации ряда чужеродных для живой клетки соединений (галогенсодержащие алифатические или ароматические углеводороды), переводя их в водорастворимую, способную к выделению почками, форму.
Грамицидин S — антибиотик, активно синтезируется бактериями Вас. brevis, по своему химизму является циклическим декапептидом, в составе которого, кроме белковых аминокислот, есть орнитин (орн):
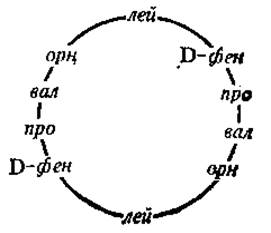
Пептидные антибиотики типа грамицидинов являются ионофорами, они действуют на биологические мембраны, образуя комплексы с ионами металлов, чем нарушают регуляцию ионной проницаемости в мембранах бактерий.
Аманитины — токсичные октапептиды ядовитых грибов рода Amanita. Типичным представителем аманитинов является а-аманитин. Он блокирует синтез белка в клетке эукариот на стадии транскрипции. Замена в молекуле а-аманитина диоксиизолейцина на лейцин приводит к образованию нетоксичного соединения.
В этих же грибах содержится ряд токсичных гептапептидов — фаллоидинов, имеющих сходное с аманитинами строение (бициклическое). Фаллоидины необратимо поражают печень млекопитающих. Роль противоядия фаллоидинам выполняет циклический декапептид — антаманид, содержащийся в тех же грибах, что и токсин. Он уплотняет мембраны клеток печени и понижает их проницаемость по отношению к токсинам. Антаманид является ионофором, связывающим Na+ или Са2+, сорбированные на поверхности мембраны, и тем самым покрывает определенные участки мембраны, уплотняя ее и меняя ее свойства, в частности, проницаемость. В Amanita muscaria обнаружен другой токсичный для человека пептид — мускарин.
Известно большое число гормонов пептидной природы. Они рассматриваются в гл. 12.
К свободным пептидам принадлежат каллидин и брадикинин плазмы крови, относящийся к кининам. Они повышают проницаемость капилляров, обладают мощным сосудорасширяющим действием, являются сильнейшими возбудителями болевых ощущений. Оба эти пептида образуются из общего предшественника кинино-гена в результате протеолитического расщепления. Брадикинин — линейный нонапептид: арг — про — про — гли — фен — сер — про — фен — арг; каллидин отличается от него наличием еще одного аминокислотного остатка (лиз) на N-конце. Инактивируются пептиды в результате отщепления С-концевого аргинина при участии карбоксипептидазы В.
Опиоидные пептиды (эндопиоиды) — группа нейропептидов, оказывающих модулирующее влияние на передачу нервных импульсов в ряде отделов центральной нервной системы (ЦНС). Эти пептиды взаимодействуют с теми же рецепторами, что и опиатные соединения (например, морфин), и близки к ним по-своему действию.
Наибольшее количество рецепторов связывания эндопиоидов обнаружено в таламусе, гипоталамусе, нейрогипофизе и ряде других отделов ЦНС. Рецепторы опиоидных пептидов находятся и в периферической нервной системе. Эндопиоиды принимают участие в регуляции процессов, связанных с восприятием боли, влиянием гормонов на обмен веществ, воздействуют на сердечно-сосудистую деятельность, стрессорные реакции и ряд других физиологических функций. Например, при обезболивании путем иглоукалывания (акупунктурная анальгезия) в спинно-мозговой жидкости повышается содержание эндопиоидов, что говорит об активации этой системы в результате иглоукалывания. Некоторое влияние опиоидные пептиды оказывают на характер эмоций, поведение.
В настоящее время известно несколько десятков опиоидных пептидов. Конкретными их представителями являются, в частности, a-, ß- и уэндорфины, а- и ß-неоэндорфины, динорфин, пентапептиды метионин-энкефалин (тир — гли — гли — фен — мет) и лейцин-энкефалин (тир — гли — гли — фен — лей).
Особый интерес представляет процесс синтеза опиоидных пептидов. Его основным принципом является посттрансляционное расщепление протеазами высокомолекулярных белковых предшественников. Одним из предшественников эндопиоидов является так называемый проопиомеланокортин, представляющий собой прегормональный белок с молекулярной массой около 31000. Его молекула содержит аминокислотные последовательности меланоцитстимулирующих гормонов (МСГ), адренокортикотропного гормона (АКТГ), ß-липотропного гормона. В свою очередь, в ß-липотропине, являющемся гормоном, стимулирующим высвобождение жирных кислот из жировой ткани и состоящим у человека из 91 аминокислотного остатка, обнаружены последовательности, аналогичные ß-МСГ (41—58), АКТГ4-10 (47—53), а также эндопиоидов: а-эндорфина (61—76), ß-эндорфина (61—91), у-эндорфина (61—77) и метионин-энкефалина (61—65). Ниже дана аминокислотная последовательность ß-липотропина человека, содержащая последовательности ß-МСГ, ß-эндорфина и метионин-энкефалина.
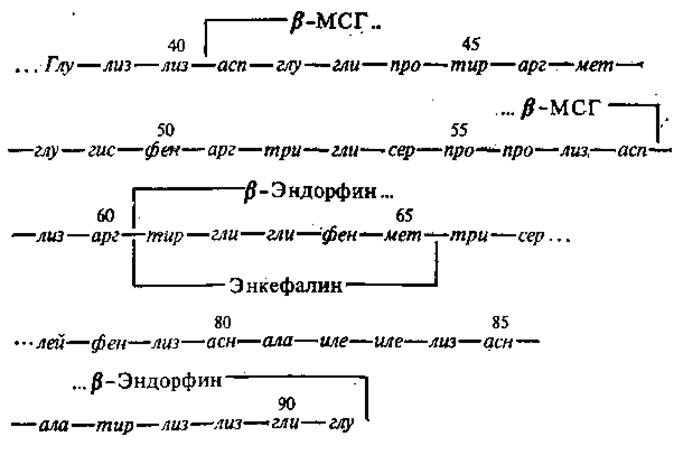
Однако, поскольку ß-липотропин и энкефалины имеют различную тканевую локализацию, полагают, что основным предшественником энкефалинов является не проопиомеланокортин, а другие полипептиды, включающие в себя несколько копий метионин-энкефалина и лейцин-энкефалина.
Кейлоны — тканеспецифичные гормоны местного действия — представлены белками или пептидами различной молекулярной массы. Кейлоны подавляют митотическую активность других клеток той же ткани. Вероятно, эти гормоны, участвуя в регуляции деления клеток, предотвращают их злокачественный рост.
Фолиевая кислота, являющаяся по своей биологической функции витамином (см. разд. 10.3), также может быть отнесена к пептидам. В ее составе содержится до 7 остатков глу в виде у-глута-минилпептида (т. е. соединение глутаминовых остатков происходит за счет y-карбоксильных, а не а-групп).
Помимо перечисленных пептиды выполняют ряд других, очень интересных и важных функций. Открыты гормоны, ответственные за индукцию сна. Некоторые специфические пептиды, возможно, являются веществами, участвующими в явлениях памяти, выработке условных рефлексов. Не исключено, что долговременная память связана с синтезом в определенных нейронах этих пептидов. Так, при тренировке крыс на избегание темноты у них в мозге накапливается 15-членный пептид (скотофобин), введение которого нетренированным животным вызывает у последних такое же поведение. Прослеживается связь между отклонениями в психической деятельности человека от нормы и содержанием определенных пептидов в мозге.
Таким образом, биологическая активность пептидов связана с их регуляторной ролью, причем точки приложения их действия и эффективность в организме очень разнообразны. Природные пептиды привлекают в настоящее время большое внимание исследователей, активно ведутся работы по их выделению, установлению структуры, функции, химическому синтезу с целью применения в практической медицине как лекарственных средств.
2.5.2. Протеины (простые белки). Ниже представлены группы простых белков, классификация которых основана на растворимости этих соединений.
Альбумины. Это водорастворимые белки, осаждающиеся при насыщении растворов нейтральными солями, например (NH4)2SО4. Добавление одной соли обычно не приводит к осаждению белков (за исключением (NH4)2SО4), требуется смесь солей, преимущественно одно- и двухвалентных катионов (NaCl и MgSО4 или Na2SО4 и MgCl2). Сульфат аммония начинает осаждать альбумины при 65% насыщения, а полное осаждение наступает при 100% насыщения.
Альбумины широко распространены в природе. Они составляют около 50% всех белков плазмы крови человека. Высоко содержание альбумина в белке яиц (до 50%). Белок, обладающий сходной растворимостью и получивший название лактальбумин, выделен из молока; богаты альбуминами и растения.
Глобулины. Растворимы в слабых растворах нейтральных солей, однако высокие концентрации последних осаждают глобулины. (NH4)2SО4 высаливает глобулины уже при 50% насыщения, хотя надо иметь в виду, что полного разделения альбуминов и глобулинов как при этой концентрации сульфата аммония, так и при других не происходит. В воде глобулины нерастворимы, по-этому выпадают в осадок при отделении солей диализом. Глобулины составляют большую часть белков семян многих растений» особенно бобовых и масличных, например легумин в семенах гороха, фазеолин — фасоли, эдестин — конопли.
Проламины. Хорошо растворимы в 60—80%-ном этиловом спирте, в их составе много аминокислоты пролина, а также глутаминовой кислоты. В очень незначительном количестве в эти белки входят лиз, ара, гли. Проламины характерны исключительно для семян злаков, где выполняют роль запасных белков: в семенах пшеницы и ржи — белок глиадин, в семенах ячменя — гордеин, кукурузы — зеин. Все указанные проламины представляют собой комплексы белков, различающихся по составу и молекулярной массе.
Глютелины. Хорошо растворимы в щелочных растворах (0,2—2% NaOH). Это белки растений, содержатся в семенах злаков и других культур, а также в зеленых частях растений. Комплекс щелочерастворимых белков семян пшеницы получил название глютенин, риса — оризенин. Глиадин семян пшеницы в соединении е глютенином образует клейковину, свойства которой в значительной мере определяют технологические качества муки и теста.
Гистоны. Представляют собой щелочные белки с молекулярной массой 12 000—30 000, на долю основных кислот в них приходится 20—30%. Гистоны растворимы в слабых кислотах (0,2 н. НСl), осаждаются аммиаком, спиртом. Они не содержат триптофана и, в большинстве случаев, цистеина, цистина. Гистоны присутствуют главным образом в ядрах клеток животных, растений и играют важную роль в структуре хроматина, так как количественно преобладают среди белков хромосом.
Гистоны — сравнительно консервативные в эволюционном плане белки. Показано, что гистоны животных и растений характеризуются близкими величинами отношения ара к лиз и содержат довольно сходный набор фракций.
Согласно данным рентгеноструктурного анализа и электронной микроскопии гистоны не найдены в хромосомах тех организмов, которые не имеют оформленного клеточного ядра (бактерии, сине- зеленые водоросли). Вместе с тем следует отметить, что фракции белков, богатые лиз и ара, выделены из клеток ряда бактерий и некоторых синезеленых водорослей. Противоречивы данные о содержании гистонов в грибах.
Протамины. Это сильно основные белки с низкой молекулярной массой (до 12 000), благодаря чему некоторые из них проходят через целлофан при диализе. Протамины растворимы в слабых кислотах, не осаждаются при кипячении; в их молекуле содержание щелочных аминокислот составляет около 80%, особенно много apa. В протаминах нет цис, три и асп, очень часто отсутствуют тир, фен, поэтому они не дают многих цветных реакций на белок. Благодаря высокой концентрации в молекуле протаминов основных аминокислот, она представляет собой поливалентный органический катион и легко реагирует с молекулами, имеющими избыток отрицательно заряженных групп, в частности нуклеиновыми кислотами.
Протамины широко распространены в природе. Они содержатся в половых клетках животных и человека и составляют основную массу белков хроматина этого типа. Протамины придают ДНК биохимическую инертность, что является необходимым условием сохранения наследственных свойств организма. Показано, что синтез протаминов происходит в процессе сперматогенеза в цитоплазме половой клетки, после этого протамины фосфорилируются, проникают в клеточное ядро и по мере созревания спермы вытесняют гистоны из нуклеопротеина, образуя прочный комплекс с ДНК. В результате такого взаимодействия наследственные свойства организма оказываются защищенными от неблагоприятных воздействий. Протамины в большом количестве встречаются в сперме рыб; наиболее хорошо из них изучены сальмин из лососевых рыб, клупеин из сельди. Протамины обнаружены и у представителей растительного царства — они выделены из спор плауна.
Протеиноиды. Трудно растворимые белки, для них характерно высокое содержание серы. К протеиноидам относятся фибриллярные белки: фиброин — белок шелка, кератины — белки волос, рогов, копыт, коллагены — белки соединительной ткани, спонгин — белок морских губок и др.
2.5.3. Сложные белки; Липопротеины. Простетической группой в этих сложных белках являются различные жироподобные вещества — липиды. Связь между компонентами липопротеинов может быть различной степени прочности. Полагают, что основной вклад в стабилизацию комплексов дают силы слабого взаимодействия (гидрофобные, ионные, водородные), роль ковалентных связей незначительна.
В составе липопротеинов обнаружены как полярные, так и нейтральные липиды, а также холестерин и его эфиры. Липопротеины широко распространены в природе, встречаются у всех представителей живых организмов. Они являются обязательными компонентами всех клеточных мембран, где их небелковая часть представлена, в основном, полярными липидами — фосфолипидами, гликолипидами. Липопротеины всегда присутствуют в крови (см. разд. 2.5.4). Инозитолдифосфатсодержащий липопротеин выделен из белого вещества мозга, в состав липопротеинов серого вещества мозга входят сфинголипиды. У растений значительная часть фосфолипидов в протоплазме находится также в форме липопротеинов.
Известны комплексы липидов и белков, белковая часть которых содержит много гидрофобных аминокислот, липидный компонент часто преобладает над белковым. В результате такие сложные белки растворимы в органических растворителях, например в смеси хлороформа и метанола. Подобного рода комплексы называются протеолипидами. Они в большом количестве содержатся в миелиновых оболочках нервных клеток, а также в синаптических мембранах и внутренних мембранах митохондрий.
Фосфопротеины. Характерной особенностью фосфопротеинов является присутствие в значительных количествах ортофосфорной кислоты, которая связана обычно с оксигруппой сер, реже трe сложноэфирной связью. Другие оксиаминокислоты (тирозин, гидроксипролин) не образуют фосфорные эфиры.
К фосфопротеинам относятся многие белки, играющие важную роль в питании молодых организмов. Это основной белок молока казеин, осаждающийся при створаживании, яичного желтка — вителлин и фосвитин, икры рыб — ихтулин. Они содержат 1—10% фосфора. Фосфопротеины обнаружены в мозге.
Казеин кроме фосфорной кислоты имеет углеводный компонент молекулы, поэтому является фосфогликопротеином. Относительно кратковременное фосфорилирование самых разнообразных белков (ферментативных, мембранных, рибосомальных и др.) происходит при участии особой группы ферментов — протеинкиназ. Такого рода фосфорилирование имеет регуляторный, временный характер, и эти белки, видимо, следует отличать от структурно-постоянных фосфопротеинов.
Металлопротеины. Комплексы ионов металлов с белками, в которых ионы металлов присоединены к белку непосредственно, являясь составной частью структуры белковых молекул, называются металлопротеинами. Некоторые авторы относят к металлопротеинам и те белки, которые помимо металла имеют металлсвязывающие простетические группы, например порфириновая группа в гемоглобине, хлорофилле. Однако эта точка зрения не является общепринятой.
В составе металлопротеинов часто встречаются такие металлы, как Cu, Fe, Zn, Mo и др. Типичными металлопротеинами являются некоторые ферменты, содержащие перечисленные металлы, а также Mn, Ni, Se, Ca и др. (см. разд. 3.4.2).
К медьсодержащим белкам относятся, например, цитохромо- ксидаза, пластонианин (переносчики электронов), белок крови церулоплазмин; к железосодержащим — лактоферрин (белок молока), трансферрин (белок крови), ферритин и др. В сыворотке крови найден специфический никельсодержащий белок класса макроглобулинов, названный никелеплазмином.
Обнаружены белки — селенопротеины, в которых селен, вероятнее всего, ковалентно присоединен к ароматической или гетероциклической (гем) группе. Один из селенопротеинов содержится в мышцах животных.
У некоторых морских животных обнаружен белок, содержащий ванадий, — ванадохром, являющийся, вероятнее всего, переносчиком кислорода.
Гликопротеины. Это сложные белки, в составе которых имеется углеводный компонент. Белок в данных соединениях является своеобразной основой, к нему прикрепляются углеводные группировки. Общепризнанная и устоявшаяся классификация этих белков отсутствует. В соответствии с особенностями химического строения гликопротеины могут быть подразделены на истинные гликопротеины и протеогликаны (гликозаминопротеогликаны).
Основное различие между ними заключается в том, что углеводные группировки истинных гликопротеннов содержат обычно до 15—20 моносахаридных компонентов, не образующих повторяющихся олигосахаридных фрагментов, в то время как у протеогликанов они построены из очень большого числа повторяющихся единиц, в основном имеющих своеобразный дисахаридный характер.
Истинные гликопротеины. Молекулярная масса истинных гликопротеинов варьирует в широких пределах, достигая иногда 1 млн. и более. Особенно велика молекулярная масса у гликопротеинов слюны. На долю углеводного компонента в гликопротеинах приходится от 1—3% (овальбумин) до 80—90% (групповые вещества крови) массы всей молекулы. В значительных пределах колеблется и число углеводных цепей, приходящихся на одну молекулу. Так, в трансферрине, рибонуклеазе их количество не превышает 1—4, а у групповых веществ крови, муцинов слюны достигает 300—800. Углеводные цепочки, разветвленные или линейные, всегда ковалентно связаны с пептидной частью молекулы.
В составе углеводных компонентов обнаружено более 10 различных моносахаридов: D-галактоза, D-манноза, D-глюкоза, N-ацетилглюкозамин и N-ацетилгалактозамин, дезоксисахара (L-фукоза, L-рамноза), D-ксилоза, L-арабиноза. Типичным компонентом гликопротеинов является также нейраминовая кислота (см. разд. 6.2.3), которая благодаря наличию карбоксильной группы (при физиологических значениях pH) придает молекуле углеводсодержащих соединений отрицательный заряд. Нейраминовая кислота чаще встречается в форме сиаловых кислот, которые наряду с фукозой обычно занимают терминальное положение в углеводных цепях гликопротеинов.
Ковалентную связь между углеводной и белковой частями гликопротеинов могут образовывать различные группировки. Очень распространен гликозиламидный тип связи между N-ацетилглюкозамином и ß-амидным азотом аспарагина.
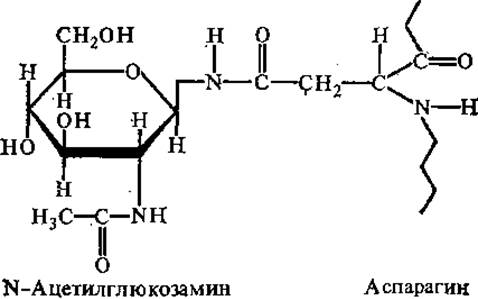
Другим типом углеводпептидной связи в гликопротеинах является О-гликозидный. В образовании этой связи чаще всего участвуют сер или тре и N-ацетилгалактозамин или галактоза.
В коллагене встречается галактозил-гидроксилизиновая О-гликозидная связь, а в углеводсодержащих белках высших растений — арабинозил-гидроксипролиновая. В гликопротеинах мочи человека обнаружена также S-гликозидная связь галактозы с цистеином и О-гликозидная связь фукозы с треонином. В молекулах одних и тех же гликопротеинов может встречаться более чем один тип углеводпептидной связи.
Протеогликаны. Молекулярная масса протеогликанов велика и достигает иногда нескольких миллионов за счет большого числа чередующихся дисахаридных звеньев. Растворы этих углеводсодержащих белков обладают высокой вязкостью. Протеогликаны состоят из небольшой белковой части, к которой ковалентно присоединяется значительное число (несколько десятков) гетерополисахаридных цепей, содержащих в своих молекулах остатки аминосахаридов и уроновых кислот.
Углеводные компоненты протеогликанов, называемые гликозаминогликанами, представлены в основном следующими полисахаридами: гиалуроновой кислотой, хондроитинсульфатами, гепарином, гепарансульфатом и кератансульфатами. Все эти полисахариды содержат чередующиеся парные звенья, состоящие из остатков аминосахаридов, гексуроновых кислот и реже моносахаридов (см. разд. 6.4). В протеогликанах, содержащих гиалуроновую кислоту, на долю белковой части приходится 0,4—2% от всей массы молекулы, в случае хондроитинсульфатов — 17—22%.
Углеводпептидная связь может осуществляться через О-гликозидную связь D-ксилозы с сериновым остатком пептидной цепи (у хондроитинсульфатов, гепарина) или N-ацетилглюкозамина с треонином, а также гликозиламидную связь N-ацетилглюкозамина с аспарагином (у кератансульфатов).
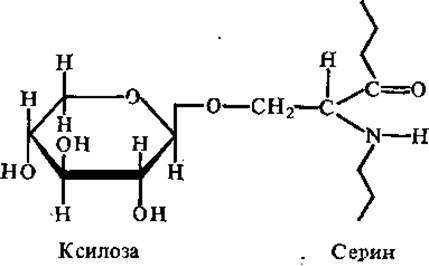
Ксилоза не входит в состав гликозаминогликанов, а выполняет роль вставочного, связующего компонента между полисахаридом и белком. Протеогликаны обладают полианионными свойствами, так как в них присутствуют карбоксильные группы уроновых кислот и сульфатные группы аминосахаридов.
Биологическая роль гликопротеинов. Углеводсодержащие белки широко распространены в живых организмах, они встречаются у животных, растений и микроорганизмов, где выполняют самые разнообразные функции.
1. Функция избирательного взаимодействия, высокоспецифического узнавания. В состав поверхностных мембран наряду с другими компонентами входят гликопротеины, участвующие в очень тонких процессах биологического узнавания и межклеточного взаимодействия, выполняющие роль рецепторных систем для определенных соединений и клеток. Так, эпителиальные клетки слизистой оболочки кишечника снабжены рецепторами, специфически связывающими клетки инфицирующих организм бактерий и вирусов.
Определенные гликопротеины эритроцитарных мембран ответственны за избирательное присоединение вируса гриппа. Специфическое связывание гормонов с поверхностью клеток-мишеней обеспечивается во многих случаях углеводсодержащими соединениями этих клеток. Такого типа рецептор для инсулина существует на поверхности клеток печени, жировой ткани и лимфоцитов. Гормоны с предварительно отщепленными концевыми сиаловыми кислотами при введении в кровоток не достигают клеток-мишеней. Несомненна также важнейшая роль углеводного компонента гликопротеинов в определении специфичности многих антигенов. Это относится прежде всего к групповым веществам крови и растворимым групповым веществам биологических жидкостей (слюна, молоко, семенная жидкость).
Антигенные комплексы бактерий имеют очень сложную химическую структуру, состоят из белкового, полисахаридного и липидного компонентов. Комплексные антигены многих бактерий, токсичные для человека и животных, называются эндотоксинами. Детерминирующие участки полисахаридных компонентов макромолекул эндотоксинов определяют их антигенную специфичность. Пептиды также являются иммунодетерминантами и увеличивают иммуногенность макромолекул. В липидном компоненте локализованы все или большинство активных токсичных участков, он определяет также пирогенное действие.
Акцептирование бактериальных токсинов клетками организма- «хозяина» также происходит с участием гликопротеинов.
Углеводный компонент гликопротеинов является своего рода указателем, в котором при помощи последовательности сахаров в углеводной цепи записано, куда должна следовать молекула — выходить из клетки, поступать в клеточные мембраны различных органов или субклеточные мембраны.
Гликопротеины являются распространенными компонентами семян растений. Так, в семенах фасоли содержится вицилин — белок, в состав которого входит манноза и N-ацетилглюкозамин, в семенах клещевины — белок рицин, обладающий способностью избирательно осаждать группоспецифические вещества крови и агглютинировать эритроциты. Соединения, обладающие таким свойством и выделенные из растений, называются фитогемагглютининами и относятся к группе лектинов. Под лектинами понимают белки неиммунного происхождения, в том числе и гликопротеины, способные специфически связывать полисахариды и углеводсодержащие биополимеры, не вызывая их химического превращения. В частности, взаимодействие лектинов с углеводсодержащими соединениями проявляется в виде реакции агглютинации частиц и клеток, например, эритроцитов, или преципитации полисахаридов и гликопротеинов.
К настоящему времени лектины обнаружены у организмов, находящихся на разных ступенях эволюционной лестницы: у бактерий, водорослей, грибов, моллюсков, рыб, млекопитающих и других животных. В связи с этим предлагают применять термины «фитолектины», «зоолектины», «миколектины» и т. д.
У млекопитающих некоторые лектины, вероятно, принимают участие в формировании органов в процессе эмбриогенеза, поскольку в больших количествах встречаются в тканях зародыша и плода. Кроме того, у животных лектины, очевидно, участвуют в компартментализации специфических гликопротеинов в клетке. Разнообразные функции лектинов в той или иной мере связаны со способностью узнавания клеток и клеточных компонентов, организации их избирательного взаимодействия.
Лектины широко распространены в растениях, предполагают, что они могут участвовать в регулировании клеточного деления и прорастания семян. Лектины играют важную роль в процессах узнавания при образовании симбиотических сообществ, в частности, между бобовыми растениями и азотфиксирующими клубеньковыми бактериями. Такую же роль выполняют лектины грибов при образовании лишайников. Лектины принимают участие и в формировании паразитических межвидовых сообществ: высшее растение — бактерии, высшее растение — грибы. Важна роль лектинов в клеточном узнавании при формировании колониальных микроорганизмов. Межклеточная адгезия за счет лектинуглеводного узнавания хорошо показана при образовании клеточных слизевиков из одноклеточных миксамеб. Высказывают предположения об участии лектинов и в транспорте ассимилятов по флоэме растений, что также объясняется их участием в избирательном акцептировании.
Поскольку связывающие участки лектинов специфичны к определенным углеводным остаткам, с их помощью в настоящее время выявляют архитектонику клеточных поверхностей.
Таким образом, во многих случаях, когда в живых организмах имеет место тонкая биохимическая специфичность и происходит высокоизбирательное узнавание, принимают участие углеводы. Особенно важны в этом отношении углеводные компоненты гликопротеинов, содержащие большое разнообразие моносахаридных остатков в различных сочетаниях, что в комплексе с белками создает возможность большой биохимической специфичности.
2. Транспортная функция. Ряд гликопротеинов, циркулирующих в кровяном русле человека и животных, являются транспортными белками, например функцию переносчика железа выполняет трансферрии, меди — церулоплазмин, стероидных гормонов — транскортин. Главный интегральный белок эритроцитарной мембраны участвует в транспорте анионов и, возможно, глюкозы.
3. Каталитическая функция. Углеводный компонент обнаружен в составе некоторых ферментов, в частности энтерокиназы, такаамилазы, пероксидазы, глюкозооксидазы, сывороточной холинэстеразы, расщепляющей ацетилхолин и участвующей в передаче нервного возбуждения, РНКазы В и др.
4. Структурно-механическая функция. Эту функцию выполняют у различных видов живых организмов в основном протеогликаны. У позвоночных животных они входят в состав межклеточного вещества соединительной ткани. Протеогликаны содержатся в коже, костях, хрящах, синовиальной жидкости суставных сумок, сухожилиях, клапанах сердца, стекловидном теле, роговице глаза и других тканях. Они придают им эластичность и устойчивость по отношению к сжатию. Протеогликаны, содержащие гиалуроновую кислоту, образуют очень вязкие растворы, что повышает стойкость ткани к проникновению инфекции. У многих бактерий защитная капсула ткани в основном построена из сложных белков, включающих гиалуроновую кислоту. Кроме того, данный протеогликан наряду с хондроитинсульфатом. А выполняет роль смазки в суставах. Функцию защитной смазки выполняют гликопротеины — основные составные вещества муцинов слюны, желудочного и кишечного муцинов. Гликопротеины являются широко распространенными структурными компонентами различных клеточных мембран.
Помимо перечисленных гликопротеины выполняют в организме и ряд других функций. К гликопротеинам относятся фибриноген, протромбин и некоторые другие факторы свертывания крови. В печени синтезируется гликозаминогликан — гепарин — важнейшее противосвертывающее вещество. Гликопротеинами являются и иммуноглобулины (см. разд. 5.5), некоторые гормоны — гонадотропные, фолликулостимулирующий, тиреоглобулин, ингибитор размножения вирусов животных — интерферон. С наличием гликопротеинов в оболочке ряда вирусов связывают гемагглютинирующую активность последних.
Углеводный компонент повышает стабильность молекул гликопротеинов, предохраняя их от действия протеолитических ферментов. Небелковая часть ряда сывороточных гликопротеинов определяет период их полураспада. В сыворотке крови и мышцах антарктических рыб обнаружены гликопротеины — антифризы, защищающие клетки от замораживания. Некоторые соединительно-тканные протеогликаны (хондроитинсульфаты) способны набухать с поглощением большого количества воды, в связи с чем иногда играют роль депо воды.
К гликопротеинам относится белок яиц — авидин. Он взаимодействует с витамином Н (биотин), препятствует его всасыванию из кишечника, что приводит к острой биотиновой недостаточности. Авидин применяется в опытах in vitro в качестве ингибитора биотинсодержащих ферментов.
Хромопротеины. К хромопротеинам относятся сложные белки, у которых небелковой частью являются окрашенные соединения, принадлежащие к различным классам органических веществ: порфириновые структуры, флавинадениндинуклеотид (ФАД), флавинаденинмононуклеотид (ФМН) и др. Порфириновое кольцо с координационно связанным с ним ионом железа входит как простетическая часть в состав ряда окислительно-восстановительных ферментов (каталаза, пероксидаза) и группы переносчиков электронов — цитохромов. Хромопротеинами являются и флавиновые дегидрогеназы или «желтые дыхательные ферменты» — флавопротеины (ФП). Белковая часть их молекулы связана с ФАД или ФМН. Более подробно ФП освещены в гл. 3. Типичными хромопротеинами являются родопсин (см. разд. 10.2), гемоглобин крови.
Важнейшая группа сложных белков — нуклеопротеины рассматривается в гл. 4.
Гемоглобин и другие дыхательные пигменты. Гемоглобин (сокращенное обозначение — Нb) составляет молекулярную основу дыхательной функции крови, т. е. способности транспортировать О2 и СО2.
Первые подробные исследования строения гемоглобина были выполнены в 1896—1901 гг. профессором Петербургского института экспериментальной медицины М. В. Ненцким. Он же впервые предложил структурную формулу небелкового компонента гемоглобина, в основе которой лежали 4 пиррольных цикла, расположенные вокруг атома железа, что правильно отражает основные структурные особенности небелковой части молекулы. К настоящему времени установлено, что гемоглобины различных видов состоят из белка глобина и гема (ферропротопорфирина), нековалентно связанных между собой. Отличия в свойствах гемоглобинов у разных видов животных обусловлены, в основном, глобиновым компонентом.
Гем. Гем представляет собой достаточно плоскую молекулу, по форме приближающуюся к квадратной, в которой ион Fe2+ находится в центре ядра протопорфирина IX, причем его четыре лигандных места заняты атомами азота пиррола. Протопорфирины могут существовать в пятнадцати изомерных формах, поскольку содержат три различных вида заместителей. В их состав входят четыре метальные группы, две винильные и два остатка пропионовой кислоты. Протопорфирин IX — самый распространенный из пятнадцати возможных изомеров. Кроме гемоглобина он содержится в миоглобине и большинстве цитохромов. Хелатный комплекс протопорфирина с Fe2+ называется протогемом или гемом.
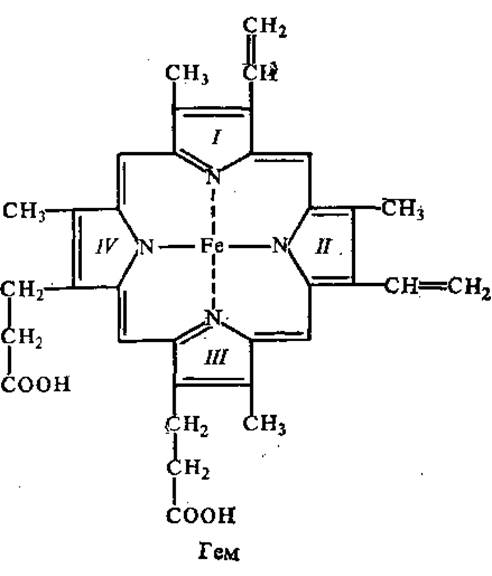
Молекулярным кислородом и другими окислителями в присутствии соляной кислоты или щелочей гем окисляется до гемина, в котором трехвалентное железо связано с анионом хлора, или до гематина, в котором третья валентность занята гидроксилом. Порфириновое кольцо из четырех пиррольных ядер является основой не только гема, но и хлорофилла растений, на что указал еще в 1896 г. М. В. Ненцкий в работе «О биологической связи пигмента крови и листьев». В ней автор сделал широкое обобщение о единстве растительного и животного мира, связывая это с теорией Дарвина.
Глобин. Белок гемоглобина — глобин — у взрослого человека состоит из двух а- и двух ß-цепей. Субъединицы упакованы в тетрамере таким образом, что образуют макромолекулу сферической формы длиной 6,4 нм и шириной 5,5 нм. Каждая субъединица в одной из своих «складок» (так называемый «гемовый карман») содержит плоское кольцо гема. «Гемовый карман» как бы выстлан большим числом неполярных групп аминокислот, осуществляющих гидрофобное взаимодействие с пиррольными кольцами гема. Последний имеет также координационную связь с глобином, которая возникает между атомом железа гема и атомом азота в гистидине глобина. Четыре гема из четырех субъединиц ориентированы по отношению к молекуле в целом так, что одним краем каждый гем обращен к внутренней области молекулы, а другим — наружу, в сторону водносолевой среды.
Внутри глобинового тетрамера существует свободная полость, пронизывающая всю молекулу по ее высоте на 5 нм. В полость обращены в основном неполярные группы аминокислотных остатков и лишь единичные полярные. Между неполярными группами в водной среде возникают гидрофобные взаимодействия, которые, по-видимому, в известной мере защищают молекулу изнутри от контакта с водой и стабилизируют структуру в целом. Опытами с мечеными атомами установлено, что гемоглобин каждого эритроцита после своего образования не подвергается обновлению и остается практически в неизменном виде до разрушения эритроцита. Средняя «продолжительность жизни» эритроцитов около 4 месяцев. После их разрушения основная часть Fe (90%) не выделяется из организма, а идет на образование особого белка — ферритина, содержащего до 30% железа. Этот белок является, таким образом, запасным депо железа. Из ферритина железо поступает на образование новых эритроцитов в костном мозге.
Гетерогенность гемоглобинов. В организме могут одновременно присутствовать две и более фракций гемоглобина, отличающихся в основном первичной структурой протомеров глобина (т. е. последовательностью их аминокислотных остатков), а иногда и четвертичной структурой. Это явление получило название гетерогенности гемоглобинов. Различают три ее типа в популяции людей: 1. Гетерогенность обусловленная наличием минорных компонентов: если основные формы (НbА) состоят из двух а- и двух ß-цепей, то минорные Нb содержат вместо ß-цепей две δ-цепи, которые отличаются от ß-цепей десятью аминокислотными остатками. 2. Гетерогенность генетическая: у взрослого человека выявлено до 300 вариантов генетически детерминированных гемоглобинов. Многие из них функционально нормальны, некоторые служат причиной заболеваний. 3. Гетерогенность эмбриональная: представлена двумя фракциями так называемого «примитивного» гемоглобина, основная из них HbF (фетальный гемоглобин). В норме при рождении его содержание составляет 60—70% от всего Hb. С возрастом количество HbF резко снижается, у взрослых он отсутствует.
Свойства гемоглобина. Кооперативное взаимодействие субъединиц. В макромолекуле Нb существует подвижность субъединиц в процессе функционирования, при связывании и отдаче лигандов. В своем движении субъединицы взаимодействуют, создавая кооперативный эффект, сущность которого заключается в том, что сродство каждой из субъединиц к лиганду не остается постоянным, а меняется под влиянием соседних субъединиц. Благодаря кооперативному эффекту, отношение Нb к O2 меняется под влиянием самого O2 в ходе оксигенации: начальное присоединение O2, вызывая изменение конформации Нb, облегчает связывание последующих молекул кислорода. В результате зависимость степени оксигенации Нb от парциального давления O2 выражается кривой сигмоидной формы.
Кооперативный характер связывания O2 гемоглобином имеет большое физиологическое значение. В капиллярах легких при парциальном давлении O2 около 100 мм рт. ст. кооперативность приводит к почти полному насыщению гемоглобина кислородом. Когда же эритроциты проходят через капилляры кислородпотребляющих тканей, его парциальное давление падает примерно до 5 мм рт. ст., и кооперативность в этом случае способствует более полной разгрузке гемоглобина от кислорода, чем в том случае, если бы четыре гемогруппы действовали независимо.
Влияние pH. Концентрация Н+ существенно изменяет свойства НЬ, прежде всего его способность связывать O2. Это явление получило название эффекта Бора. В общей форме эффект Бора рассматривается как влияние pH среды на взаимодействие атома Fe в молекулах дыхательных пигментов с различными лигандами — O2, СО, NO. Сюда же относится зависимость от pH окисления Fe2+ до Fe3+.
В капиллярах, где парциальное давление O2 невелико и может накапливаться СO2 и молочная кислота, понижение pH приводит к тому, что оксигемоглобин отдает свой кислород более активно. В эффекте Бора протоны играют роль аллостерических регуляторов, присоединяющихся к амино- и имидазольным группам глобина. Аллостерическим регулятором конформационных равновесий в гемоглобине является также 2,3-дифосфорный эфир глицерина (дифосфоглицерат), содержание которого в эритроцитах человека приблизительно эквимолярно по отношению к гемоглобину. Дифосфоглицерат присоединяется между двумя ß-цепями дезоксигемоглобина, в результате этого сродство последнего к кислороду снижается, эритроциты могут отдавать тканям большую долю переносимого ими O2. Содержание дифосфоглидерата в эритроцитах варьирует в зависимости от физиологических условий: у людей, живущих в высокогорных районах, его концентрация выше. Присутствие дифосфоглицерата в эритроцитах характерно не для всех видов животных; у птиц и черепах его заменяет, по-видимому, инозитолпентафосфат.
Формы гемоглобина. Оксигемоглобин (НbO2). Атомы Fe каждой из гем-групп молекулы Нb могут обратимо связывать молекулу O2. Полностью оксигенированный Нb называется оксигемоглобін ном, содержит четыре молекулы O2 на молекулу гемоглобина.
Валентность железа гема при образовании оксигемоглобина не меняется. Гемоглобин обладает уникальной способностью обратимо связывать O2, образуя стабильный комплекс без окисления Fe2+ до Fe3+. В геме четыре лигандные группы порфирина образуют комплекс с железом, имеющий плоскостное строение. Оставшиеся пятая и шестая координационные связи железа располагаются перпендикулярно плоскости порфиринового кольца. Пятая связь при этом занята имидазольным остатком гис, a шестая или остается незамещенной (дезоксигемоглобин), или замещается кислородом (оксигемоглобин). Окисление Fe2+ до Fe3+ в реакции O2 с гемом возможно только в растворах с высокой диэлектрической проницаемостью, а в гидрофобном гемовом кармане, из которого вытесняется вода, создается среда с низкой диэлектрической постоянной.
Карбаминогемоглобин. СO2 может связываться с Нb с образованием карбаминогемоглобина:
![]()
СO2 связывает только N-концевые а-аминогруппы. Реакция легко обратима. Образование карбаминогемоглобина определяется парциальным давлением СO2, имеет прямое отношение к транспорту СO2 кровью.
Карбоксигемоглобин (НbСО). Нb может соединяться с четырьмя молекулами СО (угарный газ) с образованием СО-гемоглобина или карбоксигемоглобина, который является фоточувствительным и диссоциирует на свету с выделением СО. Fe гема при этом остается двухвалентным. Сродство Нb человека к СО более чем в 200 раз превышает сродство к O2, т. е. для образования НbСО требуется в 200 раз более низкое парциальное давление СО, чем, соответственно, для НbO2—O2. В результате этого при вдыхании воздуха, содержащего угарный газ, большая часть гемоглобина крови переходит в карбоксигемоглобин, оксигемоглобин не образуется, нарушается перенос O2 от легких к тканям, в чем и заключается механизм отравления угарным газом. Смерть наступает вследствие недостаточного снабжения тканей (в первую очередь мозга) кислородом уже при связывании 70% НЬ угарным газом. Своевременное увеличение парциального давления O2 (вдыхание чистого кислорода) может вызвать достаточное превращение НbСО в НbO2.
Метгемоглобин (Met-Hb). Пероксиды, ферицианид, оксиды азота и хиноны могут окислять Fe2+ в гемоглобине до Fe3+с образованием метгемоглобина, который не присоединяет ни O2, ни СО. Он имеет коричневый цвет, образуется in vivo в норме, но в небольших количествах и ферментативным путем восстанавливается до Нb. Так как Met-Hb не может служить переносчиком O2, при образовании в организме значительных его количеств (например, при отравлениях анилином, нитробензолом, оксидами азота) наступает кислородное голодание, а в тяжелых случаях и смерть. Однако превращение небольшой части гемоглобина в метгемоглобин менее опасно, чем образование НbСО, поскольку Met-Hb постепенно восстанавливается в организме в гемоглобин.
Функции гемоглобинов. Основные функции гемоглобинов: 1) транспорт O2, 2) транспорт СO2, 3) поддержание постоянной буферной емкости крови.
В легких, благодаря имеющемуся градиенту O2, последний диффундирует через стенки капилляров и плазму и попадает в эритроциты. Нb артериальной крови насыщается O2 на 96%. В тканях O2 диффундирует из эритроцитов через плазму в интерстициальную жидкость (межтканевая), а затем в клетки ткани, в то же время СO2 диффундирует в обратном направлении.
Транспорт СO2 от тканей до альвеолярного воздуха осуществляется небольшой частью в виде карбаминогемоглобина. Основная часть СO2 под действием карбоангидразы гидратируется до Н2СO3, которая затем диссоциирует. Около 60% СO2 транспортируется в виде НСО-3 венозной плазмой и около 32% в виде карбамино-СO2 и НСО з эритроцитами. Однако и транспорт 60% НСО-3 венозной плазмы косвенно обеспечивается Нb, так как он служит акцептором водорода при диссоциации Н2СO3.
Гемоглобин — функционально более слабая кислота, чем НbO2. Эти два белка образуют буферную систему, которая способствует поддержанию pH крови на постоянном уровне.
Обмен гемоглобина. Срок жизни эритроцитов 120 суток. В 1 сутки из разрушившихся эритроцитов освобождается 8—9 г Нb. Разрушение эритроцитов и распад гемоглобина происходят главным образом в печени, селезенке и костном мозге. Распад Нb начинается с разрыва одной а-метиновой связи (между 1-м и 2-м порфириновыми кольцами) под действием НАДФ-содержащей оксидазы. Образуется зеленый пигмент вердоглобин, в котором еще содержатся железо и глобин. Дальнейший распад протекает, видимо, спонтанно. Отщепляются железо, глобин и образуется один из желчных пигментов — биливердин. Биливердин восстанавливается НАДФН- зависимой дегидрогеназой до билирубина, который из печени вместе с желчью изливается в желчный пузырь.
В крови взрослого человека содержание билирубина относительно постоянно—от 2,5 до 12 мг/л. Возрастание концентрации билирубина в крови до 20 мг/л приводит к возникновению желтухи, дальнейшее увеличение его содержания в крови вызывает явления тяжелого отравления. Поступая с током крови в печень, билирубин обезвреживается путем связывания с глюкуроновой кислотой. Окончательный распад билирубина происходит в кишечнике под действием бактерий: отщепляется глюкуроновая кислота, а билирубин восстанавливается в стеркобилиноген, который выводится с калом.
Миоглобин. Миоглобин — небольшой глобулярный белок (М 17 000); молекула его состоит из одной полипептидной цепи (153 аминокислотных остатка) и одного гема. Таким образом миоглобин представляет собой как бы 1/4 молекулы Нb. Известна полная аминокислотная последовательность полипептидной цепи миоглобина. Она несколько отличается у человека и различных видов животных, но характер укладки цепи во вторичную спираль и третичную конфигурацию в основных чертах одинаков. Молекула образует восемь сегментов из правых а-спиралей. В складке между сегментами расположен гем. Подобно гемоглобину он образует оксимиоглобин, карбокси- и метмиоглобин.
Типы переноса кислорода к тканям у разных по эволюционному положению животных. По данным П. А. Коржуева (1964), примерно у 86% видов животных транспорт О2 осуществляется без участия дыхательных пигментов типа Нb. Из них у 78% видов (насекомые, многоножки, большинство паукообразных) О2 доставляется всем тканям и органам системой трахей, а у остальных 8% «беспигментных» видов (простейшие, губки, кишечнополостные, моллюски, иглокожие) — путем диффузии через поверхность тела. Дыхательные пигменты есть в крови или полостной жидкости только у 14% видов, но это наиболее высокоорганизованные животные, в том числе все позвоночные.
У наиболее примитивных животных переносчик О2 включен в клетки, суспендированные в целомической жидкости. С развитием циркуляции появились переносчики О2, растворимые в циркулирующей плазме. Важнейшим этапом в ходе эволюции был период появления специализированных клеток — эритроцитов, в которых сосредоточены высокие концентрации переносчиков, благодаря чему не происходит резкого увеличения вязкости и коллоидного осмотического давления циркулирующей крови.
Наиболее распространенным дыхательным пигментом является гемоглобин, который содержится почти у всех групп животных, начиная от простейших и кончая позвоночными. Близок по структуре гемоглобину хлорокруорин. Он находится в крови некоторых кольчатых червей. В его состав входит железо, однако порфирин хлорокруорина отличается от протопорфирина гема тем, что винильная группа у 2-го пиррольного кольца заменена на формильную.
В крови морских червей находится гемэритрин. Он встречается у небольшого числа многощетинковых червей и у одной формы брахиопод. Субъединицы этого белка обычно образуют октамеры, в каждом мономере имеется активный центр, содержащий два атома негемового Fe2+. В плазме крови многих моллюсков и членистоногих находятся гемоцианины — синие медьсодержащие пигменты, не имеющие гема.
2.5.4. Белки плазмы крови. Представители и функции. Если кровь предохранить от свертывания и с помощью центрифугирования осадить форменные элементы, то прозрачная светло-желтая надосадочная жидкость будет представлять собой плазму крови, В процессе свертывания крови из плазменного белка фибриногена образуются нити фибрина, которые вместе с форменными элементами крови дают сгусток. Жидкая часть свернувшейся крови называется сывороткой. Следовательно, плазма отличается от сыворотки наличием в ней белка фибриногена. На долю белков, растворенных в плазме, приходится около 7% ее массы. С помощью метода электрофореза в сыворотке было обнаружено пять главных фракций белков: альбумин, на долю которого приходится 54—58%, a1-глобулины — 6—7, а2-глобулины — 8—9, ß1-глобулины — 13— 14, у-глобулины — 11 —12%.
Методом электрофореза в крахмальном геле дополнительно обнаруживаются фракции преальбумина, ß-липопротеина и трансферрина. При иммуноэлектрофорезе выделяются также ß1-липопротеин, a1- и а2-липопротеины, гаптоглобин, церулоплазмин, LgG-глобулин.
Преальбумин. Содержание в плазме невысокое — 10—40 мг/100 мл. Его функция заключается в связывании и транспорте тироксина и ретинолсвязывающего белка.
Сывороточный альбумин содержится в плазме в значительном количестве — 3500—4500 мг/100 мл. Один из немногих белков плазмы, которые не являются гликопротеинами.
Основные функции альбуминов — осмотическая регуляция н транспорт. Осмотический эффект плазмы на 75—80% связан с альбумином, так как из основных белков плазмы, где он составляет более половины по массе, альбумин обладает наименьшей молекулярной массой. Транспортная функция альбуминов проявляется в переносе свободных жирных кислот из печени, билирубина в печень, где он экскретируется с желчью, стероидных гормонов. Ряд лекарственных препаратов, поступая в кровь, образуют прочные комплексы с альбумином. Альбумин может принимать участие в удалении ядовитых веществ, например тяжелых металлов. Альбуминам отводится большая роль в азотистом обмене тканей, содержание их может служить показателем восполнения белковых запасов организма.
а-Глобулины. Их обозначают как a1 и а2-глобулины в зависимости от электрофоретической подвижности. К арглобулинам относятся: a1-гликопротеин кислый (ретинолсвязывающий белок), a1-антитрипсин, транскортин (связывает транспортирует кортизол и кортикостерон), тироксинсвязывающий белок. К а2-глобулинам относятся: церулоплазмин, гаптоглобины, а2-макроглобулин и интер-а-трипсиновый ингибитор.
Церулоплазмин — основной медьсодержащий белок крови, относится к гликопротеинам, имеет голубой цвет, на его долю приходится 3% меди, содержащейся в организме. Церулоплазмин участвует в транспорте Сu, в поддержании ее уровня в тканях, особенно в печени. Церулоплазмин обладает ферментативными свойствами, полиаминоксидазной и ферроксидазной активностью. Последняя проявляется в катализе окисления Fe2+ в Fe3+. Важность этой реакции состоит в том, что лишь Fe3+ может присоединяться к транспортирующему железо белку трансферрину.
Гаптоглобины (Нр). Это агглобулины гликопротеинового строений, способные связываться с гемоглобином, в результате повышается устойчивость последнего и увеличивается время его жизни — в этом основная функция гаптоглобинов. Нр выполняют также неспецифическую защитную функцию, комплексируясь с различными белковыми и небелковыми веществами, появляющимися при распаде клеток, защищают ткани от протеолиза, участвуют в процессах детоксикации.
ß-Глобулины. Это целый ряд белков, в том числе и липопротеины. Трансферрин (Tf), или сидерофелин, является главным компонентом этой фракции. Он легко образует с Fe комплексное соединение, которое при определенных условиях также легко распадается. Благодаря этому свойству трансферрин выполняет важную физиологическую функцию по переводу железа плазмы в депонированную форму и доставке его в костный мозг (где железо используется при кроветворении) и другие ткани, особенно ретикулоэндотелиальной системы.
Гемопексин. Связывает гем, предотвращая выведение его с мочой.
Липопротеины. Содержатся в плазме крови в количестве 700—1100 мг/100 мл. В крови человека присутствуют несколько фракций липопротеинов, отличающихся по плотности, что связано с различным соотношением липидного и белкового компонентов в молекуле. Самая низкая плотность (менее 0,95 г⋅см-3) характерна для хиломикронов, на долю липидов в них приходится около 98%. Хиломикроны — это капельки липидов, стабилизированные небольшим поверхностным слоем белков. Липиды здесь представлены в основном триацилглицеринами (80%). Более высокую плотность имеют ß-липопротеины, их средняя молекулярная масса составляет 10 млн. Эти липопротеины плазмы разделяют (в свою очередь) на прелипопротеины, или липопротеины очень низкой плотности (ЛПОНП), и ß-липоротеины, или липопротеины низкой плотности (ЛПНП).
Липопротеины плазмы с плотностью 1,06—1,20 г⋅см-3 называют a1-липопротеинами или липопротеинами высокой плотности (ЛПВП), содержание липидов в них составляет примерно 65%. Наименьшее количество липидов характерно для а2-липопротеинов, липопротеинoв очень высокой плотности (ЛПОВП, плотность более 1,2 г∙см-3). На долю липидов в них приходится 43%. а-Липопротеины имеют молекулярную массу около 300 000, в них преобладают фосфолипиды. Классификация липопротеинов плазмы условна, поскольку их состав и плотность изменяются в процессе транспорта липидов к тканям.
Липопротеины крови представляют собой сферические частицы, диаметр которых уменьшается с увеличением плотности. Ядро этих частиц содержит неполярные липиды (триацилглицерины, эстерифицированный холестерин). Ядро окружено оболочкой, в состав которой входят фосфолипиды, белок и свободный холестерин. В настоящее время доказана роль некоторых фракций липопротеинов в патогенезе атеросклероза, они получили название атерогенных липопротеинов.
Атеросклероз возникает при значительном повышении в крови фракции ЛПНП, а во многих случаях и ЛПОНП. Атеросклероз — это липидное перерождение стенок артерий, образование бляшек, сужение просвета. Хиломикроны не могут проникать в стенку сосудов из-за своих больших размеров. ЛПВП имеют самый маленький размер, легко проникают в стенку, но и легко удаляются из нее в лимфу. Кроме того, в ЛПВП самый высокий процент белков и фосфолипидов, в связи с чем они быстро метаболизируются в стенке, не оседая в ней. Поэтому атерогенностью обладают ЛПНП и ЛПОНП, они достаточно хорошо проникают в стенку и очень богаты холестерином и триацилглицеринами (жирами), вызывающими атеросклероз. Есть указания, что в регуляции содержания ЛПНП и ЛПОНП в крови важнейшую роль играют белки — рецепторы ЛПНП. Они располагаются на поверхности клеток организма и извлекают частицы ЛПНП из крови. Затем ЛПНП переходят внутрь клеток, где холестерин освобождается и метаболизируется. Количество рецепторов может определяться как генетически, так и зависеть от ряда других факторов.
Механизм свертывания крови. Биологические и биохимические процессы, которые обеспечивают в организме предупреждение и остановку кровотечений, называются гемостазом. Он осуществляется следующими компонентами: 1) тромбоцитами, 2) сосудистой стенкой, 3) плазменной ферментативной системой свертывания. Последняя включает ряд веществ (факторы свертывания крови), которые в соответствии с рекомендациями Международного комитета по номенклатуре обозначают римскими цифрами (буква а рядом с номером фактора означает его активную форму). Ниже дана характеристика некоторых факторов свертывания.
Фактор I (фибриноген) присутствует в плазме крови теплокровных в концентрации от 0,17 до 0,4 г/100 мл. Гликопротеин, у которого три пары неидентичных полипептидных цепей соединены дисульфидными мостиками. Синтезируется в печени.
Фактор II (протромбин) — гликопротеин, играющий центральную роль в свертывании крови. Представляет собой профермент тромбина (фактор IIа).
Фактор Па (тромбин) относится к сериновым протеиназам. Осуществляет путем расщепления пептидных связей преобразование фибриногена в фибрин и превращение фактора XIII в фактор ХIIIа.
Фактор XII является ключевым ферментом внутренней активирующей системы протромбина, имеет гликопротеиновое строение. Активация фактора XII, осуществляемая путем его адсорбции на поверхностях иных, нежели нормальная эндотелиальная выстилка кровеносных сосудов, служит пусковым механизмом для цепной реакции последовательной активации ряда специфических протеин аз гемокоагуляционной системы.
Фактор XIII является проферментом трансглутаминазы. После перехода в активную форму (ХIIIа) катализирует синтез ковалентных связей, соединяющих между собой мономерные единицы в фибрине. При этом растворимый фибрин S переходит в нерастворимый фибрин I.
Калликрвин-кининовая система участвует в активации начальных этапов свертывания крови и в формировании «калликреинового моста» между факторами ХIIа и VII (рис. 2.22).
Важнейшими кининами плазмы являются пептиды брадикинин, каллидин и метиониллизил-брадикинин (см. разд. 2.5.1). Субстраты, из которых высвобождаются кинины, называются кинаногенами. Они представляют собой белки, связанные в плазме крови с «2-глобулиновой фракцией. Образование кининов из кининогенов происходит при участии специфических ферментов — калликреинов, являющихся протеиназами типа трипсина.
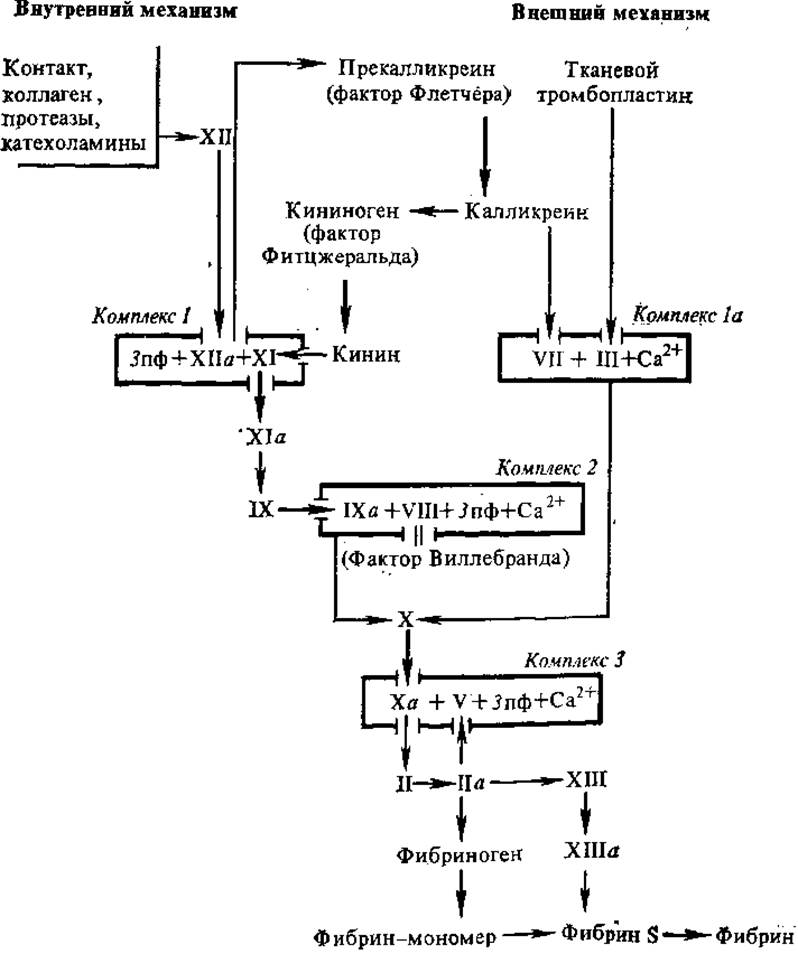
Рис. 2.22. Каскадно-комплексная схема свертывания крови:
фибрин S и фибрин I — растворимый и нерастворимый фибрин, а — активированные факторы, пф — пластиночный фактор
Участие тромбоцитов в гемостазе определяется основными функциями этих клеток: а) ангиотрофической, т. е. способностью поддерживать нормальную структуру и функцию микрососудов (диаметр до 100 мкм); б) способностью образовывать в поврежденных сосудах первичную тромбоцитарную пробку (адгезивно- агрегационная функция); в) способностью поддерживать спазм поврежденных сосудов; г) участием в свертывании крови и ингибирующим влиянием на фибринолиз. Если повреждение сосуда небольшое, тромбоцитарная пробка может остановить кровотечение.
Тромбоциты периодически смыкаются с эндотелиальными клетками и «изливают» в них свое содержимое, являются естественными «кормильцами» эндотелия. Последний не в состоянии извлекать ряд необходимых ему веществ прямо из плазмы.
Формирование тромбоцитарной пробки начинается с приклеивания (адгезии) тромбоцитов к субэндотелиальным структурам сосудистой стенки. Коллаген сосудистой стенки — главный стимулятор этого процесса. Тромбоциты, интенсивно склеиваясь друг с другом, образуют агрегаты. Одним из агрегирующих агентов является тромбин. Он вызывает агрегацию тромбоцитов, будучи в дозах, в несколько раз меньших, чем те, что необходимы для свертывания крови. Поэтому формирование тромбоцитарной пробки опережает свертывание крови.
В настоящее время свертывание крови рассматривают как многоэтапный каскадный ферментативный процесс, в котором последовательно активируются проферменты и действуют механизмы аутокатализа, функционирующие как сверху вниз, так и в направлении «обратной связи». В последние годы выяснилось, что на разных этапах процесса свертывания образуются белково-липидные комплексы, в составе которых активируются ферментные факторы. Неферментные компоненты этих комплексов ускоряют процесс и обеспечивают специфичность действия коагулирующих ферментов путем создания дополнительных мест связывания в комплексах фермент-субстрат. Каскадно-комплексная схема свертывания крови включает четыре типа комплексов.
Комплекс 1: факторы ХІІа + XI + фосфолипид = активатор фактора II.
Комплекс 1а: фактор III + фактор VII + Са2+ = активатор фактора X (внешний механизм).
Комплекс 2: факторы ІХа + VIII + Са2+ + фосфолипид = активатор фактора X (внутренний механизм).
Комплекс 3: факторы Ха + V + Са2+ + фосфолипид = активатор протромбина (протромбиназа).
Свертывание осуществляется с помощью двух механизмов, тесно связанных между собой, — внешнего и внутреннего (рис. 2.22).
Внешний механизм свертывания запускается тканевым тромбопластическим фактором (фактор III), который взаимодействует с фактором VII и при участии Са2+ образует комплекс 1а (активатор фактора X). Последний, будучи составной частью комплекса 3, трансформирует фактор II в фактор IIа.
Внутренний механизм свертывания запускается без добавления извне тканевого тромбопластина, т. е. за счет внутренних ресурсов крови или плазмы. Запуск внутреннего механизма начинается с активации фактора XII. Активация этого фактора может осуществляться коллагеном поврежденной сосудистой стенки, измененными клеточными мембранами, некоторыми протеазами, адреналином. Вне организма активация фактора XII наступает от контакта с чужеродными поверхностями — стеклом, иглами и т. д. Вслед за фактором XII последовательно активируются факторы XI (в составе комплекса 7), IX и VIII. Последние входят в состав комплекса 2, который активирует фактор X, т. е. опять-таки приводит к формированию протромбиназной активности, необходимой для превращения протромбина в тромбин. Тромбин (IIа) и фактор XIII необходимы для превращения фибриногена в фибрин, образования сгустка крови.
Этот процесс состоит из трех стадий. Молекула фибриногена содержит три пары неидентичных полипептидных цепей, соединенных дисульфидными мостиками (2аА, 2ßB, 2у). В первую, протеолитическую, стадию тромбин отщепляет фибринопептиды А от а (А)-цепей и фибринопептиды В от ß (В)-цепей, оставляя соответственно а- и ß-цепи, входящие в состав образующегося фибрин-мономера. Таким образом, полипептидная формула фибрин-мономера (а, ß, у)2. В следующую, полимеризационную, стадию мономерные молекулы соединяются друг с другом «бок о бок» и «конец в конец», формируя сеть фибрина с полипептидной формулой (а, ß, у)n. В последнюю, стабилизационную, стадию фибриновая сеть стабилизируется ковалентными связями под действием фермента, образующегося из фактора XIII.
Ферментная система, обеспечивающая лизис фибрина в кровяном русле, получила название фибринолитической или плазминовой системы. Этот лизис осуществляется фибринолизином, или плазмином, который находится в плазме крови в виде профермента плазминогена в концентрации около 20 мг%. Активаторами плазминогена служат протеиназы, в том числе змеиного яда, стрептокиназа из гемолитического стрептококка. Физиологическим активатором является урокиназа. Плазмин гидролизует в фибрине пептидные связи, образованные арг и лиз.
Антикоагулянты — вещества, предупреждающие процесс свертывания крови. Их можно разделить на две основные группы: физиологические и нефизиологические. К первым относятся гепарин, антитромбины, антитромбопластины и др. К нефизиологическим антикоагулянтам относят вещества, осаждающие Са2+ из плазмы (оксалаты, цитраты), антивитамины К (производные кумаринов), биологические яды (змей, пиявок), воздействие физико-химических условий (t°, ультразвук и т. д.).