Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Биосинтез белка
Трансляция и общие требования к синтезу белка в бесклеточной системе
Аминоацил-тРНК-синтетазы
Экспериментально доказано существование в любых клетках живых организмов специфических ферментов, катализирующих активирование аминокислот и связывание последних с определенными тРНК. Все эти ферменты выделены в чистом виде из Е. coli, секвенированы, и для ряда их установлена трехмерная структура.
Все они оказались чувствительными к реагентам на SH-группы и требуют присутствия ионов Mg2+. Ферменты обладают абсолютной специфичностью действия, поскольку они узнают только одну какую-либо L-аминокислоту или одну тРНК. Для тех аминокислот, для которых открыты две и более тРНК (см. далее), соответствующая аминоацил-тРНК-синтетаза катализирует аминоацилирование всех этих тРНК. Это обстоятельство чрезвычайно важно, поскольку в дальнейшем в белковом синтезе «узнавание» аминоацил-тРНК основано не на природе аминокислоты, а на химической природе антикодона тРНК. Считается, что в молекуле каждой аминоацил-тРНК-синтетазы имеется по крайней мере 3 центра связывания: для аминокислоты, тРНК и АТФ; ферменты весьма чувствительны также к аналогам аминокислот, которые ингибируют активирование соответствующих аминокислот. Некоторые ферменты состоят из одной полипептидной цепи, другие — из двух или четырех гомологичных или гетерогенных субъединиц.
Аминоацил-тРНК-синтетазы в последнее время стали делить на 2 класса в соответствии с различиями в их первичной и третичной структурах, а также в зависимости от своеобразия механизма катализируемой реакции. Первый класс включает ферменты, катализирующие синтез аминоацил-тРНК следующих аминокислот: Арг, Вал, Глн, Глу, Иле, Лей, Мет, Тир, Трп, Цис; второй класс — аминокислот Ала, Асн, Асп, Гис, Гли, Лиз, Про, Сер, Тре, Фен. Оказалось, что ферменты 1-го класса обеспечивают перенос аминоацильной группы сначала ко второй 2'-ОН-группе терминального остатка адениловой кислоты, затем перемещение ее к 3'-ОН-группе (путем реакции трансэтерификации), в то время как ферменты 2-го класса катализируют перенос аминоацильной группы непосредственно к 3'-ОН-группе концевого аденилового нуклеотида.
Аминоацил-тРНК-синтетазы в активном центре содержат гистидин, имидазольное кольцо которого участвует в связывании АТФ посредством ионов Mg2+. Наибольшим сродством эти ферменты, как было указано, обладают к молекулам специфических тРНК, хотя конкретный механизм, посредством которого ферменты узнают подходящую РНК, пока неясен. В то же время эти ферменты отличаются низкой молярной активностью (число оборотов не превышает нескольких сот каталитических актов в минуту).
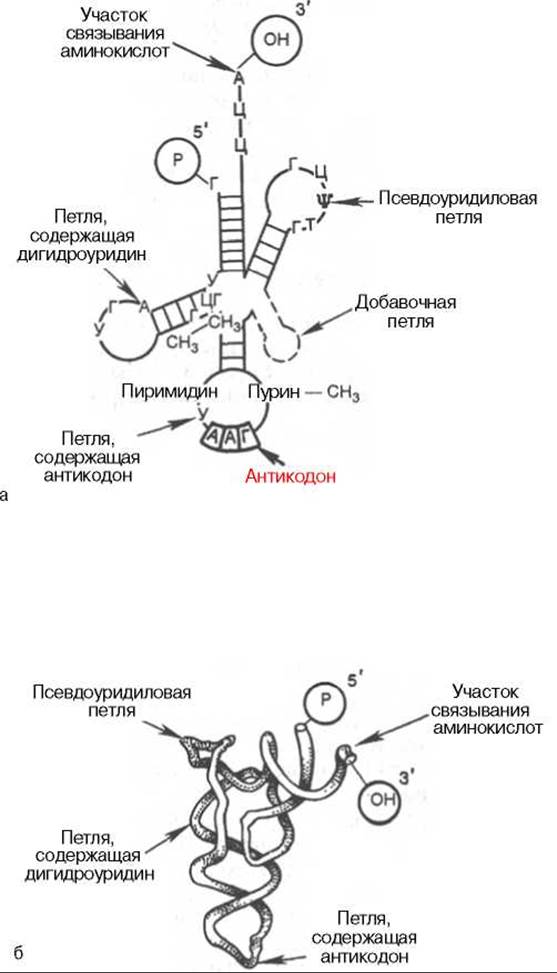
Рис. 14.3. Структура тРНК.
а - общая структура различных тРНК; б - пространственная структура тРНК.
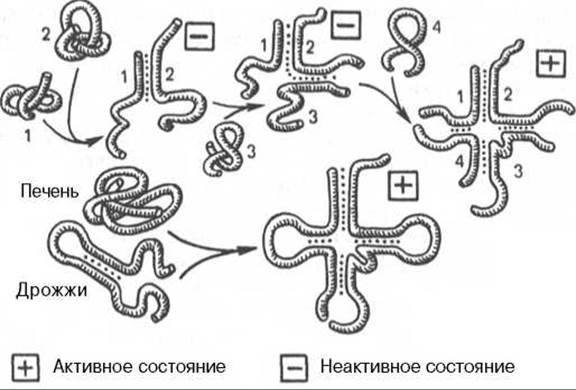
Рис. 14.4. Созревание валиновой тРНК (по А.А. Баеву). Цифрами обозначены фрагменты молекулы тРНК.