Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ IV. МОЛЕКУЛЯРНІ МЕХАНІЗМИ СПАДКОВОСТІ ТА РЕАЛІЗАЦІЇ ГЕНЕТИЧНОЇ ІНФОРМАЦІЇ
ГЛАВА 20. МОЛЕКУЛЯРНІ МЕХАНІЗМИ РЕПЛІКАЦІЇ ДНК ТА ТРАНСКРИПЦІЇ РНК
20.2. ФЕРМЕНТИ РЕПЛІКАЦІЇ ДНК У ПРОКАРІОТІВ ТА ЕУКАРІОТІВ
Дослідження А. Корнберга (відкриття ДНК-полімерази I)
Загальна схема біосинтезу ДНК у системі А. Корнберга
А. Корнберг та співавт. (Kornberg Artur, 1956) інкубували екстракти E. Coli, що містили ферменти та деяку кількість ДНК, із сумішшю дезоксинуклеозидтрифосфатів (дНТФ), а саме: дАТФ, дТТФ, дГТФ та дЦТФ.
Було встановлено, що в цих умовах синтезується певна кількість нової ДНК (точніше, полідезоксирибонуклеотиду), до складу якого входили дезоксинуклеозидмонофосфати (дНМФ) із складу дНТФ, що були використані для біосинтезу. При цьому новий ланцюг ДНК утворювався за рахунок приєднання дНМФ до кінця одного з ланцюгів ДНК, що вже існувала (передіснуючої ДНК).
Рівняння реакції в найпростішій формі має вигляд:
![]()
Фермент, що каталізував зазначену реакцію, отримав назву ДНК-полімерази I, і його вивчення дозволило з’ясувати деякі принципові особливості біосинтезу ДНК як у прокаріотів, так і в еукаріотів, хоча, як з’ясувалося, він не є основним ензимом в реплікації ДНК, а виконує в цьому процесі певні допоміжні функції.
Необхідність вихідної (передіснуючої) ДНК в системі Корнберга
ДНК-полімераза I, що здійснювала утворення 3'-5'-фосфодіефірних зв’язків в системі Корнберга, могла функціонувати тільки в присутності вже існуючої («передіснуючої») ДНК. Передіснуюча ДНК, що необхідна для утворення нового полідезоксирибонуклеотиду, виконує дві функції (рис. 20.6). Вона служить:
(1) затравкою для подовження ланцюга полідезоксирибонуклеотиду;
(2) матрицею, що визначає (програмує) послідовність включення в ланцюг, що синтезується, нових нуклеотидів.
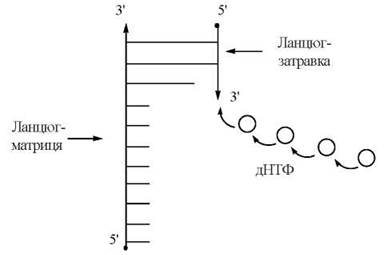
Рис. 20.6. Схема синтезу нового ланцюга ДНК при наявності ланцюга-затравки та ланцюга-матриці.
Пізніше було встановлено, що ДНК-полімераза I («фермент Корнберга») не є основним ферментом в реплікації ДНК у прокаріотів. Проте, певні особливості цього синтезу виявилися справедливими і для функціонування інших полімераз.
Особливості синтезу ДНК в ДНК-полімеразній системі:
- ДНК-полімераза не може синтезувати повністю новий ланцюг ДНК, а спроможна лише приєднувати дНМФ до вже існуючого ланцюга;
- синтез нового ланцюга ДНК відбувається в напрямку 5'-3', тобто ДНК-полімераза послідовно приєднує нуклеотиди (дНМФ з наявних дНТФ) до 3'-кінця одного з ланцюгів ДНК (ланцюга-»затравки»);
- для синтезу нового ланцюга ДНК необхідний також ланцюг-матриця; нуклеотиди сполучаються з 3'-кінцем ланцюга-»затравки» відповідно до нуклеотидної послідовності в ланцюгу-»матриці» (тобто, за принципом комплементарності).
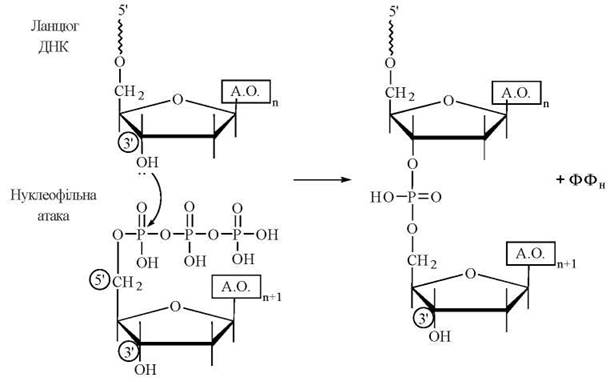
Механізм подовження (елонгації) ланцюга ДНК полягає в утворенні нових 3'-5'-фосфодіефірних зв’язків, що синтезуються в напрямку 5'→3'. При цьому відбувається нуклеофільна атака з боку вільної 3'-гідроксильної групи кінцевого нуклеотиду ланцюга, що вже існує, на α-фосфат дНТФ, який вступає в реакцію:
Ферменти біосинтезу ДНК у прокаріотів
1) ДНК-полімераза I — білок з м.м. 103 кД.
Біохімічні функції:
5'→3' — полімеразна активність (розглянута вище);
5'→3' — екзонуклеазна активність (тобто спроможність видаляти нуклеотиди вище від напрямку синтезу);
3'→5' — екзонуклеазна активність («коригуюча» активність, або спроможність видаляти вже включений нуклеотид, якщо він включений помилково, тобто не є комплементарним ланцюга-матриці);
2) ДНК-полімераза II (білок з м.м. 120 кД) не є основним в реплікації ДНК у прокаріотів; за уявленнями, що існують, переважною функцією цього ферменту є участь у репарації ДНК;
3) ДНК-полімераза III — головний фермент, що реалізує процес елонгації ДНК у E. Coli.
За своєю молекулярною будовою ДНК-полімераза III є асиметричним димером з м.м. близько 900 кД. Це мультисубодиничний фермент, ціла молекула якого (холофермент) містить у своєму складі 10 типів субодиниць — поліпептидних ланцюгів.
Фермент має 5'→3'-полімеразну, 3'→5'-екзонуклеазну та АТФ-азну активності. ДНК-полімераза III є високопроцесійним ферментом, що може, не залишаючи матрицю, каталізувати сполучення в ланцюг багатьох тисяч мононуклеотидів (на відміну від 15-20 нуклеотидів при дії ДНК-полімерази I). Швидкість полімеразної реакції складає близько 1000 нуклеотидів за секунду.
АТФ-азна активність є передумовою утворення комплексу холоферменту ДНК-полімерази з матрицею: спочатку АТФ взаємодіє з β-субодиницею холоферменту, а потім активований холофермент сполучається з матричним ланцюгом ДНК, що супроводжується гідролізом АТФ.
Ферменти біосинтезу ДНК в еукаріотів
У клітинах еукаріотів знайдено декілька типів ДНК-полімераз (табл. 20.1).
Таблиця 20.1. ДНК-полімерази еукаріотів
Тип |
Молекулярна маса, кД |
Локалізація в клітині |
α |
250 |
Ядро |
β |
39 |
Ядро |
γ |
200 |
Мтохондрії |
δ |
170 |
Ядро |
ε |
260 |
Ядро |
Ферментами, що відіграють основну роль у реплікації ДНК в еукаріотів, є ДНК- полімерази α та δ, які є високопроцесійними ферментами з 5'→3'-полімеразною активністю. Полімерази β та ε беруть участь в репарації ядерної ДНК, а γ-полімераза відповідає за реплікацію мітохондріальної ДНК.
Вміст ферменту ДНК-полімерази α помітно зростає під час S-фази клітинного циклу, коли відбувається активний синтез ДНК. Активність ДНК-полімераз α, δ та ε специфічно блокується афідиколіном — дитерпеноїдом з грибів, що діє як потужний антипухлинний антибіотик.