Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ IV. МОЛЕКУЛЯРНІ МЕХАНІЗМИ СПАДКОВОСТІ ТА РЕАЛІЗАЦІЇ ГЕНЕТИЧНОЇ ІНФОРМАЦІЇ
ГЛАВА 21. БІОСИНТЕЗ БІЛКІВ У РИБОСОМАХ
21.4. РЕГУЛЯЦІЯ ТРАНСЛЯЦІЇ. АНТИБІОТИКИ — ІНГІБІТОРИ ТРАНСЛЯЦІЇ
Становлячи кінцевий етап багатоступеневого процесу генної експресії, рибосомальний синтез поліпептидного ланцюга є об’єктом контролю з боку регуляторних систем клітини та впливу різних фізіологічно активних сполук.
Молекулярні механізми контролю трансляції
Механізмом контролю процесів трансляції в клітинах еукаріотів є ковалентна модифікація білкового фактора ініціації трансляції eIF-2, який може бути в дефосфорильованій (активній) та фосфорильованій (неактивній) формах.
Шляхом зворотного фосфорилювання — дефосфорилювання фактора ініціації eIF-2 за участю цАМФ-залежного регуляторного каскаду відбувається контроль синтезу в рибосомах ретикулоцитів білкової частини гемоглобіну — глобіну, залежно від адекватного постачання простетичної групи — гему.
Регуляція здійснюється за такою схемою (рис. 21.6):
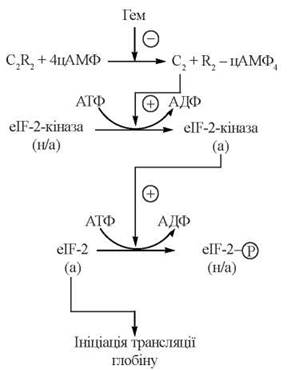
Рис. 21.6. цАМФ-залежна каскадна система регуляції трансляції глобіну (а — активні, н/а — неактивні форми відповідних білків).
(1) в ініціації синтезу глобіну бере участь фактор ініціації eIF-2, який може бути в дефосфорильованій (активній) та фосфорильованій (неактивній) формах;
(2) фосфорилювання α-субодиниці фактора ініціації синтезу глобіну eIF-2 специфічною eIF-2-протеїнкіназою інактивує фактор і тим самим блокує процес ініціації трансляції;
(3) активність eIF-2-кінази, що фосфорилює фактор eIF-2, контролюється (також шляхом фосфорилювання-дефосфорилювання) іншою протеїнкіназою, яка є цАМФ-залежною;
(4) у свою чергу, каталітична активність цАМФ-залежної протеїнкінази негативно контролюється гемом, який є інгібітором цієї кінази, що блокує вивільнення її каталітичної субодиниці.
Механізм, що розглянутий, забезпечує взаємну координацію кількості гему та глобіну: в умовах високої концентрації гему активність протеїнкінази, яка фосфорилює фактор eIF-2, блокується, що призводить до накопичення дефосфорильованої, тобто активної молекулярної форми фактора ініціації і, відповідно, — стимуляції синтезу глобіну; вичерпавши внутрішньоклітинний резерв гему, рибосомальна система синтезу глобіну переходить у неактивний стан, і утворення гемоглобіну гальмується.
Вплив фізіологічно активних сполук на процеси трансляції
Процеси рибосомальної трансляції, що складають кінцевий етап багатоступеневого процесу експресії генетичної інформації, є мішенню для дії багатьох фізіологічно активних сполук, зокрема лікарських засобів і токсинів.
1. У клінічній практиці, а також в експериментальній біології і медицині, знайшли широке застосування антибіотики, що є інгібіторами біосинтезу білка у прокаріотичних та еукаріотичних організмів на різних етапах трансляції:
(1) інгібітори ініціації: стрептоміцин, ауринтрикарбоксилова кислота;
(2) інгібітори елонгації: аміцетин, хлорамфенікол, еритроміцин, циклогексимід, пуроміцин, тетрацикліни;
(3) інгібітори термінації: анізоміцин, хлорамфенікол, еритроміцин, лінкоцин, стрептоміцин.
Вплив деяких найбільш поширених антибіотиків на процес трансляції поданий в таблиці 21.2:
Антибіотики, що є інгібіторами процесів трансляції у прокаріотів, застосовуються як антибактеріальні лікарські засоби в терапії інфекційних хвороб та інших захворювань, що спричинені мікробним фактором.
Антибіотики, які інгібірують трансляцію в еукаріотичних клітинах вищих організмів, зокрема ссавців, застосовуються як протипухлинні засоби. Гальмуючи біосинтез білка в клітинах злоякісних пухлин, ці антибіотики спричиняють регресію росту пухлини.
2. Шляхом впливу на процес ініціації трансляції в еукаріотичних клітинах реалізуються захисні ефекти інтерферонів — білків, що синтезуються в організмі людини і тварин (в лімфоїдній та інших тканинах) і мають властивості противірусних антибіотиків та природних протипухлинних факторів.
Механізм антивірусної дії інтерферонів здійснюється за рахунок фосфорилювання клітинних факторів ініціації eIF-2, що, як зазначено вище, можуть бути в дефосфорильованій (активній) та фосфорильованій (неактивній) формах.
Таблиця 21.2. Властивості антибіотиків — інгібіторів трансляції
Антибіотик |
Чутливі організми |
Механізми дії |
Стрептоміцин |
Прокаріоти |
Інгібірує ініціацію за рахунок протидії зв'язуванню з рибосомою форміл-метіоніл-тРНК; крім того, спричиняє правильне зчитування кодонів мРНК |
Тетрацикліни |
Прокаріоти |
Зв'язуються з 30s-субодиницею та гальмують зв'язування з нею різних аміноацил-тРНК |
Хлорамфенікол |
Прокаріоти |
Інгібірує пептидилтрансферазну активність 50s-субодиниці рибосоми |
Циклогексимід |
Еукаріоти |
Інгібірує пептидилтрансферазну активність 60s-субодиниці рибосоми |
Еритроміцин |
Прокаріоти |
Зв'язується з 50s-субодиницею та блокує процес транслокації |
Пуроміцин |
Прокаріоти, еукаріоти |
Спричиняє передчасну термінацію незрілого пептидного ланцюга за рахунок структурної подібності до аміноацил-тРНК |
Синтез інтерферонів стимулюється вірусами, що проникають у клітини організму людини. В свою чергу, інтерферони індукують синтез протеїнкіназ, які фосфорилюють фактори ініціації трансляції eIF-2, що, за розглянутою вище схемою, гальмує біосинтез як вірусних білків, так і всіх білків клітини, в яку потрапив вірус. У результаті зазначеного спричиняється загибель клітини макроорганізму, і тим самим запобігається розмноження часточок віріонів.
Крім антивірусної дії, деякі інтерферони гальмують розмноження клітин злоякісних пухлин, у зв’язку з чим ці сполуки розглядаються як перспективні анти- пухлинні засоби.
3. Потужним інгібітором трансляції в еукаріотів є дифтерійний токсин, що виробляється клітинами Corinebacterium diphteriae і спричиняє небезпечну хворобу дітей та дорослих, яка до введення специфічної імунізації призводила до високої смертності хворих.
Токсин — це білок з молекулярною масою 61 кД, який після проникнення в організм людини розщеплюється протеолітичним шляхом на два поліпептидні ланцюги: активний А-фрагмент (м.м. 21 кД) та неактивний В-фрагмент (м.м. 40 кД).
Молекулярний механізм токсичної дії дифтерійного токсину полягає в каталітичній активності А-фрагменту, який є ферментом АДФ-рибозилтрансферазою, що переносить АДФ-рибозу з молекули НАД на фактор елонгації eEF-2:
![]()
Залишок АДФ-рибози сполучається з амінокислотним залишком дифталамідом в молекулі фактора елонгації eEF-2, що призводить до втрати останнім його властивості здійснювати процес транслокації пептидного залишку з А- на П-сайт рибосоми (див. п. 21.3). Таким чином, процес елонгації трансляції в клітині блокується, що призводить до загального припинення білкового синтезу.
А-фрагмент дифтерійного токсину є біологічним токсином з надзвичайно високою летальною дією: однієї молекули цього пептиду достатньо для загибелі цілої клітини- мішені, в яку він потрапив.