Практическая химия белка - А. Дарбре 1989
Определение состава белковых олигомеров. Получение мономеров и полипептидных цепей
Стехиометрическое соотношение мономеров в олигомере
Диссоциация и сборка
Третичная и четвертичная структуры олигомеров нарушаются в присутствии мочевины, гуанидингидрохлорида и ДНС (разд. 1.3) и в результате химической модификации (разд. 1.4.3).
Идентифицируя продукты диссоциации, можно определить соотношение мономеров в олигомере. Существенное значение может иметь pH среды. Например, агглютинин проростков пшеницы и его сукцинилпроизводное при рН>5 — димеры, но диссоциируют при рН<5 [122]. Зависимость четвертичной структуры от pH определяет условия сборки и реконструкции белка. Гемоцианин, агрегат из 8 гексамеров, диссоциирует на мономеры и димеры при pH 8,9 (в присутствии ЭДТА для связывания Са2+). Напротив, при изменении ионной силы, pH и концентрации Са2+ гемоцианин диссоциирует с образованием комплексов гексамера промежуточного размера [20].
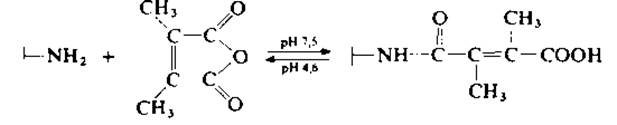
Дополнительные возможности метода, основанного на химической модификации, рассмотрены в работе [184] на примере мультиферментного комплекса дрожжевой синтетазы жирных кислот. При этом вместо янтарного ангидрида, который необратимо ацилирует остатки лизина, предложено использовать ангидриды других дикарбоновых кислот, цитраконовый или лучше диметилмалеиновый ангидрид. В отличие от цитракониламидов диметилмалеилмоноамиды могут легко гидролизоваться в мягких условиях. После ацилирования диметилмалеиновым ангидридом а- и ß-полипептидные цепи диссоциируют при повышении pH или снижении ионной силы. Реакция ацилирования обратима в слабокислой среде (pH 4,6), что допускает последующую сборку олигомера. Именно потому, что нативная конформация мономерных ферментов относительно легко реконструируется (разд. 1.5.1.3), по-видимому, как термодинамически наиболее выгодная, можно показать, что олигомерные ферменты сохраняют специфичность in vitro после обратимой денатурации и последующей реконструкции [39].
Для отдельных олигомеров существенное значение могут иметь параметры среды, например величина pH. После диссоциации фумаразы в мочевине [186] и диализа против воды не происходит сборки активного тетрамера, однако реконструкция удается при диализе против буфера в отсутствие мочевины (разд. 1.4.4.1). Первоначально образующийся продукт обладает частичной активностью и является в основном димером, хотя данные флуоресценции и кругового дихроизма совпадают с соответствующими параметрами нативного тетрамера.
1.4.4.1. Методики. Ниже приводятся методики диссоциации и реконструкции конкретных ферментов с использованием денатурирующих агентов (пример 1) и химической модификации (пример 2).
Пример 1 [186J. Фумаразу из сердца свиньи (0,5—5 мкг/мл) инактивируют при 25 °С в течение 30 мин в присутствии 6 М мочевины (или гуанидин-HCl) в растворе следующего состава: 50 мМ фосфатный буфер (pH 7,3)+6 М мочевина (или гуанидин-НСl) + 10 мМ дитиотреит+0,1 мМ ЭДТА+10%-ный глицерин+200 мМ КСl.
Затем раствор диализуют против исходного буфера, но не содержащего мочевину, при 4 °С в течение 24 ч, а затем инкубируют при 25 °С в течение 3 ч.
Пример 2 [184]. К раствору синтетазы жирных кислот (5—6 мг/мл) в 0,3 М калийфосфатном буфере (pH 7,5), содержащем 10 мМ 2-меркаптоэтанол, прибавляют 13 мкл свежеприготовленного 0,8 М раствора диметилмалеинового ангидрида в сухом тетрагидрофуране. Смесь инкубируют при 0 °С в течение 30 мин, а затем диализуют против 100 мМ трис-HCl буфера (pH 8,0), содержащего 1 мМ дитиотреит. Для обессоливания используют гель-фильтрацию на сефадексе G=50.
Реактивация фермента. Прежде всего с помощью гидролиза в мягких условиях снимают ацильные группы модифицированных аминокислот. Раствор белка разбавляют вдвое 0,2 М трис-ацетатным буфером (pH 8,1). При содержании белка <1 мг/мл в раствор добавляют бычий сывороточный альбумин до суммарной концентрации белка 1 мг/мл. Раствор осторожно титруют при комнатной температуре насыщенным (при 23 °С, 100%-ное насыщение) сульфатом аммония, подкисленным до pH 2 концентрированной серной кислотой. Белок начинает выпадать в осадок при pH ~6,5. Суспензию выдерживают при pH 4,6 и комнатной температуре в течение 30—60 мин, а затем центрифугируют при 28 000 g и 4 °С в течение 30 мин. Осадок ресуспендируют в охлажденном до 4 °С буфере следующего состава: 100 мМ калийфосфат (pH 8,5)+10 мМ дитиотреит+0,5 мМ калий ЭДТА+10 мкМ флавинмононуклеотид. Небольшая примесь бычьего сывороточного альбумина (0,1 мг/мл) способствует растворению осадка. Сульфат аммония удаляют с помощью гель-фильтрации на сефадексе G-50 в указанном буфере. Обессоленный образец (1—2 мг/мл) инкубируют в буфере для реактивации при 25 °С.