Биохимия и молекулярная биология - Белясова Н.А. 2002
Структура и функции клеточных компонентов
Белки. Особенности организации и функции ферментов
Специфичность ферментов
Одним из удивительных свойств ферментов является их высокая специфичность. Различают субстратную специфичность (способность связываться с определенным субстратом или их группой) и специфичность действия, или реакционную специфичность (способность катализировать реакции определенного типа).
Специфичность связывания субстрата у разных ферментов значительно варьирует — некоторые ферменты могут катализировать реакцию с участием только одного субстрата, тогда как другие — с несколькими химически родственными веществами. Например, формамидаза гидролизует только формамид, в то время как амидаза гидролизует любой алифатический амид. В таком случае говорят соответственно об узкой и широкой специфичности ферментов.
Ранее было принято объяснять субстратную специфичность ферментов теорией замка и ключа: к ферменту (замку) подходит лишь свой субстрат (ключ). Однако в настоящее время эта теория получила развитие в гипотезе Кошланда об индуцированном соответствии субстрата и фермента, которая считается общепринятой. Согласно этой гипотезе, пространственное соответствие между структурами активного центра фермента и субстрата создается в момент их взаимодействия друг с другом. При этом в молекуле фермента индуцируются небольшие конформационные изменения, в результате чего в каталитическом участке функционально активные группы ориентируются наиболее благоприятным для протекания соответствующей реакции образом. В субстрате также возникают конформационные превращения (говорят о возникновении напряжения в субстрате), что делает его более реакционноспособным. Данная гипотеза объясняет тот факт, что молекулы, очень похожие по форме на истинный субстрат, могут связываться с ферментом, но не превращаются в продукт, т. е. действуют как ингибиторы.
Субстратная специфичность ферментов настолько выражена, что большинство из них способно распознавать положение заместителей у аномерного атома углерода, связывая и катализируя превращения лишь одной из групп аномеров. Например, почечная оксидаза D-аминокислот катализирует окисление целого ряда D-аминокислот, но не действует на L-аминокислоты. Однако это правило не абсолютно, и существуют ферменты, катализирующие превращения обоих энантиомеров. Так, субстратами глутаминсинтетазы из мозга овцы служит как D-, так и L-глутаминовая кислота.
Специфичность действия ферментов также проявляется в высокой степени и характеризует способность ферментов катализировать одну-единственную химическую реакцию или несколько реакций одного типа. Часто превращения субстрата могут идти по нескольким путям, и в ходе некатализируемой реакции либо при участии неорганического катализатора превращения органического вещества сопровождаются образованием множества побочных продуктов. Этого не происходит при ферментативном катализе, и продукт ферментативной реакции не содержит примесей.
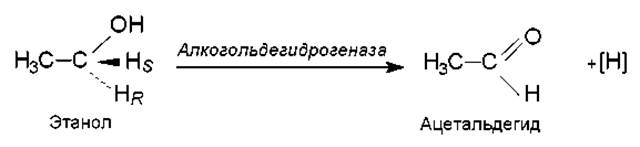
Более того, некоторые ферменты обладают стереохимической специфичностью, т. е. способны различать в субстрате правую и левую стороны, а также распознавать пространственное положение атомов. Например, ферменты, расщепляющие а- и ß-метилглюкозиды, узнают эти пространственные изомеры и характеризуются специфичностью по отношению к ним. Алкогольдегидрогеназа, катализирующая окисление этанола, распознает и отщепляет один из пары атомов в СН2-группе этанола, а именно тот, который находится в положении про-R относительно прохирального центра: