Биохимия и молекулярная биология - Белясова Н.А. 2002
Структура и функции клеточных компонентов
Белки. Особенности организации и функции ферментов
Механизм ферментативного катализа
Последовательность событий в ферментативном катализе можно описать следующей схемой. Вначале формируется субстрат-ферментный комплекс. При этом происходит изменение конформаций ферментной молекулы и молекулы субстрата, последняя фиксируется в активном центре в напряженной конфигурации. Так формируется активированный комплекс, или переходное состояние, — высокоэнергетическая промежуточная структура, которая энергетически менее устойчива, чем исходные соединения и продукты. Важнейший вклад в суммарный каталитический эффект вносит процесс стабилизации переходного состояния —взаимодействия между аминокислотными остатками белка и субстратом, находящимся в напряженной конфигурации. Разность значений свободной энергии для исходных реагентов и переходного состояния соответствует свободной энергии активации (∆G#). Скорость реакции зависит от величины ∆G#: чем она меньше, тем больше скорость реакции, и наоборот. По сути ∆G# представляет собой «энергетический барьер», который требуется преодолеть для осуществления реакции. Стабилизация переходного состояния понижает этот «барьер» или энергию активации. На следующем этапе происходит сама химическая реакция, после чего образовавшиеся продукты освобождаются из фермент-продуктного комплекса.
Можно выделить несколько причин высокой каталитической активности ферментов, которые обеспечивают снижение энергетического барьера реакции.
1. Фермент может связывать молекулы реагирующих субстратов таким образом, что их реакционноспособные группы будут располагаться поблизости друг от друга и от каталитических групп фермента (эффект сближения).
2. При образовании субстрат-ферментного комплекса достигаются фиксация субстрата и его оптимальная для разрыва и образования химических связей ориентация (эффект ориентации).
3. Связывание субстрата приводит к удалению его гидратной оболочки (существует на растворенных в воде веществах).
4. Эффект индуцированного соответствия субстрата и фермента.
5. Стабилизация переходного состояния.
6. Определенные группы в молекуле фермента могут обеспечивать кислотно-основный катализ (перенос протонов в субстрате) и нуклеофильный катализ (формирование ковалентных связей с субстратом, что приводит к образованию более реакционноспособных структур, чем субстрат).
Одним из примеров кислотно-основного катализа является гидролиз гликозидных связей в молекуле муреина с помощью лизоцима. Лизоцим представляет собой фермент, присутствующий в клетках различных животных и растений: в слезной жидкости, слюне, курином белке, молоке. Лизоцим из куриных яиц имеет молекулярную массу 14 600 Да, состоит из одной полипептидной цепи (129 аминокислотных остатков) и имеет 4 дисульфидных мостика, что обеспечивает высокую стабильность фермента. Рентгеноструктурный анализ молекулы лизоцима показал, что она состоит из двух доменов, образующих «щель», в которой находится активный центр. Вдоль этой «щели» связывается гексосахарид, причем для связывания каждого из шести сахарных колец муреина на ферменте имеется свой участок (А, В, С, D, E и F) (рис. 6.4).
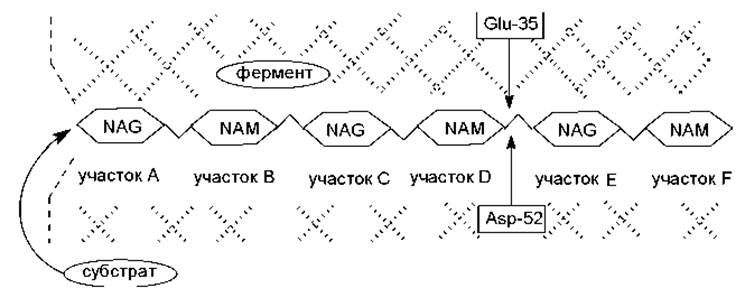
Рис. 6.4. Расположение гексосахаридного звена муреина в активном центре молекулы лизоцима: NAG — остаток N-ацетилглюкозамина; NAM — остаток N-ацетилмурамовой кислоты; заштрихованная часть рисунка — область активного центра лизоцима
Молекула муреина удерживается в активном центре лизоцима в основном благодаря водородным связям и гидрофобным взаимодействиям. В непосредственной близости к месту гидролиза гликозидной связи расположены 2 аминокислотных остатка активного центра: глутаминовая кислота, занимающая 35-е положение в полипептиде, и аспарагиновая кислота — 52-е положение в полипептиде (рис. 6.5).
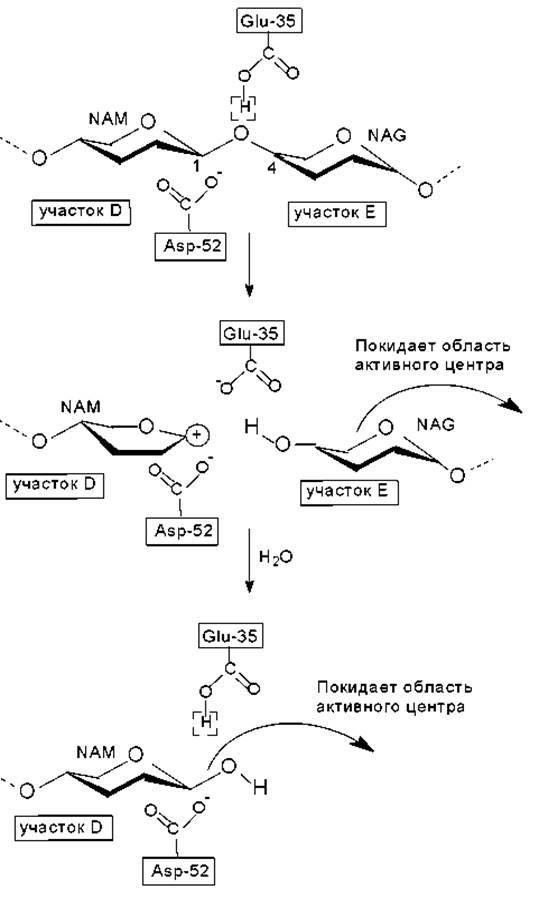
Рис. 6.5. Механизм гидролиза гликозидной связи в молекуле муреина с участием фермента лизоцима
Боковые цепи этих остатков располагаются на противоположных поверхностях «щели» в непосредственной близости к атакуемой гликозидной связи — примерно на расстоянии 0,3 нм. Остаток глутамата находится в неполярном окружении и не ионизирован, а остаток аспартата — в полярном окружении, его карбоксильная группа депротонирована и участвует в качестве акцептора водорода в сложной сети водородных связей.
Процесс гидролиза осуществляется следующим образом. Протонированная карбоксильная группа остатка Glu-35 предоставляет свой протон гликозидному атому кислорода, что приводит к разрыву связи между этим атомом кислорода и С1-атомом сахарного кольца, располагающегося в участке D (стадия общего кислотного катализа). В результате образуется продукт, включающий в себя сахарные кольца, находившиеся в
участках E и F, который может высвободиться из комплекса с ферментом. Конформация сахарного кольца, расположенного в участке D, искажается, принимая конформацию полукресла, в которой пять из шести атомов, образующих сахарное кольцо, лежат практически в одной плоскости. Эта структура соответствует конформации переходного состояния. При этом С1 -атом оказывается положительно заряженным и промежуточный продукт носит название карбоний-иона (карбкатиона). Свободная энергия переходного состояния уменьшается за счет стабилизации карбоний-иона депротонированной карбоксильной группой остатка Asp-52 (рис. 6.5).
На следующем этапе в реакцию вступает молекула воды, которая замещает диффундирующий из области активного центра дисахаридный остаток. Протон молекулы воды переходит к Glu-35, а гидроксильный ион (ОН-) к атому С1 карбоний-иона (стадия общего основного катализа). В результате второй фрагмент расщепленного полисахарида становится продуктом реакции (конформация кресла) и уходит из области активного центра, а фермент возвращается в исходное состояние и готов осуществить следующую реакцию расщепления дисахарида (рис. 6.5).