Биохимия и молекулярная биология - Белясова Н.А. 2002
Структура и функции клеточных компонентов
Кофакторы
Переносчики фосфатных групп. Преобразование энергии в клетке
Кофакторы — переносчики фосфатных групп являются обязательными компонентами не менее 225 ферментов. Подавляющее большинство этих ферментов специфично к аденозиндифосфату (ADP), и их называют киназами. Типичную киназную реакцию можно представить схематически:
x-Pi + ADP → x + ATP, (7.1)
где x-Pi — фосфорилированный субстрат, выполняющий роль донора неорганического фосфата (Pi); ADP — акцептор фосфатной группы; х — дефосфорилированный донор; АТР — аденозинтрифосфат.
После этой реакции может осуществиться другая киназная (уравнение 7.2) либо синтетазная (уравнение 7.3) реакция:
y + ATP → y-Pi + ADP (7.2)
y + z + ATP → y-z + ADP + Pi (7.3)
Нетрудно заметить, что в реакциях типа 7.2 и 7.3 высвобождается ADP, который снова может принимать участие в реакции типа 7.1, что и дает основание отнести аденозиндифосфат к кофакторам.
В реакции типа 7.1 формируется АТР — богатое энергией вещество, основной поставщик энергии в клеточных процессах. В реакции типа 7.2 АТР выполняет роль донора фосфатной группы, а в реакции типа 7.3 —донора энергии для взаимодействия вещества «y» с веществом «z». Но по сути АТР служит сопрягающим агентом, позволяющим осуществиться реакциям 7.2 и 7.3 за счет распада вещества x-Pi (реакция 7.1).
Особенности структуры молекулы АТР. Аденозинтрифосфат имеет своеобразное строение (рис. 7.6): при значениях рН, близких к 7, трифосфатный компонент несет около четырех отрицательных зарядов, которые находятся в непосредственной близости друг к другу и сильно взаимоотталкиваются. Электростатическое отталкивание между заряженными группами ослабляется при гидролизе АТР. Кроме того, АТР характеризуется меньшей резонансной стабилизацией, чем продукт его гидролиза — ADP и Pi. Таким образом, АТР является термодинамически неустойчивой молекулой и гидролизуется с образованием ADP или АМР. При этом расщепляются макроэргические связи (обозначаются знаком ~) и выделяется большое количество энергии.
При гидролизе макроэргических связей АТР при рН 7 в стандартных условиях изменение свободной энергии составляет от -30 до -35 кДж/моль, независимо от того, какая из ангидридных связей АТР при этом расщепляется. Эта энергия может быть расходована для запуска реакций, требующих притока энергии, или для активации молекул (некоторые вещества способны подвергаться превращениям только в активированном виде). При этом термодинамически невыгодная реакция может быть превращена в термодинамически выгодную путем сопряжения с гидролизом АТР.
Действующей формой АТР является комплекс с ионом Mg2+, кординационно связанным с а- и ß-фосфатом.
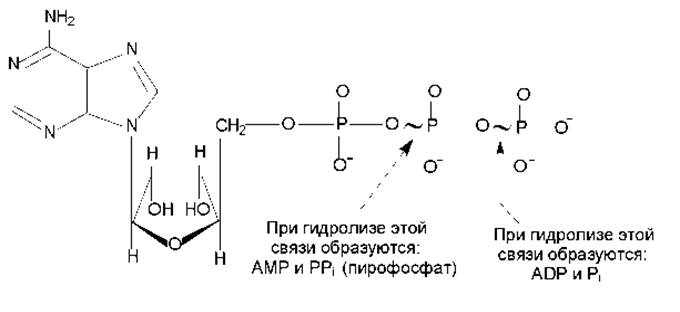
Рис. 7.6. Структура молекулы АТР
Строго говоря, АТР является непосредственно используемым донором свободной энергии, а не формой ее запасания: обычно молекула АТР расходуется в течение 1 мин после образования. Известно, что человек в покое расходует до 40 кг АТР за 24 ч, а во время интенсивной работы скорость использования АТР может достигать 0,5 кг/мин. Такие жизненно важные процессы, как движение, активный транспорт веществ через мембраны, биосинтез, поддержание температуры организма, осморегуляция, генерация и проведение нервных импульсов, свечение, мышечные сокращения, требуют непрерывной регенерации АТР. Как же образуется АТР?
Образование АТР. Аденозинтрифосфат — «основная энергетическая валюта клетки» — может образовываться в ходе нескольких процессов, сопровождающихся следующими механизмами.
1. Окислительное фосфорилирование, которое осуществляется в процессе дыхания (аэробного либо анаэробного) и требует обязательного участия мембран. Движущей силой синтеза АТР служит энергия протонного градиента на мембране.
2. Фотофосфорилирование — механизм трансформирования световой энергии в энергию макроэргических связей АТР, реализующийся при фотосинтезе. Также требует участия биомембран, поскольку и в этом случае движущей силой синтеза АТР выступает энергия протонного градиента на мембране.
3. Субстратное фосфорилирование. Здесь АТР синтезируется при расщеплении макроэргических связей некоторых метаболитов. Процесс не требует участия мембран и реализуется в катаболитных путях и в ходе некоторых типов брожения.
Во всех перечисленных процессах АТР образуется из ADP и неорганического фосфата. В свою очередь, АDP может образовываться из АТР и АМР, чему способствуют взаимопревращения, катализируемые ферментом аденилаткиназой согласно следующему уравнению реакции:
АТР + АМР ↔ АDP + АDP (7.4)
Важно отметить, что по потенциалу переноса фосфатной группы АТР занимает промежуточное положение в ряду биологически важных фосфорилированных молекул, выполняя функцию и доноров, и акцепторов энергии в обмене веществ. Это означает, что должны существовать соединения, характеризующиеся более высоким потенциалом переноса неорганического фосфата, чем АТР. Данные соединения (ацетилфосфат, креатинфосфат, фосфоенолпируват, 1,3-дифисфоглицерат, карбамоилфосфат и некоторые другие) также содержат макроэргические связи и называются макроэргическими соединениями.
Основным признаком макроэргической связи является то, что при ее расщеплении или новообразовании изменение уровня свободной энергии составляет гораздо большую величину (в среднем 25—50 кДж/моль), чем при преобразовании нормальной связи (порядка 12,5 кДж/моль). Макроэргические связи представлены в основном сложноэфирными связями, в том числе тиоэфирными, ангидридными (как в молекуле АТР) и фосфоамидными. Практически все известные макроэргические соединения содержат по месту локализации данных связей атомы серы и фосфора. Аденозиндифосфат, как кофактор киназ, представляет собой подвижный переносчик фосфатной группы и может быть отнесен к коферментам.
Некоторые ферменты используют в качестве переносчиков фосфатных групп другие нуклеозиддифосфаты — GDP, UDP или CDP, однако такие реакции встречаются нечасто.