Биохимия и молекулярная биология - Белясова Н.А. 2002
Структура и функции клеточных компонентов
Кофакторы
Переносчики карбоксильных групп
Реакции карбоксилирования — декарбоксилирования и транскарбоксилирования осуществляются с участием ферментов, многие из которых нуждаются в посредстве биотина. Биотин (витамин Н) служит простетической группой ферментов и связывается с их белковой частью ковалентно через ε-аминогруппу лизина (рис. 7.7). Гетероциклическая часть молекулы биотина состоит из имидазольного (И) и тиофенового (Т) циклов, а боковая цепь представлена остатком валериановой кислоты. Активной формой биотина-кофактора служит N5-карбоксибиотин («активный карбоксил»).
Биотинсодержащие ферменты принимают участие в процессах фиксации углекислоты, биосинтеза липидов, аминокислот, углеводов, нуклеиновых кислот и других веществ. При этом роль биотина состоит в осуществлении сопряжения расщепления АТР с карбоксилированием: на первой стадии происходит присоединение бикарбоната (НСО3-) или СО2 к биотину с образованием карбоксибиотина, для чего и необходим гидролиз АТР. На второй стадии карбоксибиотин передает карбоксильную группу субстрату, выполняя роль своеобразной «подвижной руки» в составе ферментного комплекса.
Известен только один биотинсодержащий фермент, который для катализа не требует участия АТР — карбокситрансфераза пропионовокислых бактерий. Но и в этом случае роль переносчика карбоксильной группы играет биотин.
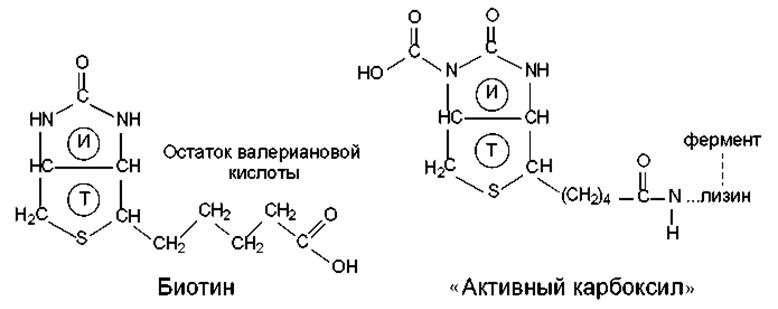
Рис. 7.7. Структура биотина и «активного карбоксила»
7.3. Переносчики ацильных групп
Незаменимым кофактором переноса ацильных остатков в клетках является коэнзим А (СоА), который еще называют коферментом А. Это соединение служит коферментом не менее 80 известных ацилпереносящих ферментов, принимающих участие в цикле трикарбоновых кислот, ß-окислении жирных кислот, брожении некоторых типов, обмене углеводов и во множестве других жизненно важных процессов.
В составе молекулы коэнзима А присутствует витамин В3 (пантотеновая кислота) (рис. 7.8), составными частями которого являются пантоевая кислота и ß-аланин. Реакционноспособной группой коэнзима А служит сульфгидрильная (SH-) группа, расположенная на конце длинной, относительно гибкой цепи. По этой группе с помощью тиоэфирной связи и осуществляется присоединение ацильных остатков. Образующиеся в результате производные носят название ацил-СоА.
Простейшим ацильным производным является ацетил-СоА (рис. 7.8). Это соединение характеризуется высоким потенциалом переноса ацетильной группы, что подтверждается большой отрицательной величиной изменения свободной энергии (∆Go) для реакции гидролиза ацетил-СоА:
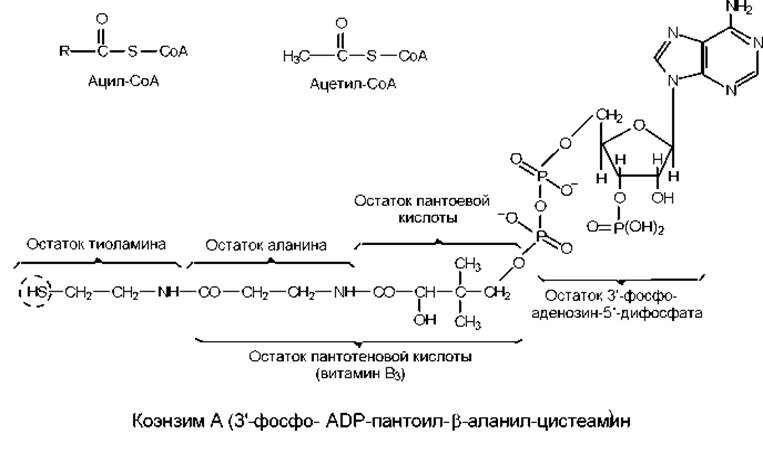
Рис. 7.8. Структура коэнзима А и его производных. В пунктирном контуре заключена активная сульфгидрильная группа
Ацетил-СоА + Н2О ↔ Ацетат + СоА + Н+ ∆G° = -31,4 кДж/моль
Коэнзим А является подвижным кофактором и в процессе переноса ацильных остатков взаимодействует с разными ферментами. Кроме него, в клетках присутствует другой распространенный кофактор, переносящий ацильные остатки — фосфопантетеин (рис. 7.9). Фосфопантетеин ковалентно (через остаток серина) связан с ацилпереносящим белком, принимающим участие в биосинтезе жирных кислот. Таким образом, данный кофактор является простетической группой белков. Его функции аналогичны функциям СоА.
Связанный фосфопантетеин обнаружен также в цитрат-расщепляющем ферменте и в ферментах, участвующих в синтезе пептидных антибиотиков.
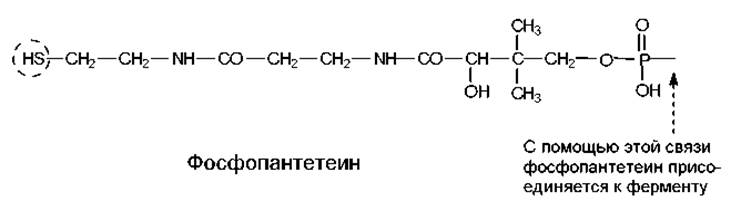
Рис. 7.9. Структура фосфопантетеина