Биохимия и молекулярная биология - Белясова Н.А. 2002
Метаболизм. Процессы, приводящие к запасанию энергии
Дыхание
Механизм окислительного фосфорилирования
Вся система переносчиков в дыхательной цепи внутренней мембраны митохондрий включает примерно 70 различных полипептидов, организованных в 4 ферментных комплекса: NADH—CoQ-редуктаза (комплекс I), CoQH2 — цитохром с-редуктаза (комплекс III), цитохромоксидаза (комплекс IY) и сукцинат — СоQ-редуктаза (комплекс II). Дыхательная цепь тесно примыкает к АТР-синтазному комплексу, в котором осуществляется фосфорилирование ADP. Для ответа на вопрос о том, каким образом транспорт электронов по компонентам дыхательной цепи сопряжен с синтезом АТР, предложено несколько гипотез:
1) гипотеза химического сопряжения (Е. Слейтер, 1953 г.): перенос электронов вызывает серию химических реакций, в ходе которых образуется некий высокоэнергетический продукт. Расщепление этого продукта сопровождается высвобождением энергии, достаточной для синтеза молекулы АТР;
2) гипотеза конформационного сопряжения (П. Бойер, 1964 г.): транспорт электронов вызывает конформационные изменения в белковых компонентах в мембране, что связано с переходом их в высокоэнергетическую форму. Эти изменения передаются АТР-синтазе, которая активируется и катализирует синтез АТР;
3) хемиосмотическая гипотеза (предложена Питером Митчеллом в 1961 г.): перенос электронов сопровождается выводом протонов в межмембранное пространство митохондрий. Так на внутренней мембране создается электрохимический градиент, который и запускает работу АТР-синтазы. Иными словами, синтез АТР осуществляется за счет осмотической энергии протонного градиента.
Из всех рассмотренных гипотез наиболее состоятельной и подтвержденной многими экспериментальными данными является гипотеза Митчелла. Она, в частности, объясняет необходимость целостности мембраны для синтеза АТР. Однако и ее положения носят пока статус теории и далеки от совершенства, хотя признаны большинством исследователей и будут рассмотрены ниже.
Каждый из комплексов дыхательной цепи включает по несколько редокс-центров, расположенных в мембране особым образом, формируя несколько «петель». В каждой такой «петле» 2 атома водорода выносятся к наружной поверхности внутренней мембраны митохондрий, где отдают 2 протона в межмембранное пространство, а пара электронов транспортируется затем на внутреннюю поверхность мембраны. На рис. 12.2 представлена упрощенная схема функционирования переносчиков дыхательной цепи (комплексы I, III, IY), работа которых описана ниже.
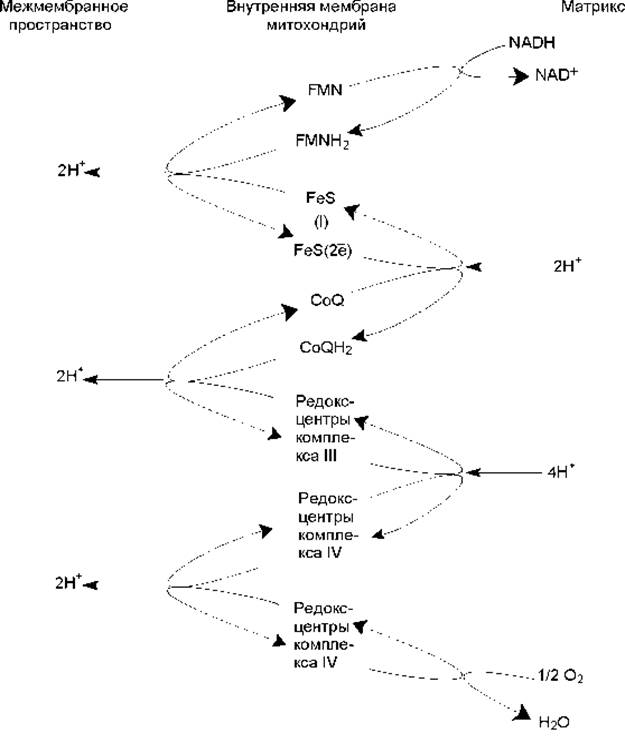
Рис. 12.2. Упрощенная схема транспорта электронов по компонентам дыхательной цепи во внутренней мембране митохондрий Комплекс I включает 25—30 субъединиц, FMN, 6—7 железосерных центров и носит название NADH-дегидрогеназа или NADH—CoQ-редуктаза.
Этот комплекс окисляет NADH и восстанавливает хиноны (CoQ). Гидрид-ион от NADH и протон из матрикса митохондрии передаются на FMN, который восстанавливается до FMNH2. FMNH2 осуществляет перенос двух атомов водорода от внутренней поверхности мембраны к внешней. При этом два протона выводятся в межмембранное пространство, а два электрона акцептируются железосерными белками и по их редокс-центрам электроны мигрируют к внутренней поверхности мембраны, где переносятся на хиноны. Но для восстановления хинонов требуются атомы водорода, а не электроны, поэтому дополнительно 2 протона акцептируются из матрикса (рис. 12.2).
Далее вступает в действие комплекс III (CoQH2—цитохром с-редуктаза), содержащий 11 субъединиц, 2 железосерных центра, 2 гема цитохрома b и гем цитохрома с1. Работа этого комплекса приводит к окислению CoQH2 и восстановлению цитохрома с. Перенос электронов осуществляется в следующей последовательности:
CoQH2 → гем b → FeS (III) → гем с1 → гем с
Процесс окисления CoQH2 также сопровождается выводом протонов в межмембранное пространство (рис. 12.2).
Цитохром с окисляется комплексом IV (цитохромоксидаза), включающим 13 субъединиц, 2 атома меди, 2 гема а и 2 гема а3. Этот комплекс восстанавливает молекулярный кислород до воды. Электрон, отнятый от гема с, переносится на редокс-центр CuA цитохромоксидазы, который расположен ближе всего к той поверхности фермента, которая обращена в межмембранное пространство. Перемещаясь далее вглубь мембраны, электрон переносится на гем а, а затем на комплекс гем а3 — CuB, который и восстанавливает молекулярный кислород. При этом следует признать, что хотя цитохромы являются переносчиками электронов, цитохромоксидаза имеет протон-проводящие каналы и, как полагают, может действовать как истинный протонный насос. На один транспортируемый электрон переносится 2 протона, один из которых участвует в восстановлении О2, а второй пересекает мембрану. Таким образом, на 2 транспортируемых по компонентам дыхательной цепи электрона через канал цитохромоксидазы должно быть перенесено 4 протона (рис. 12.2).
Комплекс II (сукцинатдегидрогеназа или сукцинат-CoQ-редуктаза) переносит водород от сукцината, окисляемого в ЦТК, на хиноны без участия NAD+. В этом случае реализуется на одну «петлю» меньше и в межмембранное пространство митохондрий выводится меньшее количество протонов.
Таким образом, на внутренней мембране митохондрий создается градиент электрохимического потенциала Н+, который и является движущей силой синтеза АТР.
Вопрос о том, каким образом энергия протонного градиента сопрягается с синтезом АТР, пока остается открытым. Известно, что в интактных митохондриях только АТР-синтаза позволяет осуществить обратное (по электрохимическому градиенту) перемещение протонов в матрикс. Этот подчиняющийся закономерностям облегченной диффузии поток протонов осуществляется через канал АТР-синтазы и каким-то образом сопряжен с фосфорилированием ADP.
АТР-синтаза (называется также АТР-аза, поскольку в определенных условиях способна катализировать обратную реакцию: гидролиз АТР и создание протонного градиента на мембране) состоит из двух частей: пронизывающего мембрану протонного канала (F0) и «головки» (F1), выступающей в матрикс в форме грибовидного выроста. Обе части АТР-синтазы состоят, в свою очередь, из нескольких субъединиц и организованы в мембране особым образом (рис. 12.3). Протонный канал и «ствол» головки примыкают друг к другу, а каталитические центры фермента располагаются между тремя а- и тремя ß-субъединицами.
Синтез АТР осуществляется в три фазы в трех каталитических центрах. Вначале АТР-синтаза связывает ADP и Р1, затем формируется фосфоангидридная связь между ними (образуется АТР) и, наконец, АТР высвобождается в матрикс.
Предполагается, что энергия транспортируемых через канал F0 протонов расходуется на поворот g-субъединицы, в результате чего изменяется конформация а- и ß-субъединиц и их каталитические центры переходят в активное состояние. Существуют и другие гипотезы, объясняющие механизм синтеза АТР. Согласно одной из них, предложенной П. Митчеллом, фосфатная группа (Р1) связывается в активном центре «головки» фермента в непосредственной близости к протонному каналу. Перенос протонов по каналу F0 под действием градиента рН и мембранного потенциала сопровождается активацией неорганического фосфата, в результате чего от него отщепляется гидроксильная группа (образует с протоном молекулу воды). Оставшаяся часть неорганического фосфата превращается в весьма реакционноспособную частицу, реагирующую с ADP, образуя АТР.
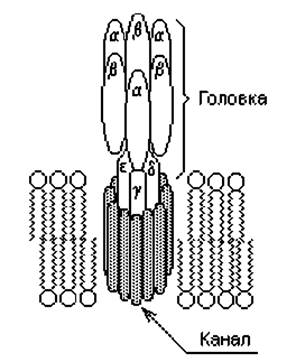
Рис. 12.3. Структура АТР-синтазы
Следует отметить, что протонный градиент на биомембранах может использоваться не только для синтеза АТР, но и для других целей: для транспорта через мембраны нуклеозиддифосфатов и нуклеозидтрифосфатов, для вращения бактериальных жгутиков, для поддержания осмотического давления, для транспорта через мембраны веществ против градиента концентрации, для выработки тепла. Последний механизм имеет очень важное значение для теплокровных животных, а также для некоторых растений, насекомых. У многих животных обнаружена особая ткань, так называемый «бурый жир», содержащая большое количество митохондрий (в мембранах этих митохондрий присутствуют красноватые цитохромы). Особенностью таких специализированных митохондрий является использование свободной энергии протонного градиента не для синтеза АТР, а для обогрева организма: энергия рассеивается в виде тепла.