Биохимия и молекулярная биология - Белясова Н.А. 2002
Основы генетической инженерии
Создание и анализ клонотек геномов
Создание клонотек геномов и идентификация в них генов
В большинстве случаев для изучения структуры и свойств определенного гена какого-либо организма требуется осуществить предварительный этап — создать банк генов данного организма. Банком генов, или библиотекой генома (клонотекой), называют совокупность клонов бактерий или фаговых частиц, в которой содержится, по меньшей мере, по одному экземпляру каждой последовательности генома исследуемого организма. Необходимое количество клонов в клонотеке определяется отношением размера генома и размеров клонируемых фрагментов ДНК. Например, если гаплоидный геном Saccharomyces cerevisiae содержит 1,4-107 п. н., а емкость используемого для клонирования вектора составляет 15-103 п. н., то весь геном этих дрожжей может быть представлен 1,4-107 /15-103 ≈ 1-103 рекомбинантными клонами. Однако реально для создания клонотеки в данном случае требуется 4000— 5000 клонов, среди которых искомый ген или сегмент генома может быть обнаружен с вероятностью 99%. Такая избыточность клонотеки объясняется тем, что лигирование отдельных фрагментов чужеродной ДНК с векторами происходит случайно, и какие-то участки генома могут быть представлены в небольшой выборке несколько раз, а другие — ни одного раза. Полная библиотека генома человека размещается в составе примерно 900 000 клонов.
Наиболее часто используются два типа клонотек: геномные библиотеки и библиотеки кДНК. Геномные библиотеки представляют собой собрание генов и последовательностей ДНК какого-то организма. Их получают обычно с помощью векторов, сконструированных на основе бактериофага 1 или космид. Эти векторы характеризуются большой емкостью, что позволяет уменьшить число клонов в клонотеке.
Библиотека кДНК («комплементарных» ДНК, см. раздел 1) представлена набором клонов, содержащих двухнитевые ДНК-копии всех мРНК клетки. Для создания этих клонотек чаще используют плазмидные или фаговые (на основе фага λ) векторы.
Оба типа клонотек, однако, можно сравнить с хаотическим собранием книг, которые превращаются в библиотеку лишь после составления каталога, позволяющего систематизировать все собрание. Иными словами, следующим необходимым этапом является идентификация генов в клонотеке генома. Решить эту задачу можно несколькими способами: анализируя саму вставочную полинуклеотидную последовательность либо продукты ее экспрессии в клетках-хозяевах. В первом случае стратегия скрининга рекомбинантных клонов основана на использовании зондов, комплементарных определенным участкам генов или кДНК. Во втором случае скрининг основан на изменении фенотипа клеток, воспринявших определенный фрагмент ДНК, под влиянием вновь синтезированного белка либо просто на свойствах самого белка. Рассмотрим некоторые способы идентификации генов в клонотеках.
Идентификация генов по изменению фенотипа клеток. Этот метод чаще используется при «самоклонировании», т. е. при переносе генов на мно- гокопийных плазмидах в тот же микроорганизм, из генома которого были выделены эти гены. Например, требуется обнаружить в клонотеке E. coli клоны, содержащие гены, ответственные за биосинтез аланина. Для этого требуется перенести векторы с клонированными фрагментами ДНК в мутантные штаммы E.coli, зависимые по аланину. Отбор потомства следует вести на синтетической среде без аланина, где способны сформировать колонии лишь те бактерии, которые восприняли комплементирующий соответствующую мутацию ген. Подобная процедура носит название «тест на комплементацию» и требует наличия штаммов с хорошо охарактеризованными мутациями искомых генов.
Иммунологический скрининг продуктов генов. Если фрагменты ДНК клонировались в составе экспрессируемых векторов, обеспечивающих транскрипцию и трансляцию чужеродных генов, то возможен отбор нужных клонов с помощью иммунологических тестов. Для этого колонии бактерий на плотной среде (чашка-реплика) подвергают лизису парами хлороформа, а затем методом реплик переносят содержимое на поливиниловую пластинку, на которой адсорбированы антитела к искомому белку. Промывают пластинку таким образом, чтобы на ней остались только связанные с антителами белки (в мягких условиях). Затем пластинку обрабатывают мечеными изотопами йода (125I) антителами к тому же белку. Таким образом, на пластине формируется комплекс антигена (искомый белок) и двух молекул антител, одна из которых мечена радиоактивным изотопом. Обнаружить местоположение такого комплекса можно радиоавтографически. Сопоставляя положение меченого комплекса и положение колоний на чашке, можно выявить клон, содержащий ответственный за синтез искомого белка ген.
Скрининг клонотеки с помощью зондов. В разделе 1 этой главы описана процедура получения кДНК. Для поиска нужной кДНК в клонотеке поступают следующим образом. Отбирают изолированную колонию, содержащую вектор со вставкой, и инкубируют ее для получения большого количества гомогенной культуры. Выделяют из клеток плазмидную ДНК и подвергают ее денатурации, в результате чего цепи расходятся. Иммобилизуют денатурированную ДНК на нитроцеллюлозном фильтре. Пропускают через фильтр смесь мРНК, выделенных из тех же клеток, чьи гены пытаются обнаружить. При этом на фильтре задерживаются лишь те мРНК, которые комплементарны гомогенной кДНК. Связавшуюся мРНК элюируют с фильтра и вносят в бесклеточную систему трансляции, где синтезируется соответствующий белок. Этот белок можно идентифицировать иммунологическим методом или с помощью хроматографического анализа. Если это удается осуществить, в руках исследователя оказывается идентифицированный клон, клетки которого содержат кДНК, служащую зондом для поиска индивидуального гена или мРНК.
кДНК-зонд можно использовать для быстрого и очень эффективного скрининга любой клонотеки. Схема такого эксперимента представлена на рис. 20.8. Изолированные колонии микроорганизмов или бляшки вирусов на газоне чувствительных клеток переносят методом реплик на нитроцеллюлозный фильтр, помещенный на поверхность плотной среды в чашке Петри. Клетки разрушают (обычно щелочным лизисом с помощью NaOH) и подвергают ДНК денатурации. При определенных условиях (80° С, вакуум) ДНК прочно прикрепляется к нитроцеллюлозному фильтру. Фильтр выдерживают в растворе, содержащем денатурированный 32Р-меченный зонд. В этих условиях комплементарные последовательности ДНК образуют дуплексы. При радиоавтографическом анализе в том месте фильтра, где содержалась комплементарная зонду ДНК, обнаруживается потемнение. Ищут соответствие этой зоны той или иной колонии на чашке-матрице (либо бляшке).
В качестве зондов для скрининга клонотек вместо кДНК можно использовать мРНК или химически синтезированные олигонуклеотидные зонды. В последнем случае требуется информация о последовательности нуклеотидов в гене или последовательности аминокислот в искомом белке. Исходя из аминокислотной последовательности участка полипептида длиной 5—6 аминокислотных остатков, предсказывают все возможные последовательности мРНК, которые могут кодировать этот участок. Вариантов обычно бывает много из-за вырожденности генетического кода. Синтезируют соответствующий набор комплементарных олигонуклеотидов in vitro. Эти нуклеотиды можно затем использовать непосредственно для скрининга смеси кДНК или геномной библиотеки. Кроме этого, данные олигонуклеотиды можно применять вместо олиготимидилатов в качестве затравок для обратной транскриптазы, чтобы синтезировать кДНК, существенно обогащенную искомыми последовательностями. В данном случае процессу обратной транскрипции будут подвергаться преимущественно те мРНК, которые содержат комплементарные затравкам последовательности рибонуклеотидов.
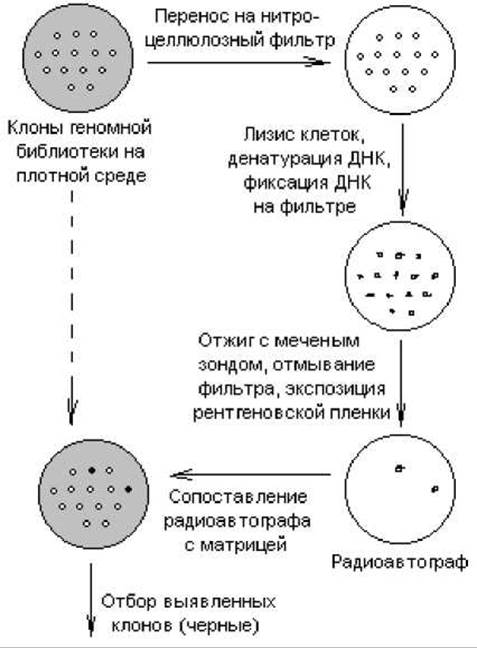
Рис. 20.8. Схема скрининга клонотеки с помощью зондов