Биохимия и молекулярная биология - Белясова Н.А. 2002
Основы генетической инженерии
Практическое использование методов генетической инженерии
Достижения генетической инженерии в конструировании штаммов-продуцентов биологически активных веществ
Если изначально методология генетической инженерии разрабатывалась для исследования основных механизмов экспрессии генов, а также функций их продуктов, то очень скоро выявились разносторонние прикладные аспекты ее достижений. В числе самых первых генноинженерных триумфальных экспериментов было получение штаммов бактерий, продуцирующих человеческие белки (инсулин, гормон роста, интерфероны и др.). Можно сказать, что эти исследования открыли эру широкого использования продуктов генетической инженерии. Поскольку данные эксперименты весьма показательны и дают возможность осознать практическую значимость большей части описанных выше приемов получения и анализа рекомбинантных ДНК, имеет смысл рассмотреть их в данном разделе.
Получение бактерий-продуцентов человеческого инсулина. Инсулин представляет собой гормон, секретируемый клетками поджелудочной железы в кровь и участвующий в углеводном обмене. Процесс синтеза инсулина в клетках осуществляется в ходе нескольких стадий: вначале на рибосомах образуется препроинсулин, который содержит сигнальный пептид, направляющий пептидную цепь внутрь эндоплазматического ретикулума. Там отщепляется сигнальный пептид и замыкаются дисульфидные мостики — формируется проинсулин. Последний поступает в аппарат Гольджи и депонируется в клеточных везикулах, где в ходе отщепления С-пептида (33 аминокислотных остатка) образуется зрелый инсулин. Молекулы зрелого инсулина состоят из А- и В-цепей, соединенных дисульфидными мостиками.
Чистый инсулин необходим в большом количестве для лечения диабета. До недавнего времени гормон приходилось получать дорогостоящим и трудоемким способом из поджелудочной железы животных. Этот инсулин вызывал ответную реакцию — образование антител. В настоящее время инсулин человека получают с помощью сверхсинтеза бактериями, сконструированными методами генетической инженерии. Инсулин стал первым коммерческим генноинженерным продуктом, продуцируемым бактериями, разрешенным к широкому применению в терапии диабета.
Ген инсулина млекопитающих содержит интрон, поэтому для клонирования нельзя было использовать сам ген, так как бактерии не способны к сплайсингу. Оставалось две возможности: использовать кДНК, полученную копированием проинсулиновой мРНК, либо синтезировать кодирующие последовательности химическим путем. На самом деле осуществлены оба эксперимента, при этом клонирование в бактериях проинсулиновой кДНК приводило к образованию предшественника гормона, который не мог превратиться в клетках E. coli в зрелый инсулин, поскольку в них не осуществляется необходимый специфический посттрансляционный процессинг. Для получения инсулина нужна была дополнительная стадия ферментативного расщепления проинсулина in vitro. В другом, более результативном эксперименте нуклеотидные последовательности, кодирующие А- и В-цепи инсулина, синтезировали химически. Для этого вначале определили последовательность аминокислот в А- и В-цепях инсулина и предсказали последовательность нуклеотидов во фрагментах ДНК на основании генетического кода. А-фрагмент содержал 69 пар нуклеотидов: 60 п. н. — кодирующая часть, плюс стартовый (ATG) и терминирующий (TGA) кодоны. Фрагмент В содержал 96 п. н. (рис. 21.3).
Стартовые метиониновые кодоны вводили в состав фрагментов гена инсулина для того, чтобы можно было отделить цепи инсулина от прокариотических аминокислотных последовательностей (N-участок ß-галактозидазы).
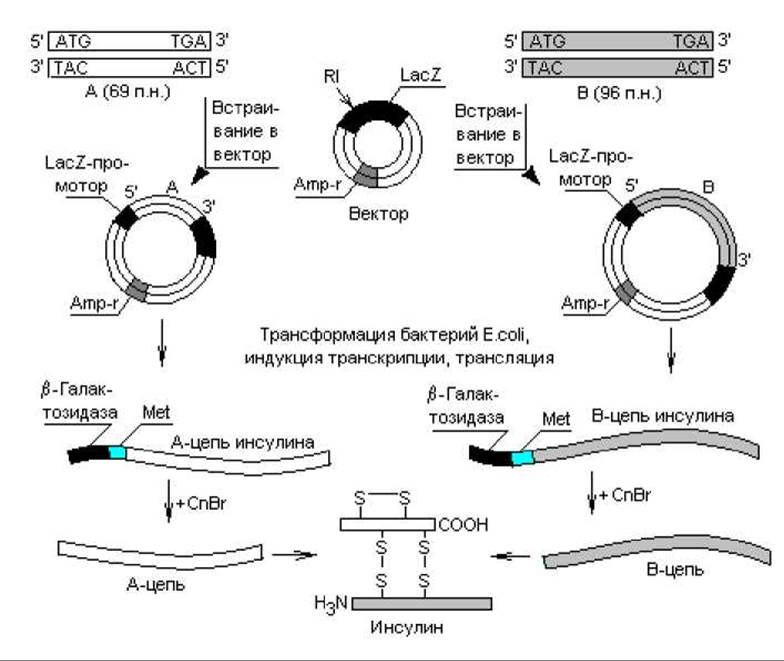
Рис. 21.3. Схема процесса образования человеческого инсулина бактериями E.coli. RI — рестриктаза типа I; CnBr — цианогенбромид
Для экспрессии клонированных генов инсулина в клетках кишечной палочки осуществляли встраивание каждого синтезированного фрагмента в плазмидный вектор под контроль ß-галактозидазного промотора Данный регуляторный элемент выбран неслучайно. Уже упоминалось, что эукариотические белки, накапливаясь в клетках прокариот в больших количествах, тормозят их рост в основном из-за токсичности, а также деградируются протеазами. В таких случаях полезным может оказаться выращивание бактериальных клеток до высокой плотности, после чего их индуцируют к синтезу продукта. Известно (глава 3), что лактозный оперон E.coli регулируется по типу индукции, т. е. инкубирование клеток с рекомбинантными ДНК в отсутствие индуктора позволяет им быстро достичь необходимой плотности популяции (инсулиновые гены не транскрибируются), а когда в культуральную жидкость вносят индуктор (изопропилтиогалактозид), клетки начинают массово синтезировать цепи инсулина.
Итак, компетентные клетки E.coli трансформировали гибридными векторами и отбирали потомство на среде с ампициллином (рис. 21.3). В трансформированных бактериях синтезировались предшественники А- и В-цепей инсулина. С помощью цианогенбромида, разрушающего метионин и с меньшей эффективностью триптофан, от предшественников отщепляли короткий ß- галактозидный участок вместе с одним остатком метионина (эти белки не содержат других остатков метионина и триптофана).
После очистки А и В-цепи смешивали в условиях, способствующих образованию прочных бисульфидных связей, в результате чего получался чистый человеческий инсулин.
Разработка методов генетической инженерии изменила структуру и содержание современной промышленной микробиологии. Во-первых, значительно возросла продуктивность микроорганизмов, используемых для синтеза биологически активных веществ (сайт-специфический мутагенез в области регуляторных элементов генов, амплификация генов, введение в геном новых кодирующих последовательностей и т. п.). Во-вторых, появилась возможность менять питательные потребности продуцентов, придавать им устойчивость к определенным факторам окружающей среды, повышать их конкурентоспособность, скорость роста и др. Наконец, изменилась сама логика промышленной микробиологии: ранее для обнаруженного вновь продуцента какого-либо метаболита создавались методы и средства его биотехнологической эксплуатации, теперь появилась возможность воспользоваться только геном или группой генов нового штамма и перенести их в адаптированный для производства соответствующей категории веществ, хорошо изученный микроорганизм.