Биохимия и молекулярная биология - Белясова Н.А. 2002
Основы генетической инженерии
Практическое использование методов генетической инженерии
Генетическая инженерия на службе медицины и сельского хозяйства
Разработка методов клонирования и секвенирования ДНК позволила установить структуру геномов различных организмов: многих вирусов и бактерий, дрожжей, нематоды, дрозофилы, а к 2003 г. планируется завершить работу по «прочтению» генома человека. Создалась ситуация, при которой скорость накопления человеком знаний в области молекулярной биологии опережает его умение пользоваться ими. Возникают морально-этические и правовые проблемы, связанные с вопросами клонирования человеческих особей, получения и использования трансгенных животных, сопоставления и предания огласке сведений из генетических паспортов индивидуумов и т. п. В то же время стремительными темпами развиваются прикладные сферы генетической инженерии, особенно в области медицины и сельского хозяйства. Нельзя не остановиться на нескольких, особенно ценных методах генетической инженерии, позволивших открыть новую эру в лечении заболеваний человека, животных, растений, в выведении новых пород и сортов сельскохозяйственных объектов.
Полимеразная цепная реакция (PCR, или ПЦР). Это метод ферментативной амплификации сегментов ДНК или РНК, позволяющий многократно воспроизводить интересующий фрагмент ДНК (РНК) без помощи рестриктаз, векторов или клетки-хозяина. Метод осуществляется in vitro и полностью автоматизирован. Для PCR-реакции необходимы: два олигонуклеотида-праймера длиной ~20 нуклеотидов, комплементарных двум участкам на 3'-концах амплифицируемого фрагмента ДНК (рис. 21.4), набор дезоксинуклеозидтрифосфатов и термостабильная ДНК-полимераза. Праймеры синтезируют химическим способом, выяснив предварительно структуру комплементарных участков, с которыми они должны спариваться. Термостабильный фермент выделяют из термофильных бактерий Thermus aquaticus.
На первой стадии двухнитевую ДНК, выделенную из клеток, нагревают до 90° С для денатурации (разделение цепей), затем смесь охлаждают, чтобы произошла гибридизация праймеров с комплементарными участками (отжиг). Далее устанавливают температуру, при которой происходит полимеризация цепей (70—75° С, в этом интервале фермент наиболее активен). После этого все события цикла повторяют, начиная с денатурации ДНК. Процесс осуществляется в термостате-амплификаторе, работу которого контролирует компьютер.
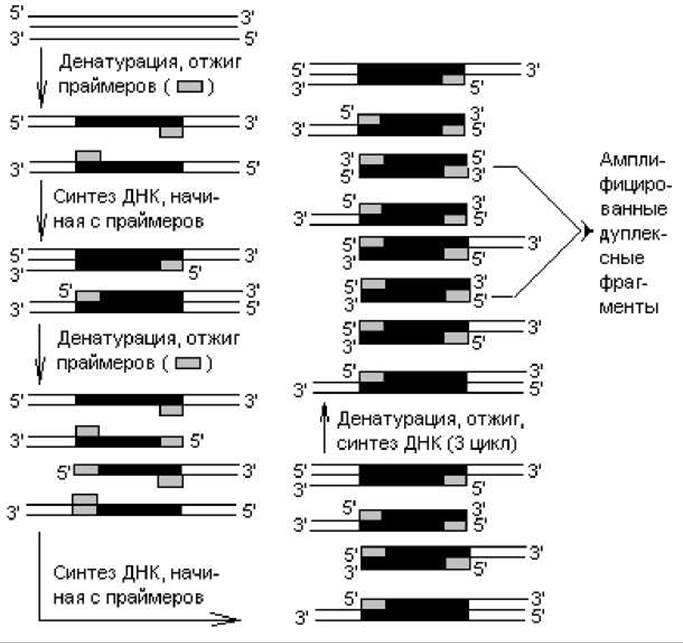
Рис. 21.4. Схема событий полимеразной цепной реакции (пояснения в тексте)
Данный циклический процесс повторяют с той же реакционной смесью 20—60-кратно. После третьего цикла амплификации начинают накапливаться двухнитевые фрагменты ДНК, равные по длине расстоянию между двумя праймерами (рис. 21.4). В каждом последующем цикле количество синтезированных фрагментов удваивается, т. е. за n циклов образуется 2n копий дуплексных сегментов с длиной, ограниченной праймерами.
Практическое применение метода PCR имеет несколько аспектов. Во-первых, с помощью амплификации определенных последовательностей ДНК, уникальных для определенных геномов или даже целых генов, можно обнаружить данные сегменты даже при условии, что изначально они присутствуют в клетках в очень малых дозах (числе копий). Например, начальные этапы вирусных инфекций характеризуются низким содержанием нуклеиновых кислот вирусов, но их можно обнаружить с помощью PCR-метода с последующей идентификацией при использовании зондов, комплементарных искомым последовательностям. Такие методы в настоящее время широко используют для детекции вирусов кори и краснухи, а также холерного вибриона.
Еще одним приложением метода является диагностирование наследственных заболеваний. Для многих наследственных заболеваний в настоящее время уже выявлены гены, а также их локусы, мутации в которых приводят к тяжелым болезням. Поскольку эти мутации передаются в поколениях индивидуумов, для ответа на вопрос — будет ли будущий новорожденный нести ту или иную мутацию требуется выявить ее у плода (пренатальная диагностика). Для этого приблизительно на 16-й неделе беременности производят отбор амниотической (околоплодной) жидкости, из которой можно выделить клетки плода в ходе центрифугирования. Из клеток извлекают ДНК. Получить препаративные количества фрагментов ДНК, предположительно содержащие мутации, можно двумя путями: клонированием соответствующих фрагментов или их амплификацией методом PCR. Второй способ гораздо проще и дешевле. После того, как искомый фрагмент ДНК получен в достаточном количестве, можно осуществить его секвенирование и сопоставить нуклеотидные последовательности нормального и анализируемого генов. Существует и более простой способ выявления мутаций во фрагментах ДНК — блот-гибридизация.
Блот-гибридизация (блотинг по Саузерну). Этот метод разработан Саузерном в Эдинбурге. Он основан на способности гомологичных цепей ДНК гибридизоваться в подходящих условиях. Суть метода состоит в следующем. Исследуемую ДНК расщепляют рестриктазами на фрагменты, которые разделяют по размеру в ходе электрофореза в агарозном геле. Затем гель помещают на нитроцеллюлозный фильтр и пропускают через него соответствующий буферный раствор в направлении, перпендикулярном направлению электрофореза. При этом фрагменты ДНК элюируются из геля и связываются с нитроцеллюлозным фильтром, на котором в результате получается реплика геля. Для поиска нужных фрагментов ДНК на реплике проводят гибридизацию с меченым зондом, специфичным к искомому гену (фрагменту). Аналогичная методика используется для анализа РНК.
В основе обнаружения мутаций в генах лежит явление полиморфизма длин рестрикционных фрагментов (ПДРФ или RFLP от англ. restriction fragment length polimorphism). Оно заключается в том, что последовательность ДНК, содержащая мутацию, может приобретать или, наоборот, утрачивать сайты рестрикции для тех или иных рестриктаз. Это можно обнаружить при разделении полученных фрагментов электрофорезом и гибридизацией с радиоактивным зондом. Сопоставление радиоавтографов для нормального и мутантного генов в этом случае позволяет обнаружить разницу в количестве и положении «полос» (рис. 21.5).
В качестве примера использования методов PCR и блот-гибридизации для ранней диагностики наследственных заболеваний можно привести пренатальную идентификацию серповидно-клеточной анемии. Причиной этого недуга является мутация в гене, определяющем структуру ß-глобиновой цепи гемоглобина, в результате чего остаток глутамата в 6 положении (кодируется триплетом GAG) замещается на остаток валина (кодируется триплетом GTG). Измененный гемоглобин имеет тенденцию кристаллизоваться в эритроцитах, при этом они становятся менее гибкими, задерживаются в селезенке, и возникает их дефицит в крови. Мутацию легко идентифицировать с помощью рестрикционных ферментов Dde I и Mst II. Нуклеотидная замена аденилата на тимидилат в смысловой цепи ДНК, вызывающая серповидно-клеточную анемию, нарушает структуру сайтов рестрикции для названных ферментов, которые, однако, остаются не измененными в нормальном гене ß-глобина. Это отличие и выявляется в ходе анализа.
Получают ДНК ß-глобинового гена или его фрагмента, который может содержать данную мутацию, используя метод клонирования или (проще) — PCR-метод. Расщепляют фрагменты, например, с помощью Dde I и осуществляют блот-гибридизацию с меченной 32Р ß-глобиновой ДНК. На радиоавтографе геля для нормальной ДНК выявляются два фрагмента длиной 201 и 175 п. н., а для мутантной ДНК — только один фрагмент размером 376 п. н. (рис. 21.5).
PCR-метод совместно с блот-гибридизацией используются также в судебно-медицинской практике, в частности для установления отцовства, а также для идентификации принадлежности биологической пробы тому или иному лицу. В последнем случае обнаруженные на месте преступления образцы биологического материала (кровь, слюна, волосы) используются для извлечения ДНК, в которой амплифицируются определенные участки (наиболее вариабельные по структуре). То же проделывают с ДНК, выделенной из крови подозреваемых лиц. После расщепления амплифицированных фрагментов рестриктазами и блот-гибридизацией с мечеными зондами получают радиоавтографы гелей. Сопоставление расположения «полос» на радиоавтографах позволяет ответить на вопрос о принадлежности биологических образцов.
Принцип метода основан на том, что одинаковые фрагменты ДНК, полученной от генетически не идентичных индивидов, часто образуют рестрикционные фрагменты различной длины. Метод достаточно чувствителен, поскольку PCR позволяет получать микрограммы ДНК-копий сегмента, даже когда он присутствует в препарате в составе единственной молекулы.
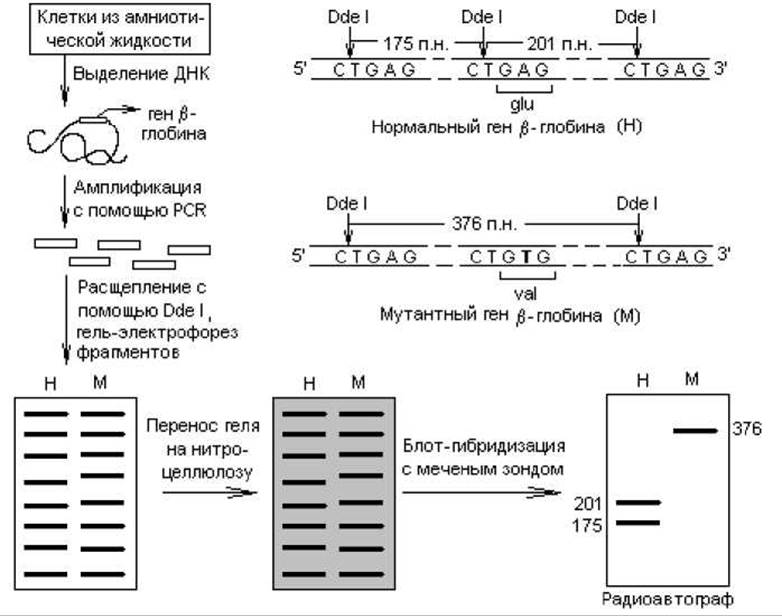
Рис. 21.5. Идентификация серповидноклеточного мутантного гена ß-глобина
Возможность идентификации мутаций в генах и умение получать практически любые гены, лишенные мутаций, позволили приблизиться к лечению наследственных заболеваний. Возникло новое направление на стыке медицины и генетической инженерии — генотерапия, под которой подразумевают введение нуклеиновых кислот в клетку с целью направленного изменения генных дефектов или придания клеткам новых функций. Основной подход генотерапии, реализуемый в настоящее время, состоит в выделении ДНК из больного организма, осуществлении исправления мутаций (например, в ходе сайт-специфического мутагенеза), введение исправленной ДНК в организм больного (метод ex vivo). Первый удачный результат генной терапии человека получен в США в 1990 г., когда с помощью методологии ex vivo удалось вылечить четырехлетнюю девочку с врожденным иммунодефицитом (мутация в гене аденозиндезаминазы). Внутривенно больной вводили собственные лимфоциты, трансформированные нормальным геном аденозиндезаминазы, клонированном на ретровирусном векторе.
Еще одно приложение генноинженерных методов к медицинским проблемам состоит в производстве вакцин, отличающихся высокой надежностью, применение которых исключает риск заболеваний (в отличие от вакцин, получаемых традиционными методами — инактивацией возбудителей). Разработаны и широко применяются генноинженерные вакцины против гепатита В и А — очень опасных заболеваний, приобретающих характер эпидемий. Разрабатываются вакцины против СПИДа.
Основными достижениями генетической инженерии для сельского хозяйства можно считать создание трансгенных животных и растений. Трансгенными считают такие особи животных, растений или микроорганизмов, генетическая программа которых изменена с использованием методов генной инженерии.
Трансгенных животных — коров, свиней, овец, коз — используют для секреции под промоторами «генов молока» высокоактивных биологических веществ для медицины и фармакологии. Уже прошли лицензирование и поступили на рынок полученные через трансгенных животных антитрипсин (для лечения легочных заболеваний), антитромбин III (для предотвращения инфарктов и инсультов), факторы свертываемости крови, лактоферрин (связывает и транспортирует в организм железо, обладает биоцидными свойствами по отношению к патогенной микрофлоре, регулирует естественный иммунитет, замедляет развитие опухолей). Первый трансгенный бычок, наследующий ген человеческого лактоферрина, получен в Голландии в 1990 г. Теперь стада трансгенных коров с этим геном есть в нескольких странах.
Методы молекулярной диагностики в применении к животным позволяют выявлять не только гены с «вредными» мутациями, которые обусловливают наследственные заболевания, но и «полезные» гены, например детерминирующие устойчивость к инфекционным заболеваниям (лейкоз, колибактериоз и др). Появляется возможность имплантировать эти гены селекционируемым животным.
Аналогичная ситуация наблюдается в отношении трансгенных растений. Изолированы гены, кодирующие ферменты деградации некоторых гербицидов. Введение этих генов в растения позволило получить устойчивые к гербицидам сорта. Другим примером является введение в геном растений модифицированных генов прототоксина Bacillus thuringiensis, в результате чего получен картофель, устойчивый к колорадскому жуку, а также хлопок и кукуруза, устойчивые к вредителям.
Показано, что растения могут производить белки животного происхождения. Например, получены трансгенные растения табака, в которых собираются полностью функциональные моноклональные иммуноглобулины, в частности специфичные к бактериям, вызывающим кариес (перспектива получения антикариесной зубной пасты). Разработаны подходы, позволяющие получать бактериальные антигены в растениях и использовать их в качестве вакцин. В настоящее время у 120 видов растений существуют трансгенные формы. Разрешено использование трансгенных сои, кукурузы, хлопка, рапса, картофеля, томатов, свеклы, тыквы, табака, льна. Эти растения выращивают в 11 странах мира. С их использованием, кроме перечисленных выше, решены такие проблемы, как устойчивость к вирусным, грибковым и бактериальным заболеваниям, регуляция сроков созревания, повышение общей продуктивности, продукция съедобных вакцин.
Перечисленные достижения, связанные с внедрением методов генетической инженерии в медицину и сельское хозяйство, получены за очень короткий срок, в основном в ходе последнего десятилетия. При этом ни научная, ни широкая общественность не успела осознать всех последствий масштабного внедрения подобных разработок в практику. Никто в настоящее время не способен гарантированно предсказать ни полную безвредность, ни безусловный вред от использования в пищу продуктов, полученных из генетически модифицированных организмов, от возделывания в неконтролируемых условиях (на естественных полях) трансгенных растений, от последствий генотерапии и т. п. Поэтому в странах, где проводятся подобные работы, существует система государственного контроля за генноинженерной деятельностью, передачей и использованием генетически модифицированных растений и животных. В большинстве государств приняты и действуют соответствующие законы, правительственные нормативные акты, строго регламентирующие требования к подобного рода исследованиям, порядок и ответственность научных организаций и государственных органов за безопасность при создании, выпуске в окружающую среду и использовании трансгенных животных и растений. Это становится особенно актуальным в связи с прогнозами специалистов, согласно которым в ближайшие годы на мировом рынке более 20 % объема всей экспортно-импортной продукции составят товары и продукты, полученные с помощью методов современной биотехнологии и биоинженерии.