Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Молекулярная генетика и системы регуляции
Технология рекомбинантных ДНК
Идентификация клонированных ДНК
Предположим, что рекомбинантные плазмиды удалось включить в популяцию клеток Е. coli и что содержащие плазмиды клетки удалось обнаружить на агаровых пластинках в селективной среде. В этом разделе мы вкратце рассмотрим методы скрининга полученных таким путем клонов и детального изучения инсерций (вставок) ДНК из интересующих нас клонов.
Прежде всего нам нужно отличать клоны, содержащие плазмиды с инсерциями чужеродной ДНК, от клонов, в состав которых входят только исходные плазмиды; это может быть достигнуто с помощью инсерционной инактивации в процессе клонирования. Предположим, например, что фрагменты ДНК включены в сайт плазмиды pBR322, расщепляемый рестриктазой PstІ. Поскольку инсердия в этом центре разрывает ген устойчивости к ампициллину, то содержащие рекомбинантные плазмиды клетки будут чувствительны к ампициллину и устойчивы к тетрациклину. Напротив, клетки с плазмидами без инсерции будут устойчивы как к ампициллину, так и к тетрациклину.
В этом случае клоны, содержащие рекомбинантные плазмиды, можно обнаружить следующим образом. Сначала клетки выращивают на пластинках в присутствии тетрациклина; таким путем избавляются от существенного фона не содержащих плазмиды клеток. Затем применяют метод реплик (отпечатков): войлочную подушечку или нитроцеллюлозную фильтровальную бумагу прижимают сначала к исходной матричной пластинке, а затем ко второй пластинке (реплике), получая на ней точную копию распределения колоний на матричной пластинке. Если реплика обработана ампициллином, то колонии клеток, содержащих плазмиды с инсерциями в гене устойчивости к ампициллину, растут на матричной пластинке, но не растут после перепечатки.
Поиск в клоне специфических нуклеотидных последовательностей может быть осуществлен с помощью ряда методик, основанных на гибридизации денатурированной (т. е. одноцепочечной) ДНК из клона с особым нуклеотидным зондом, обычно меченным радиоактивным изотопом 32Р. Нуклеотидная последовательность зонда (которым может быть как ДНК, так и мРНК) комплементарна части последовательности искомого сегмента ДНК. Зонды мРНК получают путем выделения мРНК из клеток, обогащенных интересующей исследователя генетической информацией, а зонды ДНК выделяют на одной из первых стадий клонирования или получают прямым химическим синтезом.
В методе гибридизации колонии in situ на нитроцеллюлозной Фильтровальной бумаге, лежащей на чашке Петри с питательной средой, выращивают реплику клонов. Затем клетки разрушают лизоцимом, а ДНК денатурируют обработкой NaOH, после чего нитроцеллюлозную бумагу отделяют, обрабатывают зондом, промывают и экспонируют с рентгеновской пленкой. На пленке появляются темные пятна в тех местах, где произошла гибридизация зонда с комплементарными последовательностями ДНК; эти клоны и представляют интерес для дальнейшего изучения.
Плазмидную ДНК, которую можно выделить ультрацентрифугированием в градиенте плотности хлорида цезия, далее обрабатывают рестриктазой. Полученные фрагменты ДНК образуют своеобразную картину («отпечатки пальцев») для данной плазмидной ДНК. Фрагменты могут быть разделены в соответствии с их молекулярными массами методом электрофореза в агарозном геле (0,5—1,5%); для обнаружения фрагментов ДНК часто используют флуоресцентный (краситель бромистый этидий, специфичный по отношению к двухцепочечным нуклеиновым кислотам. Путем сравнительного анализа длины фрагментов, образующихся при действии других рестриктаз и при совместном расщеплении несколькими рестрикционными эндонуклеазами, получают рестрикционную карту, характеризующую относительные положения различных сайтов рестрикции. Подобные карты чрезвычайно полезны для проверки правильности включения ДНК в заданные участки плазмиды и в качестве основы для дальнейшей работы с рекомбинантными плазмидами.
Упоминавшиеся выше меченные радиоактивными изотопами зонды можно использовать и для идентификации определенных фрагментов, образующихся при обработке рестриктазами. В методе блоттинга по Саузерну фрагменты ДНК в геле денатурируют щелочью и на гель накладывают нитроцеллюлозную пленку. Сверху помещают фильтровальную бумагу, в которую переходит буферный раствор; одновременно фрагменты ДНК переходят на нитроцеллюлозную пленку. ДНК ковалентно связывается с нитроцеллюлозой при 80°С. Затем связанные денатурированные фрагменты ДНК обрабатывают, как было описано выше, зондом, экспонируют с рентгеновской пленкой и таким образом идентифицируют полосы на электрофореграмме, соответствующие комплементарным зонду нуклеотидным последовательностям.
Современные экспериментальные методы биохимии ДНК настолько чувствительны, что нескольких нанограммов ДНК, выделенных из полосы на гелевой электрофореграмме, достаточно для клонирования или для дальнейшего изучения. Очевидно, что исчерпывающая идентификация фрагмента ДНК должна включать в себя определение его нуклеотидной последовательности. В 70-е годы были разработаны два метода быстрого, надежного и эффективного определения последовательностей нуклеотидных оснований в ДНК — Максама — Гилберта и Сэнджера. Эти методы оказали громадное воздействие на биологические науки вообще и на биотехнологию в частности.
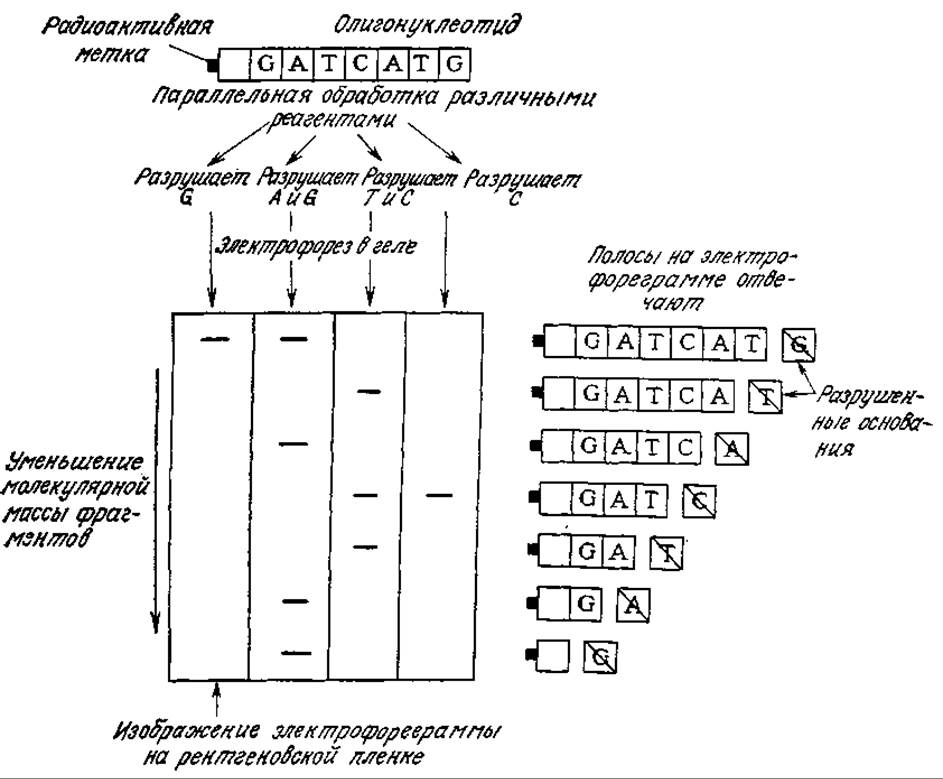
РИС. 6.24. Определение нуклеотидной последовательности методом Максама — Гилберта. При обработке изучаемой последовательности четырьмя специфическими реагентами, разрушающими различные основания, образуется смесь фрагментов, молекулярные массы которых зависят от положения расщепленного основания. Расположение полос на четырех дорожках гелевой электрофореграммы позволяет считывать нуклеотидную последовательность непосредственно с геля; считывание сверху вниз соответствует направлению последовательности к меченому концу исходного олигонуклеотида.
В методе Максама — Гилберта двойную спираль ДНК сначала метят, присоединяя радиоактивную метку к одному концу каждой цепи. Затем ДНК денатурируют и препарат одной из двух цепей разделяют на четыре аликвотные части, каждую из которых обрабатывают специфичным реагентом. В результате каждой из таких обработок селективно разрушается одно основание (или два), а цепи ДНК в этих центрах расщепляются. Для успеха метода существенно, чтобы это разрушение было частичным; в идеальном варианте желательно, чтобы каждая цепь расщеплялась бы только в одном центре. Затем образовавшиеся в результате таких четырех параллельных расщеплений фрагменты изучают на достаточно протяженном полиакриламидном геле. Полосы в геле обнаруживают с помощью чувствительной к рентгеновскому излучению фотопленки. Определяемую нуклеотидную последовательность считывают непосредственно с четырех параллельных дорожек гелевой электрофореграммы (рис. 6.24). Таким методом в одном эксперименте без труда можно выяснить последовательность около 200 нуклеотидных остатков. Метод определения нуклеотидных последовательностей по Сэнджеру рассмотрен в работе [21]; обычно его применяют при изучении более крупных фрагментов ДНК.
Часто возникает необходимость в скрининге из множества различных клонов одного клона (или нескольких клонов), обладающих способностью к экспрессии определенного белка. В большинстве случаев для решения такой задачи прибегают к помощи антитела, специфичного по отношению к данному белку. В антитела вводят радиоактивную метку (например, 125І) и раствором антител обрабатывают изучаемые колонии на пластинке; затем их промывают и с помощью рентгеновской пленки обнаруживают искомые колонии, содержащие данный белок. В другом варианте антитела связывают с ферментом и антигены обнаруживают по свойствам этого фермента. Идентифицировать колонии, содержащие искомый белок, можно, например, с помощью хромогенного субстрата (т. е. субстрата, изменяющего свою окраску или окрашивающегося после обработки ферментом). Более чувствительные иммунохимические методы, с помощью которых можно обнаружить белки в концентрациях 1—5 молекул в клетке Е. coli, описаны в приведенной в конце: главы литературе.
Объем и тематика этой книги не позволяют обсудить детально все методы идентификации и изучения клонов; все же надо надеяться, что даже приведенные здесь данные дают представление о том, насколько трудоемкой, длительной и утомительной может быть работа по скринингу клонов и по контролю каждого шага в построении новых рекомбинантных молекул. Хотя для специалиста в области биохимической технологии больший интерес представит тема следующего раздела, посвященного экспрессии клонированных генов, следует отдавать себе отчет в том, что основным препятствием в программе синтеза чужеродного белка в Е. coli или другой клетке-хозяине скорее всего будет именно клонирование гена. В то же время успехи методических разработок и развитие их автоматизации; будут содействовать внедрению «типовых методик» молекулярной генетики, что в свою очередь создаст основы для существенного расширения набора доступных и интересных генов и регуляторных последовательностей.