Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Молекулярная генетика и системы регуляции
Технология рекомбинантных ДНК
Экспрессия эукариотических белков в Е. coli
Первыми примерами успешного применения генетической инженерии в биотехнологии были синтезы ряда ценных белков-эукариот в клетках Е. coli. В этом разделе мы прежде всего рассмотрим методы получения генов, пригодных для экспрессии эукариотических белков, затем обсудим требования, предъявляемые к вектору экспрессии, и завершим раздел рядом замечаний, касающихся проблем скрининга продуктов экспрессии генов, а также устойчивости генов и соответствующих белков.
Если вернуться к рис. 6.7 и соответствующему разделу текста, нетрудно понять, что прямая экспрессия генов эукариот Е. coli связана с одним принципиальным препятствием. Прокариоты вообще и Е. coli в частности не обладают биохимическим механизмом, способным осуществлять сплайсинг РНК. Поэтому эукариотический ген, включенный непосредственно в Е. coli (при условии рассматриваемой ниже соответствующей бактериальной регуляции экспрессии), не будет нормально экспрессироваться. В Е. coli будут транслироваться последовательности нитронов эукариотического гена мРНК и синтезирующийся полипептид в общем случае будет резко отличаться от нормального эукариотического белка.
Очевидно, нам нужно каким-то образом приготовить бактериальный ген, отвечающий эукариотическому белку, т. е. такой ген, который содержал бы только нуклеотидную последовательность, кодирующую первичную структуру белка, и не имел бы ни одного нитрона. Эта цель может быть достигнута двумя принципиально различными путями. Один из них сводится к химическому синтезу заданной нуклеотидной последовательности. Хотя здесь мы не можем углубляться в детали химического синтеза генов (интересующийся этой проблемой читатель может найти все необходимые сведения в литературе), все же необходимо подчеркнуть, что синтетическая химия ДНК пока еще не позволяет осуществлять прямой синтез всего гена. Обычно синтезируют олигонуклеотиды с частично перекрывающимися последовательностями, которые обладают способностью к самосборке в полную двухцепочечную нуклеотидную последовательность за счет образования водородных связей в парах оснований. В качестве примера на рис. 6.25 приведен ген, кодирующий последовательность 21 аминокислотного остатка цепи А инсулина человека; этот ген был собран из 12 различных олигодезоксирибонуклеотидов, построенных из 10—15 нуклеотидных остатков. При планировании синтеза гена следует принимать во внимание и ряд других требований, связанных с клонированием и экспрессией, в том числе свойства кодонов, отсутствие сигналов терминации, наличие сайтов рестрикции.
Возможность химического синтеза генов или их фрагментов создает базу для чрезвычайно перспективной области белковой инженерии. В принципе уже сейчас мы можем заменить любую аминокислоту в белке, с тем чтобы попытаться повысить биологическую активность или технологическую устойчивость данного белка. Более того, мы можем заставить клетку синтезировать новые (или, во всяком случае, неизвестные нам) аминокислотные последовательности и таким путем создавать новые катализаторы, лекарственные препараты и компоненты пищевых продуктов. К сожалению, в настоящее время мы знаем так мало о связи между первичной структурой и функцией белков, что возможности улучшения свойств белков путем их модификации пока что остаются практически нереализованными.
В другом пути получения бактериального гена, соответствующего эукариотическому белку, исходят из зрелой эукариотической матричной РНК, уже прошедшей стадию сплайсинга.
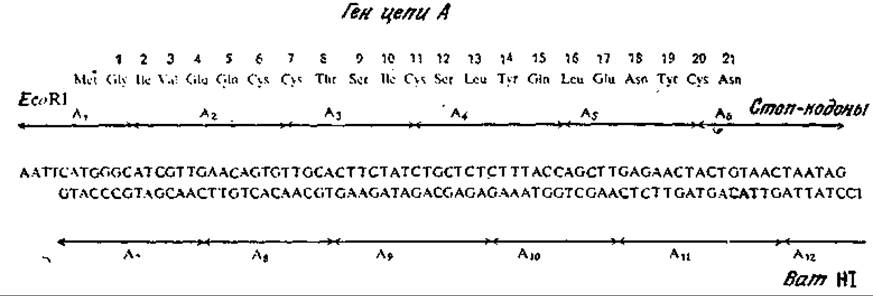
РИС. 6.25. Ген, отвечающий цепи А инсулина человека (аминокислотная последовательность приведена в верхней части рисунка). Этот ген был синтезирован из 12 олигодезоксирибонуклеотидов A1—А12. [Воспроизведено из статьи: Crea R., Kraszewski A., Hirose Т., Iiakura К., Chemical Synthesis of Genes for Human Insulin, Proc. Natl. Acad. Sсi. (USA), 75, 5765 (1978).]
Как схематично показано на рис. 6.26, соответствующая необходимому белку мРНК сама может выполнять роль матрицы, на которой особый фермент, обратная транскриптаза, может синтезировать комплементарную цепь ДНК. Цепи мРНК и ДНК затем разделяют, на цепи ДНК с помощью ДНК-полимеразы строят комплементарную цепь, после чего специфическим ферментом нуклеазой S1 отщепляют небольшой петлевой одноцепочечный участок. В результате образуется молекула двухцепочечной комплементарной ДНК (кДНК). К последней, как показано на рис. 6.26, с помощью концевой трансферазы присоединяют гомополимериые последовательности дезоксицитидина (dC). Таким путем создаются предпосылки для последующего клонирования, предпочтительно с плазмидным вектором pBR322, расщепленным рестриктазой PstІ и имеющим гомополимерные последовательности (dG).
Для эффективной экспрессии структурному гену должны предшествовать нуклеотидные последовательности, обеспечивающие инициацию транскрипции (промотирующая последовательность) и начало трансляции (связывающий рибосому сайт и стартовый кодон); за структурным геном должен следовать терминирующий кодон, означающий прекращение трансляции, и терминатор транскрипции (вспомните рис. 6.6). В векторы экспрессии входят все эти регуляторные последовательности, участок начала репликации, а также по меньшей мере один маркер селекции. С помощью клонирования и синтетическими методами получено большое число регулирующих экспрессию последовательностей, пригодных для включения в векторы экспрессии. Чаще других используются промоторы lac, trp и λpL.
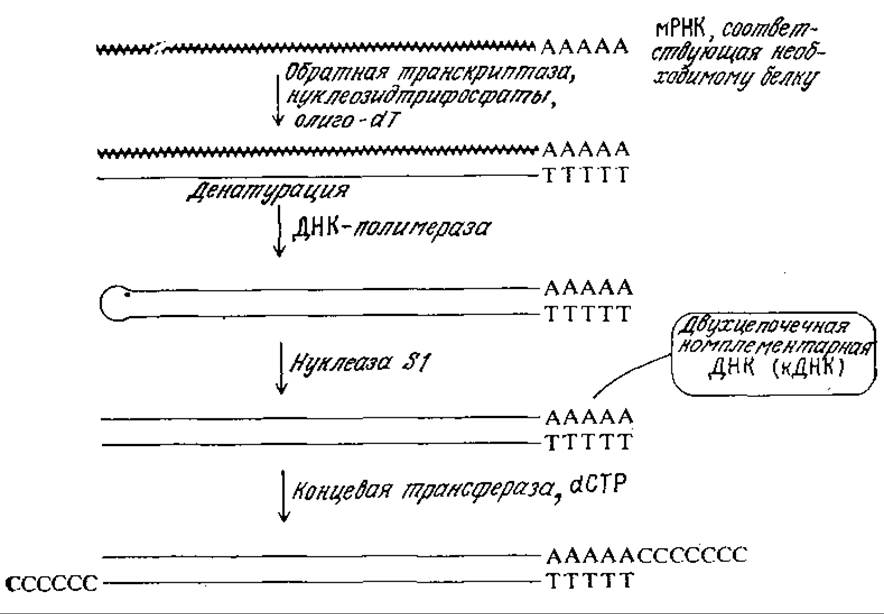
РИС. 6.26. Схема синтеза двухцепочечной ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности молекулы мРНК (волнистая линия). В результате синтеза получают пригодную для клонирования молекулу комплементарной ДНК (кДНК).
Как правило, желательно, чтобы применяющийся промотор был регулируемым, т. е. включался только при каком-либо изменении параметров среды, например при добавлении индуктора, инактивации репрессора или при изменении температуры. В хорошо отработанной системе экспрессии содержание белка, отвечающего клонированному гену, может достигать 70% от всех клеточных белков, хотя обычно эта величина составляет от 10 до 25%. Поскольку продукт экспрессии не выполняет никакой полезной для клетки-хозяина функции, столь серьезное отвлечение биосинтезирующего аппарата клетки на синтез ненужных клетке белков может сказаться на скорости роста клеток и даже на их жизнеспособности. Поэтому в практической работе, как правило, условия культивирования в реакторе меняют таким образом, чтобы сначала экспрессия клонированного гена была практически подавлена и обеспечивался в основном быстрый рост клеточной массы вплоть до достижения необходимой плотности клеток, а затем с максимальной скоростью осуществлялась бы экспрессия.
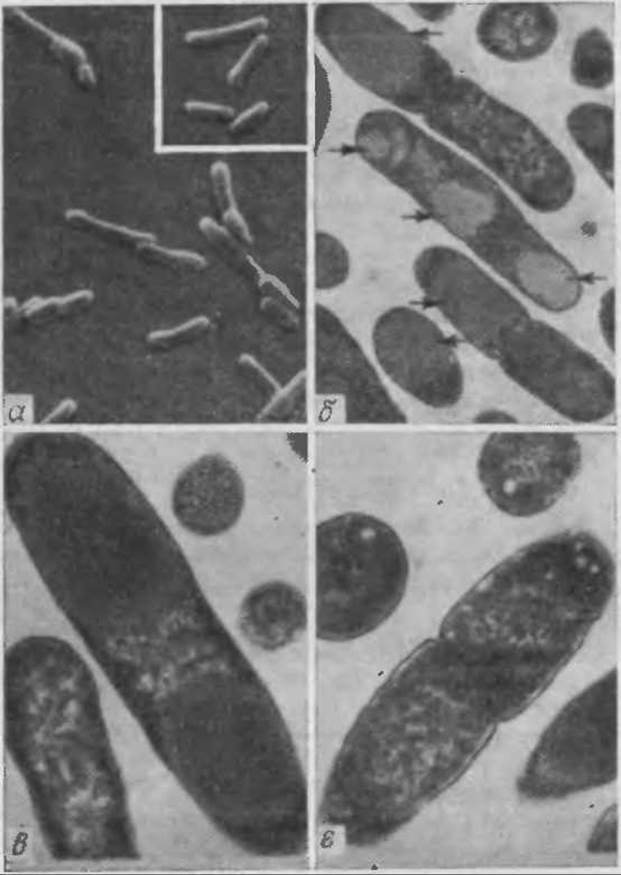
РИС. 6.27. а — электронная сканирующая микрофотография рекомбинантных клеток Е. coli, продуцирующих химерный белок политриптофан-проинсулин. Рекомбинантные клетки морфологически отличаются от нормальных клеток Е. coli (на вставке, Х5300) удлиненной формой и наличием утолщений; б — электронная просвечивающая микрофотография рекомбинантных клеток Е. coli, продуцирующих химерный белок ß-галактозидаза—цепь А инсулина (X17500); в — рекомбинантные клетки Е. coli, продуцирующие политриптофан-проинсулин (Х30 000); г — в клетках Е. coli, не содержащих плазмид, белковые включения отсутствуют (Х30 000). [Воспроизведено с разрешения из статьи: Williams D. С., Van Frank R. М., Muth IF. L., Burnett J. P., Cytoplasmic Inclusion Bodies in Escherichia coli Producing Biosynthetic Human Insulin Protein; Science, 215, 687 (1982).]
Когда в Е. coli концентрация чужеродных белков достигает высокого уровня, они аккумулируются в клетке в виде плотных образований (рис. 6.27). Последние представляют собой главным образом чужеродный белок, но содержат и небольшие количества бактериальных белков, причем чужеродный белок обычно находится в денатурированном состоянии и клетки, содержащие плотные образования, часто имеют искаженную форму. Поэтому, хотя высокая концентрация белка в той или иной степени облегчает процессы выделения, его дальнейшая стабилизация и превращение в активную форму обусловливают необходимость дополнительных технологических стадий.
Конечная продуктивность рекомбинантной культуры может лимитироваться обусловленной тем или иным фактором нестабильностью белка. Бактерия Е. coli содержит внутриклеточные протеазы, способные каким-то образом узнавать небольшие аномальные белки и разрушать их. В обычных клетках эти протеазы выполняют полезную функцию, разрушая ошибочно синтезированные белки до аминокислот, которые затем могут вновь использоваться для синтеза белков; в рекомбинантных системах подобные протеазы могут быстро расщепить весь чужеродный для клетки белок. Для повышения устойчивости последнего часто методами генной инженерии синтезируют гибридный белок, состоящий из белка Е. coli, к которому (как правило, к С-концу) присоединен чужеродный белок. Такой подход применялся для стабилизации ряда относительно небольших полипептидов, в том числе соматостатина (14 аминокислот), цепей А (21 аминокислота) и В (30 аминокислот) инсулина человека. В этих случаях роль соединительного звена между белковым фрагментом Е. coli и пептидом человека выполнял остаток метионина; при последующей обработке бромцианом, расщепляющим полипептидные цепи по остаткам метионина, образовывался активный пептид человека. (К счастью, ни один из перечисленных полипептидов не содержал остатков метионина!)
На рекомбинантных популяциях могут сказываться две различные формы генетической нестабильности. Во-первых, определенная часть вновь образующихся клеток может не содержать плазмид. В этом случае благодаря так называемой сегрегационной неустойчивости не несущие плазмид клетки могут подавлять рост содержащих плазмиды продуктивных клеток, если только система не находится под давлением отбора. Однако даже под давлением отбора сегрегационная нестабильность снижает общую скорость роста и продуктивность рекомбинантной популяции. Другой тип нестабильности — структурная неустойчивость — приводит к неспособности клеток синтезировать активный белок. Причина этой нестабильности может заключаться в мутации структурного гена или регуляторных нуклеотидных последовательностей. К сожалению, эта форма нестабильности не поддается регуляции путем давления отбора.