Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Молекулярная генетика и системы регуляции
Технология рекомбинантных ДНК
Генетическая инженерия с участием других клеток-хозяев
Е. coli — излюбленный объект подавляющего большинства работ по клонированию и генетической инженерии, поскольку этот организм наиболее детально изучен на молекулярном уровне. В то же время Е. coli практически не известна в микробиологической промышленности; будучи грамотрицательной бактерией, Е. coli содержит в своей наружной оболочке токсичные липополисахариды (заражение крови Е. coli приводит к летальному исходу в 50% случаев) и не секретирует белки в среду. К тому же как прокариота Е. coli не способна осуществлять характерные для эукариотических клеток сплайсинг и посттрансляционную модификацию белков. В силу этих и ряда других причин большой интерес представляет разработка систем клонирования и экспрессии в других, отличных от Е. coli организмах. При этом во всех случаях важно иметь в виду следующие факторы, которые могут препятствовать экспрессии чужеродного гена:
1. Разрушение чужеродных ДНК или РНК нуклеазами клетки-хозяина.
2. Несрабатывание механизма репликации вектора.
3. Низкая активность промотора или терминатора транскрипции.
4. Неполный сплайсинг мРНК.
5. Неэффективная трансляция.
6. Гидролиз протеазами.
Кроме того, необходима эффективная методика, обеспечивающая введение вектора в клетку-хозяина с высоким выходом.
Известны методы клонирования и экспрессии генов в нескольких бактериях. Из последних наиболее хорошо изучена, по-видимому, Bacillus subtilis — грамположительный, непатогенный, непаразитический микроорганизм, использовавшийся до начала эры генетической инженерии в микробиологической промышленности для производства ряда ферментов и полипептидных антибиотиков. В. subtilis секретирует некоторые свои белки в среду. В генетической инженерии последнее свойство особенно удобно, поскольку секретируемые белки обычно не загрязнены большим количеством очень близких внутриклеточных белков. К тому же секреция белка в среду в принципе позволяет достичь более высокой концентрации синтезируемого белка по сравнению с внутриклеточными белками. (Каков верхний предел количества внутриклеточного белка на единицу объема культуральной жидкости?)
В В. subtilis можно клонировать ряд плазмид и бактериофагов. Для введения в В. subtilis чужеродной ДНК могут применяться методы трансформации, трансдукции и слияния протопластов. В В. subtilis удалось успешно осуществить экспрессию нескольких белков млекопитающих, в том числе инсулина и интерферонов, однако вплоть до момента написания этой главы извлечение чужеродных белков из В. subtilis оставалось проблематичным.
Технология клонирования применима и к ряду штаммов Pseudomonas и Streptomyces. Путем сочетания генетической инженерии с методами мутации и селекции удалось получить штаммы Pseudomonas с совершенно новым механизмом метаболизма; эти штаммы, например, могут расти на обычно токсичных хлорированных углеводородах как на единственном источнике углерода. Большое промышленное значение различных видов Streptomyces обусловило интенсивное изучение возможностей применения методов генетической инженерии к этим микроорганизмам. Целью этих работ является поиск штаммов, которые были бы более продуктивными в отношении имеющих практическое значение ферментов или синтезировали бы новые полусинтетические или гибридные антибиотики.
Последние примеры заслуживают несколько более детального обсуждения. Здесь мы впервые сталкиваемся с метаболической инженерией. В целом генетическая инженерия позволяет не только синтезировать белки, представляющие интерес как таковые, но и вводить в живую клетку особые ферменты, регуляторные белки, пермеазы и вообще любые другие белки. Таким путем мы можем придать клетке совершенно новую ферментативную, регуляторную или транспортную активность, найти которую среди нативных организмов или получить путем случайного мутагенеза было бы крайне маловероятно. Отсюда следует, что теперь мы в состоянии строго определенным и направленным путем перестраивать и реконструировать отдельные участки сети метаболических превращений клетки. В перспективе именно в этом направлении в основном и будет развиваться генетическая инженерия. Пока что достижению определенных результатов мешает недостаток данных о деталях конкретных важных путей метаболизма и о стадиях, лимитирующих скорость превращений по этим путям. К тому же наши знания о регуляции всей метаболической сети явно недостаточны для того, чтобы можно было попытаться предсказать влияние изменений в одном пути на ход других. Наконец, экспрессия большого числа новых генов в рекомбинантных клетках требует разработки новых приемов генетической инженерии.
В последние годы удалось добиться больших успехов в генетической инженерии эукариотических клеток. Особенно интенсивно изучались дрожжи Saccharomyces cerevisiae; этот микроорганизм выгодно отличается мощной генетической системой, способной к прямой экспрессии как некоторых эукариотических, так и ряда прокариотических генов, а также способностью трансформироваться с помощью чистой ДНК. Дрожжи также осуществляют по меньшей мере некоторые из типичных для эукариот посттрансляционных модификаций и секретируют некоторые белки в среду. Например, рекомбинантные S. cerevisiae продуцируют антиген австралийского гепатита В, который по степени гликозилирования и агрегации, по-видимому, не отличается от антигенов, обнаруженных в организме страдающих этим заболеванием людей. Генетически модифицированные дрожжи синтезируют и секретируют в среду иммунный интерферон человека (ІNF-у).
Клонирование и экспрессия генов в клетках млекопитающих пока что осуществлялись только с помощью векторов на основе вируса SV40. Геном этого вируса (ковалентно замкнутая кольцевая ДНК) может реплицироваться в клетках млекопитающих как самостоятельно, так и после включения в хромосомы клетки-хозяина. Процесс экспрессии клонированного гена обеспечивается наличием в вирусе SV40 как промоторов, так и участка начала репликации, функционирующими в клетках млекопитающих.
Наиболее удобным для клонирования и идентификации ДНК остается все же быстрорастущий организм Е. coli, к которому применимо большинство методик генетической инженерии. Поэтому, если конечной целью являются многократная репликация вектора и экспрессия его генов в другом организме, часто оказывается удобным прибегнуть к помощи так называемого челночного вектора, который может реплицироваться как в Е. coli, так и в другом организме. Очевидно, что челночный вектор должен обладать двумя участками начала репликации — по одному на каждый организм-хозяин. На рис. 6.28 приведена схема челночного вектора, предназначенного для продуцирования иммунного интерферона (INF-у) в клетках обезьян. В этом векторе фрагмент из 342 пар оснований, содержащий участок начала репликации и «поздний» промотор из SV40. связан с фрагментом кДНК, в состав которой входят кодирующая последовательность пре-INF-y, а также с фрагментом pBR322, включающим ген устойчивости к ампициллину и участок начала репликации Е. coli. Трансфекция (инфекция клеток чистой вирусной ДНК) трансформированных клеток обезьян линии COS-7 через 3—4 дня привела к INF-y-активности порядка 50—100 единиц в 1 мл культуральной жидкости. Этот пример может служить иллюстрацией тех преимуществ, которыми обладают генетически модифицированные клетки-хозяева млекопитающих в синтезе белков млекопитающих, когда все стадии биосинтеза белков и их секреции должны с максимально достижимой точностью воспроизводить соответствующие стадии, осуществляющиеся при синтезе и транспорте этих белков in vivo.
Успешно развиваются также работы по введению чужеродных генов в целые организмы растений и животных и их последующей экспрессии. Хотя анализ методологии этих работ не входит в тематику настоящей книги, их потенциальная значимость для человека очевидна. Открывающие новые перспективы научные и технические достижения в то же время стимулировали широкие дискуссии (в том числе и в литературе) о возможности неблагоприятного воздействия биотехнологии на общество [24].
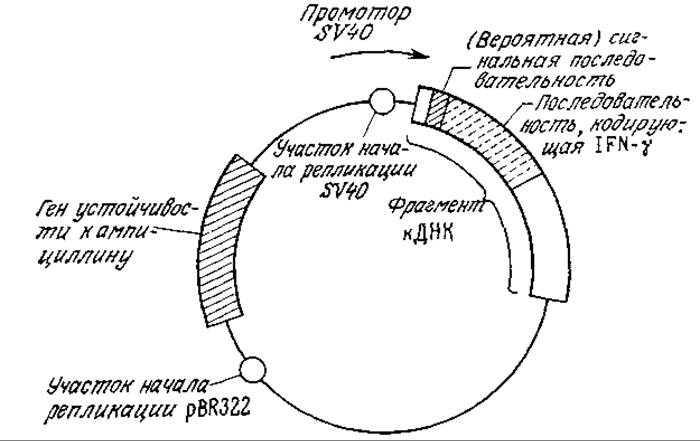
РИС. 6.28. Схема челночного вектора для Е. coli и клеток обезьяны, осуществляющего экспрессию иммунного интерферона в клетках обезьяны и его секрецию [23].