Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Химические основы жизни
Аминокислоты и белки
Пространственная структура белков; вторичная и третичная структуры
Под вторичной структурой белков понимают относительное расположение в пространстве аминокислотных остатков, занимающих соседние положения в аминокислотной последовательности. Напомним, что частичная двоесвязность амидной связи обусловливает ее планарность. По этой причине вращение возможно только вокруг двух из каждых трех связей пептидной цепи (рис. 2.18), что ограничивает число конформаций, которые может принимать короткий участок цепи.
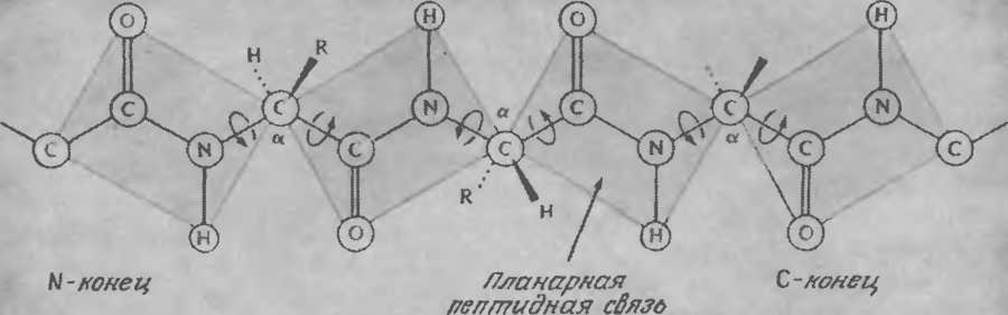
РИС. 2.18. Планарная природа пептидной связи ограничивает вращение вокруг связей пептидной цепи. (Воспроизведено из работы: Lehninger A. L., Biochemistry, 2d ed., р. 128, Worth Publishers, New York, 1975; есть перевод более раннего издания: Ленинджер А., Биохимия. — М.: Мир, 1976.)
Как мы уже отмечали (рис. 2.14), существуют две основные формы вторичной структуры белков: а-спираль и ß-структура (ß-слой). Считается, что конформация фибриллярных белков волос, шерсти и ряда других объектов стабилизируется водородными связями между атомами соседних аминокислотных остатков. При свертывании белковой цепи в спираль возможно образование таких же связей между группой —С=0 одного остатка и группой —NH другого, отделенного от первого тремя аминокислотными остатками. Такое связывание без существенной деформации связей и углов полипептидной цепи возможно только при одной конформации, называемой а-спиралью. Предполагается, что в молекуле коллагена, самого распространенного белка высших животных, имеются три а-спиральных участка, объединенных в одну суперспираль. Жесткие и относительно малоэластичные молекулы коллагена выполняют механическую (опорную) функцию. Коллаген обнаружен в коже, сухожилиях, роговице глаза и многих других органах; он важен в иммобилизации ферментов и клеток и как составляющая часть биосовместимых материалов.
Водородные связи не отличаются высокой прочностью, поэтому а-спиральные структуры легко разрушаются. Белки могут терять спиральную структуру в водных растворах в результате конкурентного образования водородных связей с молекулами воды. Если волокна шерсти обработать паром и растянуть, то белки шерсти принимают иную конформацию, называемую ß-структурой (ß-слоем, складчатым слоем). Последняя характерна для нативных белков волокна шелка. ß-Структура также стабилизирована водородными связями, однако в этом случае они возникают между соседними параллельными цепями. Для этой структуры характерны гибкость и в то же время высокая устойчивость к растяжению.
Свойства вторичной структуры фибриллярных белков используются в пищевой промышленности. Некоторые пищевые продукты растительного происхождения, например соевые бобы, являются ценными источниками незаменимых аминокислот; в то же время они не обладают консистенцией и текстурой мясных продуктов. Для придания им этих качеств растворенные глобулярные белки перерабатывают в так называемый «текстурированный белок» путем их трансформации в структуры, более близкие к линейным.
В результате чрезвычайно трудоемких и сложных экспериментов удалось определить полное пространственное строение (третичную структуру) нескольких белков. Для этой цели выращивали кристаллы чистого белка, которые затем изучали методом рентгеноструктурного анализа. В результате рассеяния рентгеновских лучей на атомах образуется сложная дифракционная картина, которая содержит информацию о деталях строения белка при разрешении до 2 Å. Дешифровка этой информации в случае миоглобина (рис. 2.19) потребовала расчета 10 000 рядов Фурье, поэтому выяснение строения белков этим методом в общем случае целесообразно только при условии использования высокоэффективных компьютеров.
Как показано на рис. 2.17,6 и 2.19, третичная структура белков, особенно глобулярных, чрезвычайно сложна. На указанных рисунках без труда можно найти области со спиральной вторичной структурой, а в молекуле лизоцима, кроме того, имеются и участки с ß-структурой. Каким путем стабилизируются эти структуры и какой цели служит класс соединений, молекулы которых обладают таким разнообразным строением?
Взаимодействия между боковыми группами R, удаленными друг от друга в аминокислотной последовательности белков, определяют характер складывания или изгиба белковой цепи с образованием компактных конфигураций, типичных для глобулярных белков. Трехмерная структура белка формируется в первую очередь за счет некоторых слабых взаимодействий, в том числе ионных и водородных связей, а также гидрофобного взаимодействия между неполярными группами R (рис. 2.20). Подобно рассмотренным ранее мицеллам, образующимся из липидов, у многих глобулярных белков гидрофобные остатки сконцентрированы во внутренней части молекулы, а более гидрофильные группировки располагаются на ее поверхности. Такая конформация, иногда называемая моделью масляной капли, вероятно, наиболее устойчива в естественной для нативных белков водной среде. (Чем, по вашему мнению, отличается от описанной структура белка, входящего в состав клеточной мембраны?)
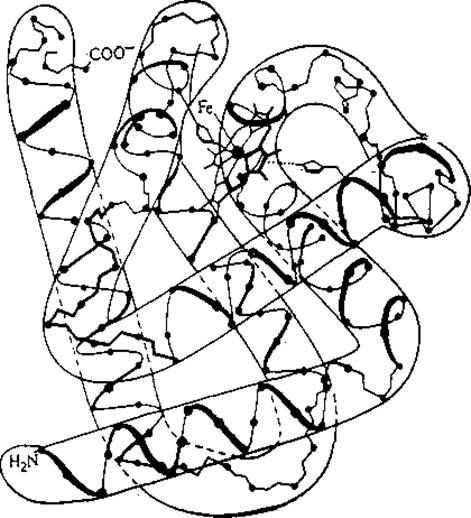
РИС. 2.19. Трехмерная структура миоглобина. Точками указаны положения а-углеродных атомов 121 аминокислотного остатка в этом белке, выполняющем функцию переносчика кислорода. В середине верхней части молекулы более крупным кружком выделен атом железа, расположенный в центре единственного гема белка. (Воспроизведено из работы: Edwards N. А., Hassall К. А., Cellular Biochemistry and Physiology, p. 57, McGraw-Hill Publishing Co., Ltd., London, 1971.)
В биохимической технологии со многих точек зрения чрезвычайно важно понять, что эти слабые взаимодействия легко нарушаются при различных изменениях окружающей среды. В биологических системах энергия водородной связи составляет от 3 до 7 ккал/моль, а энергия ионной связи обычно равна 5 ккал/моль, поэтому уже умеренное нагревание может нарушить некоторые из этих связей. Изменение pH, ионной силы, физические воздействия и добавки органических веществ, очевидно, также могут нарушать третичную структуру белков, свойственную им в нативной форме.
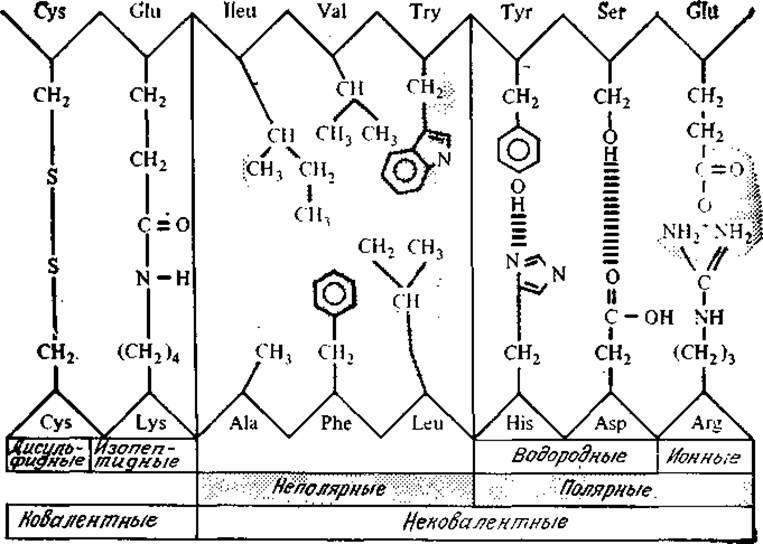
РИС. 2.20. Различные типы связей и взаимодействий, стабилизирующих молекулярную структуру белка. (Из работы: Лёви А., Сикевиц Ф., Структура и функция клетки.—М.: Мир, 1971, с. 245.)
В создании устойчивых конформаций белков важную роль играют также ковалентные связи, особенно часто образующиеся между двумя остатками цистеина. Дисульфидная связь образуется между двумя группами —SH путем элиминирования двух атомов водорода:
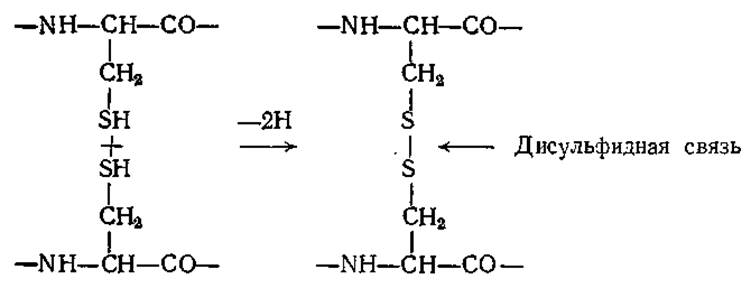
Дисульфидные мостики играют роль поперечных связей в полипептидной цепи, а иногда они связывают две различные цепи; молекула инсулина, например, представляет собой две цепи, содержащие 21 и 30 аминокислотных остатков, соединенные двумя дисульфидными связями; третий дисульфидный мостик образует внутреннюю поперечную связь в короткой цепи (рис. 2.21). По сравнению с указанными выше слабыми связями дисульфидные ковалентные мостики более устойчивы к термическому воздействию. В то же время дисульфидные связи легко восстанавливаются избытком сульфгидрильных соединений, например ß-меркаптоэтанолом.
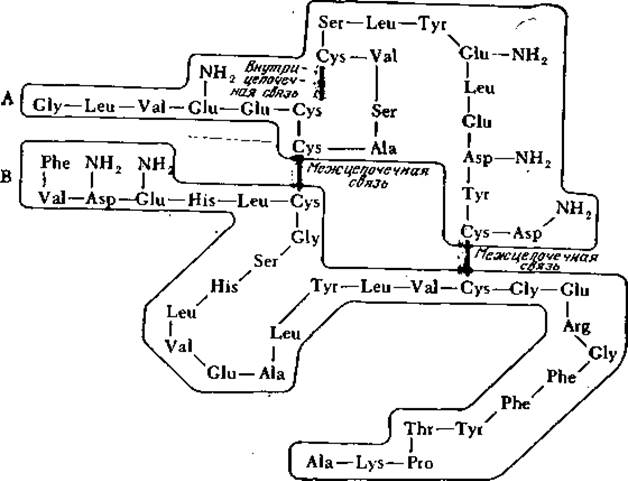
РИС. 2.21. Дисульфидные мостики связывают две пептидные цепи, называемые цепью А (21 аминокислотный остаток) и цепью В (30 остатков), в изображенной здесь молекуле бычьего инсулина; инсулины других видов животных построены аналогичным образом. Обратите внимание на третью внутрицепочечную дисульфидную связь между двумя остатками короткой цепи А. (Воспроизведено из работы: Reithel F. J., Concepts in Biochemistry, p. 237, McGraw- Hill Book Co., New York, 1967.)
Конформация белка в существенной степени определяет его биологическую активность. Многочисленные экспериментальные факты свидетельствуют о том, что во многих случаях белок способен выполнять свойственную ему функцию, только находясь в определенной трехмерной структуре. Этот принцип, в частности, положен в основу так называемой модели «замка и ключа», достаточно наглядно объясняющей высокую специфичность белковых ферментов, катализирующих биохимические превращения. Известно, что данный фермент способен превращать только определенные соединения, называемые субстратами. Согласно модели замка и ключа (рис. 2.22), фермент обладает специфическим участком («замком»), который по своей структуре комплементарен молекуле субстрата («ключу»), поэтому с ферментом могут связываться (и, следовательно, подвергаться дальнейшим каталитическим превращениям) только субстраты, обладающие необходимой пространственной структурой. Полученные в ходе изучения третичной структуры белков данные не только подтвердили эту гипотезу, но и помогли глубже понять механизм каталитического эффекта ферментов; на этой теме мы остановимся подробнее в следующей главе. Неоднократно показано, что непосредственная связь между пространственным строением белков и их высокоспецифическими взаимодействиями с другими веществами характерна также для пермеаз, гормонов, антител и других белков.
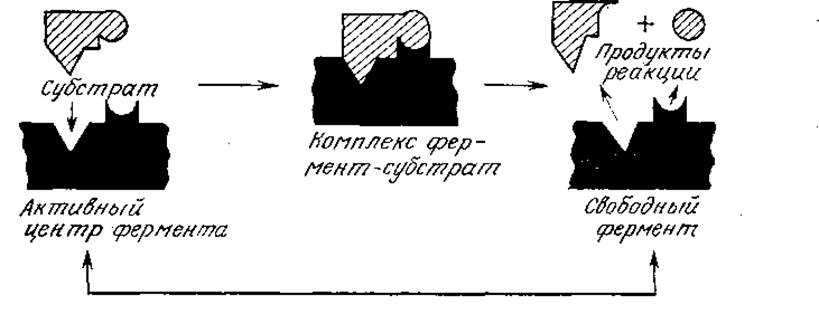
РИС. 2.22. Упрощенная схема модели ферментативного катализа типа «замок и ключ». Здесь форма каталитически активного центра фермента (замка) комплементарна форме субстрата (ключа). (Воспроизведено из работы: Реlсzar М. Jr., Reid R. D., Microbiology, 3d ed., p. 158, McGraw-Hill Book Co., New York, 1972.)
Если белок находится в условиях, отличающихся от его обычного биологического окружения, он может подвергаться структурным изменениям, которые обычно сопровождаются потерей его функциональных свойств (рис. 2.23); этот процесс называют денатурацией. Денатурация может быть вызвана, например, относительно небольшими изменениями pH и температуры раствора; в этом случае, как правило, она не сопровождается разрушением ковалентных связей. При медленном охлаждении разбавленного раствора денатурированного белка до свойственной ему в природных условиях температуры часто происходит обратный процесс, называемый ренатурацией, сопровождающийся восстановлением функции белка. Как и в случае многих других превращений, повышение температуры способствует росту энтропии (разупорядоченности) и, следовательно, разрушению глобулярных структур белков; охлаждение благоприятствует осуществлению взаимодействий, обеспечивающих компактную структуру белка и его ренатурацию.
Принимаемая белком и определяющая его свойства конформация характеризуется минимумом свободной энергии молекулы. Пока что эту концепцию нельзя использовать для предсказания структуры и функции белка, если известна только его аминокислотная последовательность. Она может, однако, оказаться полезной в тех случаях, когда необходимо высказать обоснованные предположения об изменении свойств белка в условиях конкретного технологического процесса (которые часто существенно отличаются от условий существования надивного белка) или в результате частичного изменения его аминокислотной последовательности. В частности, эта концепция помогает понять, почему связанный с твердой поверхностью фермент менее активен, чем тот же фермент в растворе.
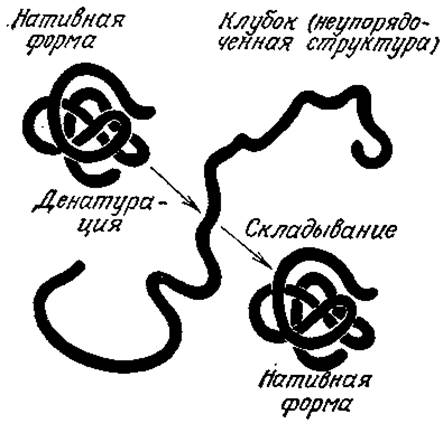
РИС. 2.23. Денатурированный под влиянием тех или иных факторов белок часто может вновь принять нативную биологически активную конформацию, как только действие этих факторов прекращается. Такого рода эксперименты показывают, что первичная структура белка определяет его вторичную и третичную структуры. (Воспроизведено из работы: Lehninger A. L., Biochemistry, 2d ed., р. 62, Worth Publishers, New York, 1975; есть перевод более раннего издания: Ленинджер А., Биохимия.— М.: Мир, 1976.)
В настоящей главе много внимания было уделено связи между строением белков и их функцией. В то же время не следует забывать, что в силу слабости большинства взаимодействий и связей, стабилизирующих молекулы белков, реальные конформации последних могут в существенной степени отклоняться от некоторой характерной усредненной конформации. Более того, эта способность белков в ряде случаев тесно связана с их биологической функцией подобно тому, как биологическая функция ДНК определяется ее способностью разделяться в изотермических условиях внутри клетки на две цепи. С точки же зрения биохимика-технолога относительная легкость термической или химической денатурации многих белков говорит в первую очередь о том, что ферментативные и клеточные процессы можно регулировать путем изменения, например pH, температуры и ионной силы, только в довольно узких пределах. Денатурацию полезно учитывать и в некоторых других случаях, например при выделении белков (гл. 11) и в конструкциях стерилизаторов (гл. 7 и 9).