Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Кинетика простых ферментативных реакций с одним и двумя субстратами
В настоящем разделе мы попытаемся вывести математические выражения, характеризующие скорости катализируемых ферментами реакций. Естественно, важнейшим критерием правильности такого выражения будет соответствие вычисленных и экспериментально найденных скоростей. Чтобы исключить возможные недоразумения, сначала мы в общих чертах опишем некоторые экспериментальные методы определения скоростей реакций.
Прежде всего определим, что мы имеем в виду под скоростью реакции. Рассмотрим реакцию ![]()
Скорость этой реакции в приближении квазиравновесного состояния (раздел 3.2.1) определяется как
![]() (3.1)
(3.1)
где символами s и р обозначены молярные концентрации исходного вещества S и продукта реакции Р соответственно. Отсюда следует, что v выражается в числе молей в единице объема в единицу времени. Скорость реакции является интенсивной величиной, имеющей определенное значение в каждой точке реакционной смеси. Поэтому, если концентрации или другие интенсивные переменные изменяются от точки к точке, то и скорости реакции в этих точках будут различными. При экспериментальном изучении кинетики часто используют реакторы с эффективным перемешиванием, в которых обеспечивается одна и та же скорость реакции во всем объеме реакционной смеси.
Как и при моделировании любых других технологических процессов, слово «точка» в определении скорости реакции используется не в строго геометрическом смысле. Напротив, здесь под точкой подразумевается некоторый объем, в который входит множество молекул, но который тем не менее очень мал по сравнению с объемом всей реакционной смеси. Это на первый взгляд не столь существенное уточнение очень важно не забывать при переходе от гипотетических моделей к конкретным биологическим системам. Например, при моделировании молекулярных процессов в отдельной изолированной клетке понятия о концентрации данного вещества А1 и скорости его превращения в определенной точке могут оказаться вообще неприменимыми, если в клетке содержится только небольшое число молекул А1. К этому вопросу мы вернемся позднее, при изучении кинетики роста клетки (гл. 7).
Типичный эксперимент по изучению кинетики ферментативных реакций (т. е. реакций, катализируемых ферментами) обычно проводят следующим образом. В нулевой момент времени растворы субстрата и соответствующего очищенного фермента смешивают при эффективном перемешивании в закрытом сосуде, в котором поддерживается постоянная температура и который содержит буферный раствор, необходимый для поддержания определенного значения pH. Далее через заданные промежутки времени определяют концентрации субстрата и (или) продукта реакции. Для этой цели применяют различные методы, в том числе спектрофотометрические, манометрические, электродные, поляриметрические, а также методы, связанные с отбором проб. Обычно используют только данные о начальных скоростях реакций. Поскольку условия реакции, в том числе концентрации фермента и субстрата, точнее всего известны при нулевом времени реакции, начальный наклон кривой, отражающей изменение концентрации субстрата или продукта реакции в зависимости от времени, определяется по следующим данным:
![]()
На рис. 3.5 приведены данные, полученные в одном из экспериментов описанного типа. Обратите внимание на то, что при t = 0 в смеси уже имеется некоторое количество продукта реакции; отсюда следует, что нулевое время на самом деле не является временем начала реакции. В этом заключается одна из трудностей, присущих методу определения начальных скоростей реакций; другие недостатки метода описаны в специальной литературе по химической кинетике. Тем не менее метод начальных скоростей позволяет с достаточной воспроизводимостью определять ферментативную активность и концентрации веществ в первый момент реакции и поэтому с успехом может применяться в практической работе.
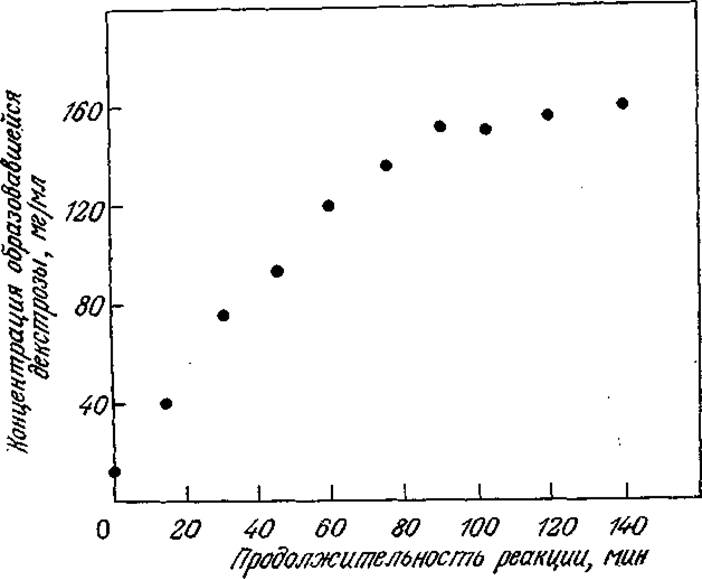
РИС. 3.5. Экспериментальное определение скорости гидролиза 30%-го раствора крахмала глюкоамилазой в реакторе периодического действия (60 °С, е0 = 11 600 единиц, объем реактора 1 л).
Проблема воспроизводимости результатов определения ферментативной активности важна со многих точек зрения, в том числе и с точки зрения конструкций реакторов, в которых осуществляются процессы с изолированными ферментами. В предыдущих разделах мы уже упоминали, что белки в условиях, отличающихся от свойственного им биологического окружения, легко подвергаются денатурации; в этой связи неудивительно, что изолированный фермент в «необычной» для него водной среде может постепенно терять свою каталитическую активность (рис. 3.6). Известно, что такая инактивация характерна для многих ферментов; в то же время во многих руководствах по кинетике ферментативного катализа это явление в лучшем случае только упоминается. Проблема постепенной потери каталитической активности ферментами не столь существенна in vivo (в интактном живом организме), когда снижение концентраций ферментов за счет инактивации компенсируется их биосинтезом в необходимых количествах. Напротив, инактивацию фермента in vitro (вне живой клетки) необходимо учитывать как при изучении кинетики реакций, так и при проектировании ферментативных реакторов. К этой теме мы обратимся еще раз в разд. 3.7.
В подписи к рис. 3.5 (в скобках) нам впервые встречается другая типичная для кинетики ферментативного катализа особенность. Обратите внимание на то, что количество фермента, использовавшегося в этом эксперименте, выражено в неких «единицах». Что это за таинственные единицы и почему нельзя количество фермента выразить более понятным и более определенным способом, например в молях или в единицах массы?
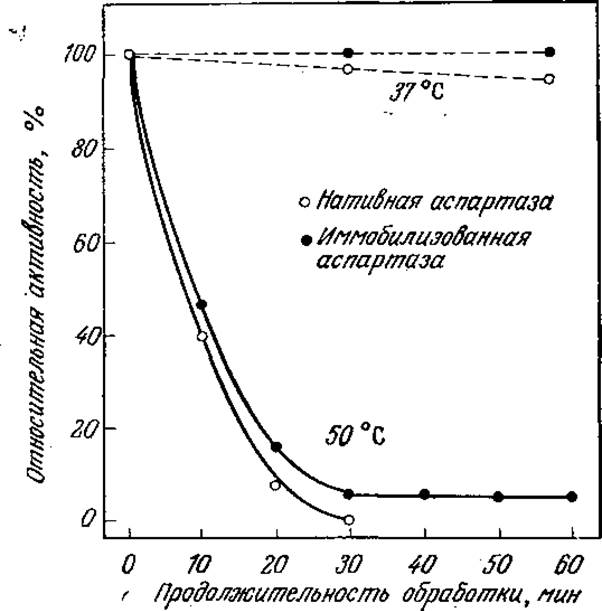
РИС. 3.6. Инактивация фермента в растворе. В течение 1 ч при 37 °С раствор аспартазы теряет более 5% исходной активности. [Воспроизведено из статьи: Tosa Т. et al., Continuous Production of L-Aspartic Acid by Immobilized Aspartase, Biotech. Bioeng., 15, 68 (1973)].
Сначала ответим па вторую часть вопроса. Количество фермента обычно не выражают, например, в единицах массы, поскольку ферментные препараты, как правило, представляют собой смесь различных белков, в которой данный фермент является всего лишь одним из нескольких компонентов. Содержание интересующего нас фермента в этой смеси часто неизвестно; более того, оно может быть различным в разных партиях препарата. Чтобы охарактеризовать препарат, содержание фермента обычно выражают в единицах каталитической активности, содержащейся в единице массы ферментного препарата.
Единицей или единицей активности называют количество фермента, которое обладает определенной каталитической активностью в заданных для этого фермента стандартных условиях. Например, в эксперименте по гидролизу крахмала, результаты которого приведены на рис. 3.5, за единицу активности глюкоамилазы принимали количество фермента, которое в 4%-ном растворе крахмала Линтнера при pH 4,5 и температуре 60 °С образует 1 мкмоль глюкозы в 1 мин. Отсюда следует, что единица активности каждого конкретного фермента будет иметь свое специфическое определение и, более того, один фермент может иметь несколько определений активности в зависимости от конкретных условий катализируемых им реакций. Поэтому во избежание ошибок при интерпретации или использовании результатов изучения кинетики реакций ферментативного катализа всегда следует тщательно проверять применяемое в каждом случае определение единицы ферментативной активности. Конечно, вероятность ошибки резко снижается, если известна активность высокоочищенного фермента.