Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Регуляция ферментативной активности
Изменять, или модулировать, каталитическую активность ферментов могут не только субстраты, но и другие взаимодействующие с ферментами вещества; их называют модуляторами, или эффекторами. Эффекторы могут быть обычными компонентами клетки, но могут и проникать в клетку из среды или действовать на изолированные ферменты. Основное внимание в этом разделе будет уделено ингибиторам — веществам, понижающим ферментативную активность. Следует, однако, иметь в виду, что известны и случаи активации ферментов субстратами.
Взаимодействие фермента с эффектором представляет собой химическую реакцию и поэтому может быть полностью обратимым, частично обратимым или практически необратимым. К числу известных необратимых ингибиторов принадлежат яды, например цианидный ион, инактивирующий ксантиноксидазу, а также группа соединений, называемых нервнопаралитическими ядами-, последние необратимо инактивируют холинэстеразы (ферменты, участвующие в системах передачи нервных импульсов и, таким образом, в моторной активности). Если процесс ингибирования необратим, то кинетика ингибиторзависимых ферментативных реакций не подчиняется уравнению Михаэлиса — Ментен, основой которого является наличие равновесия между свободной и связанной формами фермента. Часто по мере полной инактивации все большего и большего числа молекул фермента процесс необратимого ингибирования прогрессирует во времени. В других случаях, труднее поддающихся выявлению, фермент инактивируется лишь частично и сохраняет каталитическую активность, хотя и в меньшей степени по сравнению с чистым ферментом.
В разд. 2.6 мы уже говорили о замечательной способности большинства микроорганизмов продуцировать множество разнообразных сложных соединений из относительно небольшого числа простых предшественников. Для достижения этой цели необходима некая система очень эффективного распределения поступающих предшественников по многим биосинтетическим путям, ведущим к различным конечным продуктам метаболизма. В большинстве случаев принцип оптимального усвоения доступного исходного продукта требует синтеза любого из конечных продуктов только в строго необходимом количестве. Если, например, в клетке имеется достаточное количество данного мономера, то его дальнейшее накопление должно быть прервано, с тем чтобы ресурсы клетки могли быть направлены на синтез других соединений, количество которых в этот момент относительно мало.
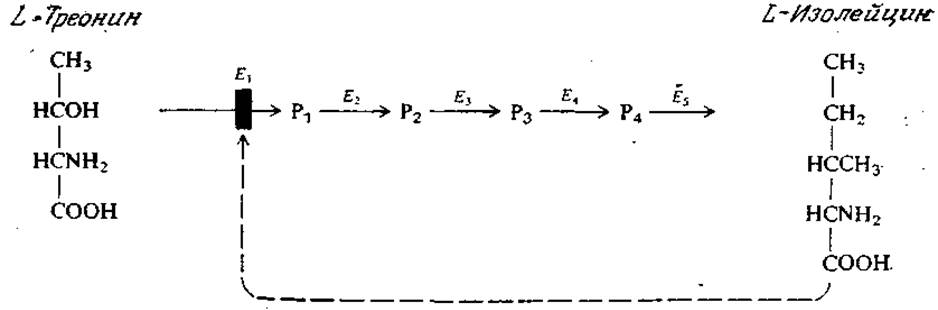
РИС. 3.19. Последовательность реакций биосинтеза L-изолейцина, ингибируемая по принципу обратной связи; здесь активность фермента E1(L-треонин-дезаминазы) снижается в присутствии конечного продукта последовательности — L-изолейцина. (Р1 = а-кетобутират; Р2 = а-ацетогидроксибутират; Р3 = а,β-дигидрокси-β-метилвалерат; Р4 = а-кето-β-метилвалерат.)
Одним из регуляторных механизмов, используемых клеткой для достижения максимально эффективного усвоения питательных веществ, является обратимая регуляция ферментативной активности. (Другой важный механизм управления будет рассмотрен в гл. 6, разд. 1.) Наиболее интересные примеры регуляции ферментативной активности включают в себя сложную сеть реакций с несколькими регуляторными петлями; эти примеры мы рассмотрим позднее, после того как изучим основы химии клетки (гл. 5). Сейчас же нам будет достаточно примера регуляции простой последовательности реакций. На рис. 3.19 изображена пятистадийная последовательность биосинтеза
аминокислоты L-изолейцина. Регуляция этой последовательности реакций осуществляется путем ингибирования по принципу обратной связи, когда конечный продукт, L-изолейцин, ингибирует активность фермента, катализирующего первую стадию последовательности. Таким образом, биосинтез конечного продукта последовательности реакций будет тормозиться по мере его накопления.
Таблица 3.7. Некоторые типы обратимого ингибированияa
Тип ингибирования |
Механизм ингибирования |
Ингибирующий эффект |
Ia. Полное конкурентное |
Ингибитор сорбируется активным центром, связывающим субстрат |
Увеличение кажущегося значения Кm |
б. Частичное конкурентное |
Ингибитор и субстрат связываются различными центрами; связывание ингибитора влияет на связывание субстрата |
Увеличение кажущегося значения Кm |
IIа. Неконкурентное |
Связывание ингибитора не влияет на сродство субстрата к ферменту, но фермент-субстрат-ингибиторный комплекс устойчив и далее не диссоциирует |
Снижение Vmax без изменения Кm |
б. Неконкурентное |
Тот же, что в ингибировании типа IIа, но фермент-субстрат-ингибиторный комплекс распадается с образованием нормального продукта реакции со скоростью, меньшей скорости диссоциации ES |
Снижение Vmax без изменения Кm |
III. Смешанное |
Изменение как Кm, так и Vmax |
а Из работы: Диксон М., Уэбб Э., Ферменты. — М.: Мир, 1966.
Поскольку катализируемые ферментами Е2—Е5 реакции находятся в состоянии равновесия, а первая реакция в клеточной среде «необратима», то быстродействие такой регуляторной системы очень высоко. По сути дела, большинство регуляторных ферментов катализирует именно такие «необратимые» реакции. С точки зрения биологии клетки очевидно, что такая «природная» регуляция ферментативной активности должна быть обратимой. Если, например, весь L-изолейцин был израсходован в процессе белкового синтеза, то ингибирование фермента E1должно прекратиться и система вновь должна синтезировать необходимое количество этой аминокислоты.
В случае обратимого ингибирования изложенные в разд. 3.2 подходы к анализу кинетики оказались очень плодотворными. Поскольку многие изолированные фермент-субстратные системы подчиняются кинетике Михаэлиса — Ментен, принято классифицировать ингибиторы по их влиянию на параметры уравнения Михаэлиса — Ментен vmах и Кm.
Обратимые ингибиторы называют конкурентными, если в их присутствии повышается значение Km, а vmах не изменяется. Вызываемый ингибиторами такого типа эффект можно частично или полностью подавить путем повышения концентрации субстрата. Неконкурентные ингибиторы, напротив, инактивируют фермент или фермент-субстратный комплекс путем уменьшения vmах фермента, но не влияют на величину Km. В этом случае повышение концентрации субстрата до сколь угодно высокого уровня уже не позволит повысить скорость реакции до величины, характерной для неингибированного фермента. Типичными примерами неконкурентных ингибиторов являются ионы тяжелых металлов, обратимо реагирующие с сульфгидрильными (—SH) группами цистеиновых остатков.
Известны несколько сочетаний и вариантов этих двух основных типов обратимых ингибиторов; некоторые из них приведены в табл. 3.7. Чуть позже мы рассмотрим экспериментальные методы определения типа ингибирования, но прежде вкратце обсудим некоторые теории, объясняющие механизмы действия регуляторов ферментативной активности, и соответствующие экспериментальные данные.