Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Другие типы зависимостей скорости ферментативной реакции от концентрации субстрата
Взаимодействие одного фермента с несколькими различными субстратами
Многие ферменты могут взаимодействовать с несколькими субстратами. В таких случаях различные субстраты конкурируют за связывание с активным центром (здесь мы принимаем, что роль активного центра для различных субстратов выполняет один и тот же участок молекулы фермента). Наиболее известными примерами ферментов такого типа являются гидролизующие деполимеразы, которые расщепляют многие идентичные связи, часто независимо от длины гидролизуемого полимерного сегмента. В то же время кинетические параметры реакций такого фермента с димером, тримером или олигомером могут заметно отличаться от параметров аналогичной реакции с достаточно высокомолекулярными полимерными цепями. Примером таких ферментов может служить лизоцим, содержащийся в яичном белке, слизистых выделениях и слезах. Лизоцим гидролизует сложные мукополисахариды, в том числе и муреины клеточных стенок, вызывая гибель грамположительных бактерий. Приведенные выше общие положения подтверждаются экспериментальными данными (табл. 3.6), где указаны найденные скорости и константы диссоциации для каждого субстрата лизоцима в отсутствие других субстратов. Нетрудно видеть, что наибольшие отличия характерны для мономерного и олигомерных субстратов.
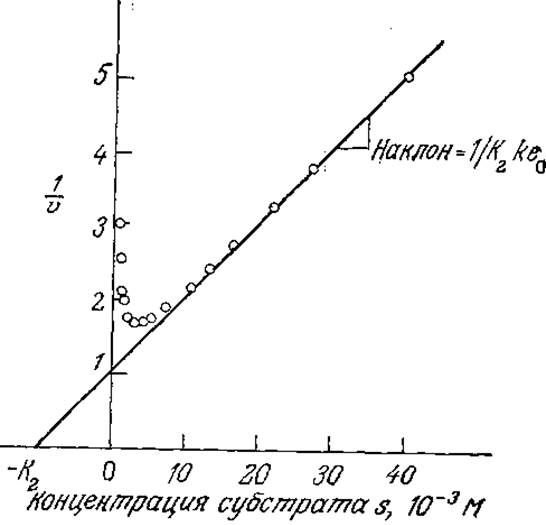
РИС. 3.16. Способ определения константы К2 по наклону прямой зависимости 1/v от s. Приведены данные для гидролиза этилбутирата карбоксипептидазой из печени овцы. (Из работы: Диксон М., Уэбб Э. Ферменты, т. 1—3. — М.: Мир, 1982, т. 1, с. 99.)
Таблица 3.6. Кинетические параметры реакции лизоцима с компонентами клеточной стенки бактерий (сополимеры GlcNAc—MurNAc; GlcNAc — N-ацетилглюкозамин, MurNAc—N-ацетилмурамовая кислота)a

a По данным работы: Chipman D. М., A Kinetic Analysis of the Reaction of Lysozyme with Oligosaccharides from Bacterial Cell Walls; Biochemistry. 10, 1714 (1971).
В приведенных выше и в последующих примерах каждую подвергающуюся гидролизу связь олигомера или полимера можно рассматривать как индивидуальный субстрат. Более того, полимерный субстрат типа крахмала на самом деле также представляет собой не индивидуальный субстрат в строгом смысле слова, а смесь полимеров различной молекулярной массы, которые к тому же могут содержать мономер-мономерные связи разных типов (разд. 2.2.2). На рис. 3.17 отражены различия в кинетике гидролиза разных крахмалов. Пример кинетики ферментативного гидролиза более четко охарактеризованной системы приведен на рис. 3.18. Такого типа реакции используются в промышленности для разжижения растворов крахмала амилазами. Аналогичные эффекты следует ожидать и в других подобных реакциях, например, в случае гидролиза белков протеолитическими ферментами. Прежде чем перейти к количественной оценке конкуренции между различными субстратами, следует подчеркнуть, что в приведенных выше примерах определенную роль могут играть и другие факторы, в частности различия в физических размерах и состояниях индивидуальных субстратов, а также в числе поддающихся гидролизу связей в каждом из находящихся в реакционной смеси субстратов.
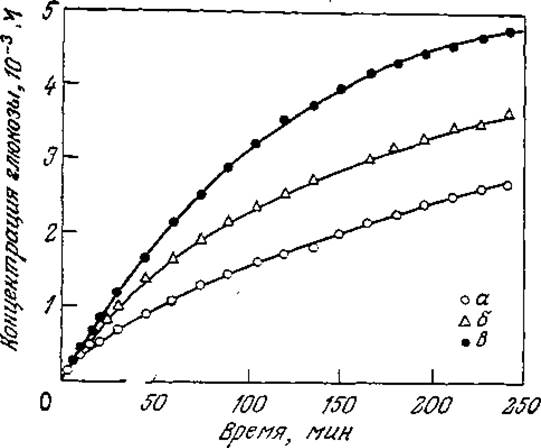
РИС. 3.17. Кривые зависимости скорости гидролиза различных фракций амилозы под действием амилоглюкозидазы от времени (25 °С; pH 4,6; s0 = 0,1 г/100 мл, е0 = 6,8∙10-8 М); молекулярные массы фракций амилозы около 1 650 000 (а), 1 100 000 (б) и 360 000 (в). [Воспроизведено с разрешения из статьи: Hiromi К. et al, A Kinetic Method for the Determination of Number-Average Molecular Weight of Linear High-Polymer by Using an Exo-Enzyme, J. Biochem. (Tokyo), 60, 439 (1966).)
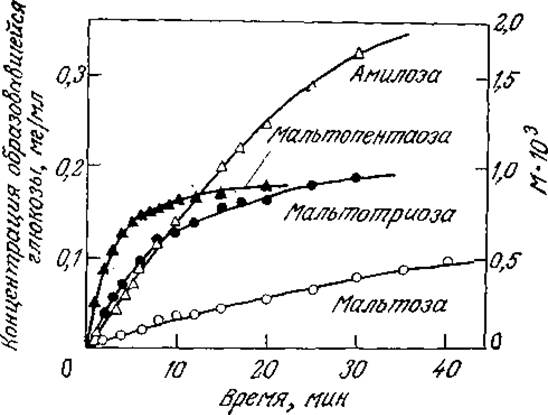
РИС. 3.18. Кривые зависимости скорости ферментативного гидролиза олигомеров и полимеров глюкозы под действием амилоглюкозидазы от времени (15 °С; pH 5,15; s0 = 0,04 М; е0 = 2,82∙10-7 М). [Воспроизведено из работы: Ono S., et al., Kinetic Studies of Gluc-amylase; J. Biochem. (Tokyo), 55, 315 (1964).]
Для некоторых гидролитических ферментов характерна селективность в отношении различных участков цепи биополимера. Так, экзоферменты расщепляют концевые (или близкие к концевым) связи цепи, а эндогидролазы катализируют гидролиз внутренних связей цепей. При описании кинетики таких систем важно учитывать оба типа ферментативных реакций, а также «концентрации» концевых и внутренних связей в смеси биополимеров. С таким подходом мы встретимся в следующей главе при изучении ферментативного гидролиза целлюлозы.
Ниже мы рассмотрим один простой, но показательный пример, иллюстрирующий некоторые типичные затруднения, которые встречаются при описании кинетики ферментативных реакций со смесями субстратов. Пусть последовательности реакций (3.41) и (3.42) отражают взаимодействие двух различных субстратов с одним и тем же ферментом:
![]()
Медленные стадии:
![]()
Здесь подразумевается, что каждый субстрат связывает какую-то часть фермента. Если мы далее, как и в наших предыдущих анализах кинетики ферментативных реакций, используем уравнение общего материального баланса фермента и условия равновесия, то получим следующие выражения для скоростей реакций:
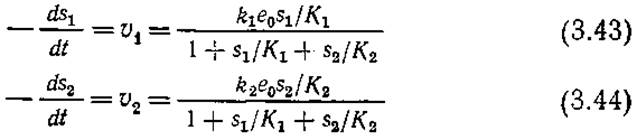
Из уравнений (3.43) и (3.44) следует, что если две реакции катализируются одним и тем же ферментом, то скорости индивидуальных реакций в присутствии двух субстратов ниже, чем в присутствии только одного субстрата. Этот факт успешно использовался для идентификации ферментных препаратов; действительно, таким путем можно выяснить, действует ли на оба субстрата один и тот же фермент или же реакция каждого субстрата катализируется своим ферментом.
В экспериментах и в технологических процессах обычно трудно или даже невозможно определять и контролировать концентрации всех компонентов реакционной смеси. Например, изображенные на рис. 3.18 кривые отражают ход многих одновременно протекающих реакций, в том числе гидролиза мальтозы, мальтотриозы и т. д. Другими словами, в действительности изучают не индивидуальную реакцию, а некоторую гипотетическую общую реакцию превращения полимеров глюкозы в мономерную глюкозу под действием фермента амилоглюкозидазы:
![]()
В этой реакции все субстраты, построенные из остатков глюкозы, объединены в некий воображаемый единый субстрат, концентрация которого может быть определена сравнительно легко. Такого типа усреднение субстратов широко применяется во всех областях химической кинетики. Рассмотрим, например, каталитический крекинг газойля. В проектных разработках или при анализе работы реактора этот процесс для удобства часто изображают в виде следующей двустадийной реакции:
![]()
хотя в данном случае каждый из реагентов, очевидно, представляет собой смесь соединений. В научно-технической литературе по биологии и биохимической технологии при изучении и моделировании биологических реакций, а также при проектировании соответствующих технологических процессов подобные усреднения, хотя и далеко не всегда столь очевидные, встречаются сплошь и рядом. В нашей книге мы постараемся тщательно анализировать обоснованность таких и подобных упрощений, применяющихся (обычно косвенным образом) при описании биологических систем. Неоправданные упрощения могут привести к серьезным ошибкам как в теоретических исследованиях, так и в проектных разработках.
Приведем пример одной из таких ошибок. Предположим, что sT представляет собой общую концентрацию всех субстратов в смеси:
![]()
Тогда суммарная скорость превращения vT будет определяться выражением
![]()
Очевидно, что скорость vT зависит от отношения величин s1 и s2. Например, если суммарная концентрация субстрата имеет определенную величину sT0, то суммарная скорость vT в общем случае не имеет определенного значения, а в зависимости от отношения s1/s2 может изменяться в следующих пределах:
![]()
Отсюда следует, что определенные экспериментальным путем кинетические параметры vmax и Kmбудут зависеть как от состава смеси (отношения s1/s2), так и от общей концентрации субстрата sT. Точно так же параметры работы ферментативного реактора будут изменяться при изменении относительных количеств субстратов S1 и S2, даже если общая концентрация вводимых в реактор реагентов будет поддерживаться па постоянном уровне.