Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Регуляция ферментативной активности
Анализ влияния обратимой регуляции на кинетику ферментативных реакций
Основная ценность подхода Михаэлиса и Ментен к анализу кинетики ферментативных реакций заключается в том, что он позволяет количественно описать влияние эффекторов. Прежде всего допустим, что приведенная ниже последовательность реакций достаточно точно отражает механизм взаимодействия
ингибитора и субстрата с ферментом при (полном) конкурентном ингибировании. Здесь, как обычно, Е и S обозначают фермент и субстрат соответственно, а символами I и ЕІ обозначены ингибитор и фермент-ингибиторный комплекс соответственно.
Равновесные стадии реакции:

Медленная стадия:
![]()
В этом случае фермент может связывать или только субстрат, или только ингибитор. Поскольку часть фермента связана в комплексе ЕІ, не весь фермент участвует в каталитическом превращении субстрата; следовательно, скорость реакции в присутствии ингибитора замедляется.
На базе равновесных реакций (3.48) и уравнения общего материального баланса фермента
е + (es) + (ei) = е0 (3.50)
скорость реакции можно выразить через общую концентрацию фермента е0 и концентрации свободного субстрата и ингибитора (s и і соответственно):
![]() (полное) конкурентное ингибирование (3.51)
(полное) конкурентное ингибирование (3.51)
Сравнение с исходной формой уравнения Михаэлиса — Ментен показывает, что параметр vmax остался без изменений, а кажущаяся константа Михаэлиса Кmарр в присутствии конкурентного ингибитора возрастает:
![]()
Другими словами, обусловленное конкурентным ингибитором снижение скорости реакции может быть полностью компенсировано путем соответствующего повышения концентрации субстрата; на максимально возможную скорость реакции конкурентный ингибитор не влияет.
Если последовательные реакции (3.48) и (3.49) дополнить равновесными реакциями (3.53а) и (3.536), то можно получить полезную модель (полного) неконкурентного ингибирования:

Здесь ингибитор и субстрат могут одновременно связываться с ферментом, образуя тройной комплекс EIS (фермент-ингибитор-субстратный). В этой простейшей модели неконкурентного, ингибирования мы принимаем, что связывание ингибитора не влияет на сродство фермента к субстрату, а связывание субстрата не сказывается на сродстве фермента к ингибитору. Отсюда следует, что Ksи Ki в уравнениях (3.53) идентичны соответствующим константам диссоциации в уравнении (3.48). Примем также, что комплекс EIS не диссоциирует с образованием продукта реакции Р.
Используя уже известный нам прием выражения концентраций комплексов через e0, s и i, можно получить следующее выражение для скорости реакции:
![]() (полное) неконкурентное ингибирование (3.54)
(полное) неконкурентное ингибирование (3.54)
Нетрудно заметить, что в этом выражении константа Михаэлиса осталась без изменений, а максимальная скорость реакции снизилась до
![]()
Отсюда следует, что в присутствии неконкурентного ингибитора добавление к реакционной смеси сколь угодно большого количества субстрата не позволит повысить максимальную скорость реакции до той величины, которая может быть достигнута в отсутствие ингибитора.
Конкурентное и неконкурентное ингибирование легко различить по графикам зависимостей кинетических параметров в координатах Лайнуивера — Бэрка. В случае конкурентного ингибирования добавление ингибитора приводит к увеличению отрезка, отсекаемого прямой на оси 1/s, и не влияет на отрезок, отсекаемый на оси 1/v. Напротив, при неконкурентном ингибировании возрастает только отрезок, отсекаемый на оси 1/v. Рассмотрим в качестве примера приведенные на рис. 3.21 данные по гидролизу крахмала. Сравнивая графики зависимостей 1/v от 1/s в присутствии различных ингибиторов, а также без ингибитора, нетрудно видеть, что а-декстрин является конкурентным ингибитором, a мальтоза и предельный декстрин представляют собой неконкурентные ингибиторы.
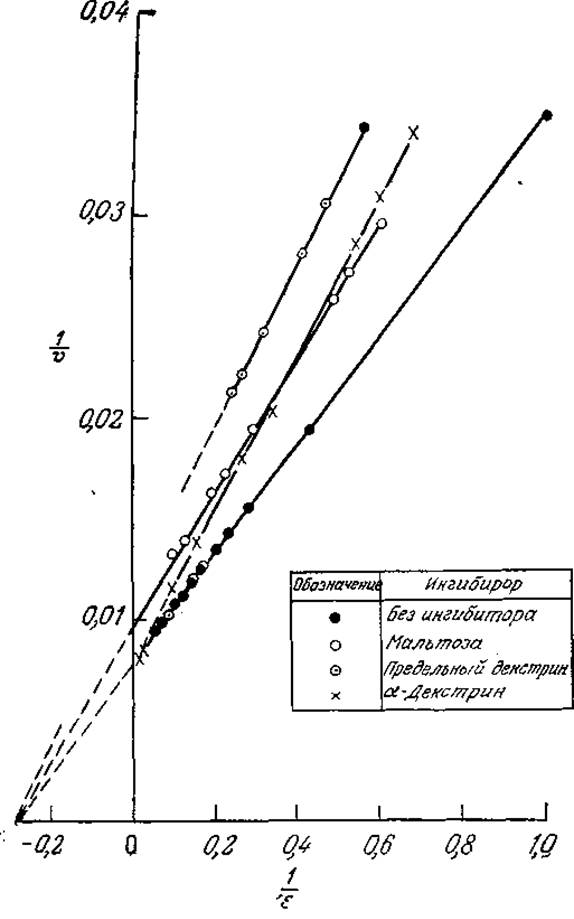
РИС. 3.21. Конкурентное (а-декстрин) и неконкурентное (мальтоза, предельный декстрин) ингибирование а-амилазы. (Воспроизведено с разрешения из работы: Aiba S., Humphrey А. Е., Millis N., Biochemical Engineering, 2d ed., p. 101, University of Tokyo Press, Tokyo, 1974; есть перевод 1-го издания; Аиба Ш., Хемфри А., Миллис Н., Биохимическая технология и аппаратура. — М.: Пищевая промышленность, 1975, с. 81.
Как мы указывали в табл. 3.7, существуют и другие типы ингибирования ферментативных реакций. Ниже мы в нескольких словах обсудим, как можно их описать путем видоизменения рассмотренных выше моделей ингибирования. При частичном конкурентном ингибировании (тип 16 в табл. 3.7) ингибитор и субстрат соединяются с различными участками молекулы фермента и ингибитор влияет на сродство фермента к субстрату. Чтобы описать этот случай, добавим к последовательности
реакций (3.48) и (3.49) следующие стадии, которые мы будем считать равновесными:
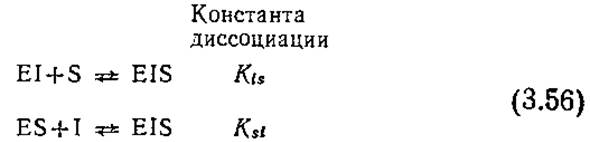
и медленную стадию:
![]()
(Обратите внимание: можно показать, что Kis = KsKsi/Ki.)
В другом случае неконкурентного ингибирования (типа IIб) описанная выше модель видоизменяется с учетом возможности образования продукта реакции из комплекса EIS; диссоциация последнего по сравнению с комплексом ES протекает с меньшей скоростью:
![]()
Одну из моделей смешанного ингибирования, включающего в себя полный конкурентный и частично конкурентный типы, можно получить, опустив реакцию (3.57) в приведенной выше модели частичного конкурентного ингибирования. Результаты анализа всех этих типов ингибирования можно записать в форме уравнения Михаэлиса — Ментен:
![]()
В этом уравнении кажущиеся параметры vmахарр и Кmарр зависят от концентрации ингибитора и различных кинетических параметров (табл. 3.8). На рис. 3.22 схематически показано влияние разных типов ингибирования на различные формы графического выражения данных по изучению кинетики ферментативных реакций.
Один из типов активации фермента эффектором может быть описан моделью типа IIб при условии, что kiбольше k. С точки зрения механизма процесса это означает, что скорость образования продукта реакции из комплекса EIS выше, чем из комплекса ES. Таким образом, здесь вещество I выполняет функцию активатора фермента.