Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Другие факторы, влияющие на ферментативную активность
Прежде чем приступить к изложению темы этого раздела, полезно напомнить, что основная цель настоящей главы заключается в описании скорости катализируемых ферментами реакций с помощью математических выражений. Без последних мы не сможем разработать проект реактора или спланировать эксперимент с участием изолированных ферментов. Более того, когда мы приступим к изучению кинетики клеточного роста, мы узнаем, что и здесь приложимы различные аспекты кинетики ферментативного катализа. В этой связи становится очевидной важность тщательного изучения различных факторов, влияющих на ферментативный катализ, в том числе количественной оценки степени их влияния.
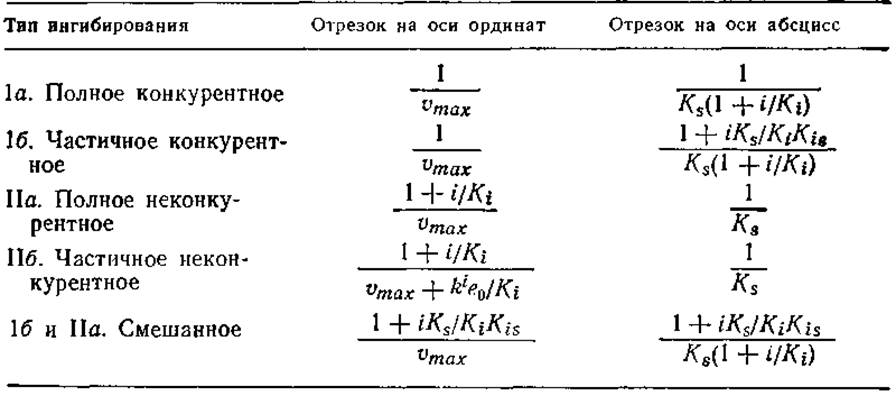
Таблица 3.8. Параметры кинетики ферментативных реакций в присутствии ингибиторов различных типов; отрезки, отсекаемые прямыми на осях 1/v и 1/s
Мы уже знаем, что различные химические соединения, связываясь с ферментами, могут изменять скорость катализируемых ферментами реакций, и в общих чертах представляем, как это происходит. На каталитическую активность ферментов влияют и многие другие факторы, которые могут изменять строение или химическую природу фермента. К числу таких факторов относятся:
1. pH
2. Температура
3. Силы, действующие в текучих средах (гидродинамические силы, гидростатическое давление и поверхностное натяжение)
4. Химические агенты (например, спирт, мочевина или пероксид водорода)
5. Облучение (свет, звук, ионизирующая радиация)
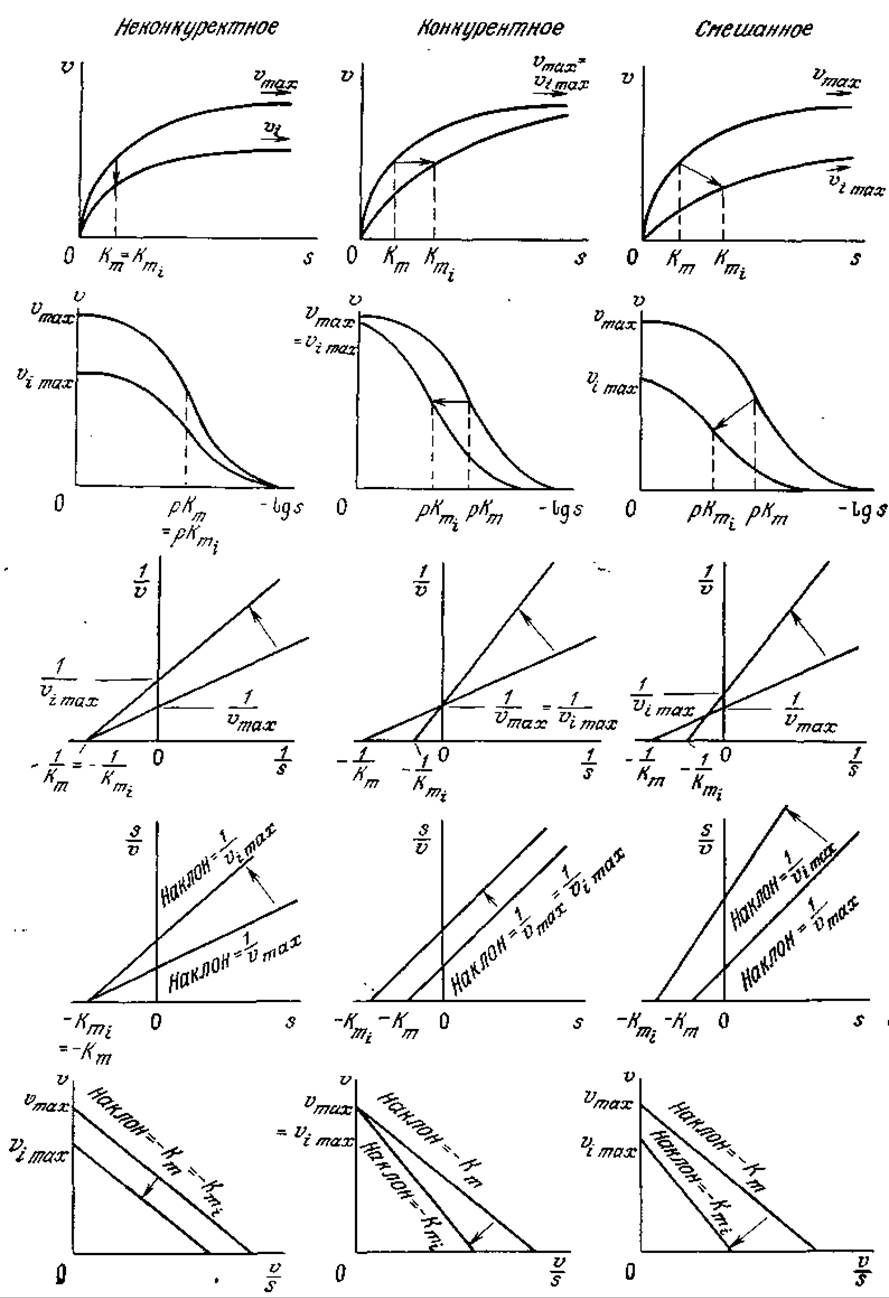
РИС. 3.22. Влияние типа ингибирования на различные формы графического выражения кинетики ферментативных реакций. Индексом і обозначены параметры реакции в присутствии ингибитора, (Из работы: Диксон М., Уэбб Э., Ферменты, т, 2, с. 498, — М.: Мир, 1982,]
Иногда снижение каталитической активности, вызванное, например изменением pH, обратимо; в таких случаях возврат к первоначальным условиям сопровождается восстановлением активности фермента. В известном смысле такая ситуация аналогична рассмотренному случаю обратимого ингибирования; небольшие изменения одного из перечисленных выше факторов, по сути дела, только слегка сдвигают равновесие (или квази-стационарное состояние), характерное для данной ферментативной реакции. В общем случае отклонение от условий, типичных для биологического окружения нативного фермента, должно быть относительно небольшим (или кратковременным); в противном случае возрастает вероятность инактивации фермента. Многие из перечисленных выше факторов мы обсудим в следующем разделе, посвященном инактивации ферментов, здесь же основное внимание будет уделено «обратимому» влиянию pH и температуры на каталитическую активность ферментов.
Следует подчеркнуть, что граница между «обратимой» и «необратимой» инактивацией белков не всегда четко определена. Например, подвергнутый кратковременному нагреванию фермент при охлаждении до свойственной ему «рабочей» температуры может полностью восстановить свою активность. С другой стороны, более продолжительное нагревание при той же температуре или столь же кратковременная термическая обработка при более высокой температуре могут привести к тому, что при последующем охлаждении активность фермента восстановится лишь частично. Такое поведение белков вообще и ферментов в частности становится понятным, если учесть связь между их строением и функцией, влияние молекулярной динамики на функцию белков и возможность разрыва некоторых слабых связей при изменении условий среды.