Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Инактивация ферментов
Механизмы денатурации белков и сопутствующие эффекты
Как мы уже знаем, структура белков стабилизуется за счет слабых взаимодействий; таким путем обеспечивается функционально важная молекулярная подвижность. С другой стороны, слабость стабилизирующих сил предполагает, что с энергетической точки зрения белки могут сравнительно легко принимать несколько альтернативных и биологически менее активных конформаций. Иллюстрацией этого свойства белков могут служить приведенные на рис. 3.26 термодинамические характеристики различных состояний а-лактальбумина. Нетрудно видеть, что разность свободных энергий нативного и полностью денатурированного состояний этого белка составляет всего лишь 9,0 ккал/моль (хотя переход из одной конформации в другую может потребовать преодоления более значительных энергетических барьеров переходных состояний). Поэтому приходится признать, что стабильность нативной структуры белков крайне низка.
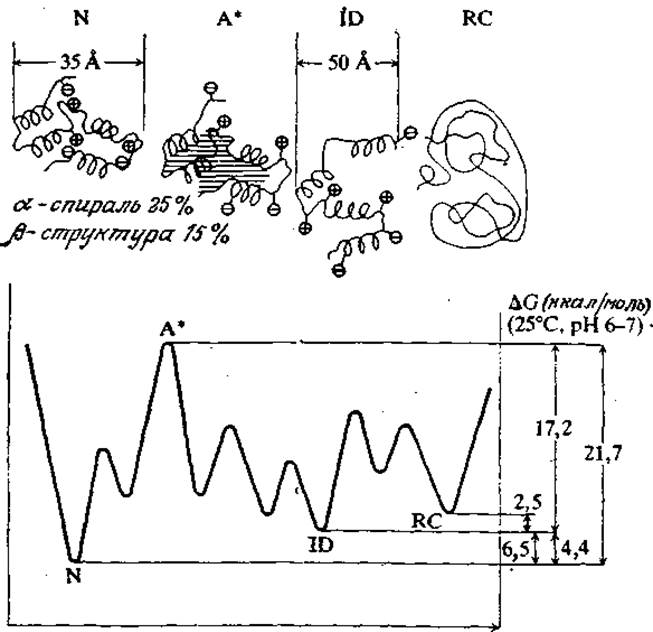
РИС. 3.26. Схематичное изображение ступенчатого разворачивания белковой молекулы а-лактальбумина и соответствующие термодинамические данные. [Воспроизведено с разрешения из статьи: Kuwajima К., A Folding Model of a-Lactalbumin Deduced from the Three-state Denaturation Mechanism; J. Molec. Biol, 114, 241 (1977).]
Обозначения: N — нативная конформация; A* — критически активированное состояние; ID — частично неупорядоченная конформация; RC — неупорядоченный клубок (полностью денатурированное состояние).
В этой связи неудивительно, что сопровождающиеся снижением активности нарушения природной геометрической и химической структуры белков могут быть вызваны множеством физических и химических факторов (табл. 3.9). Установив индивидуальные факторы, обусловливающие денатурацию белков, следует в то же время учитывать, что скорость денатураций белков определяется не каждым из этих факторов в отдельности, а их сочетанием. Например, склонность белка к денатурации при повышенных температурах может изменяться в очень широких пределах в зависимости от pH раствора, а совместное влияние определенных pH и температуры на белок в очень большой степени зависит от его природы.
Можно указать целый ряд различных, но часто взаимосвязанных свойств белков, которые изменяются под воздействием перечисленных в табл. 3.9 физико-химических факторов. К внешним проявлениям денатурации белков относится изменение таких их свойств, как растворимость, тенденция к образованию гелей или к кристаллизации, а также нарушение биологической активности (каталитической активности, способности связывать антитела) растворов белков. Точно так же, как при денатурации важно прежде всего совместное действие различных факторов, так и в сопровождающих денатурацию эффектах главнейшую роль играет не каждый эффект в отдельности, а их комбинация. Например, если фермент выделяют осаждением, то существенно, чтобы условия осаждения не вызывали необратимой потери активности фермента.