Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Применение реакций, катализируемых ферментами
Технологические процессы с участием иммобилизованных ферментов
Иммобилизация ферментов
Существует много методов иммобилизации ферментов. Как мы увидим ниже, от метода иммобилизации во многом зависят и свойства полученного биокатализатора. Таким образом, выбор конкретного способа иммобилизации зависит от целого ряда факторов и параметров каталитического процесса, в том числе от общей каталитической активности, эффективности использования катализатора, его способности подвергаться инактивации и регенерации и, конечно, от его цены. В связи с проблемой захоронения отходов производства, а также в зависимости от предполагаемой области использования получаемых продуктов следует принимать во внимание и токсичность реагентов, применяемых в реакциях синтеза иммобилизованных ферментов.
Все методы иммобилизации ферментов можно разделить на две группы: химические методы, основанные на создании ковалентных связей между ферментом и носителем, и физические методы, основанные на более слабых взаимодействиях или на включении ферментов в какую-либо оболочку или матрицу (рис. 4.5). Ферменты можно превратить в иммобилизованную форму посредством адсорбции на различных носителях (табл. 4.9); целесообразность применения этого метода иммобилизации обусловлена тем обстоятельством, что в ряде случаев катализатор удается сравнительно просто регенерировать путем десорбции отработанного фермента и адсорбции новой порции активного биокатализатора. Свойства иммобилизованного фермента определяются как свойствами фермента, так и характеристиками носителя или матрицы и методикой иммобилизации.
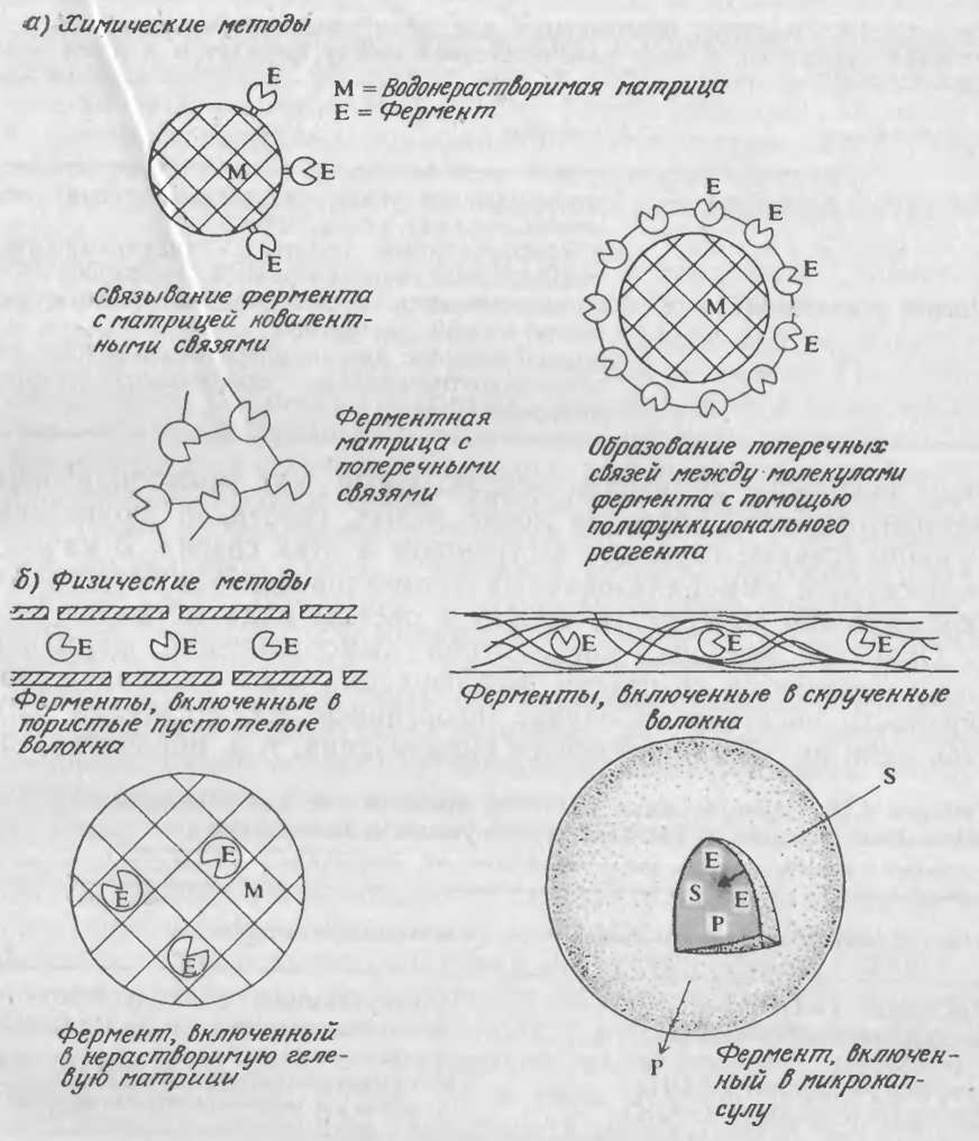
РИС. 4.5. Некоторые методы иммобилизации ферментов: химические (а); физические (б).
Выбор носителя для химической или адсорбционной иммобилизации фермента зависит прежде всего от свойств его поверхности. Способен ли фермент адсорбироваться на этой поверхности? Есть ли у носителя функциональные группы, связывающие фермент? Если поверхность носителя не удовлетворительна в этом отношении, то можно ли химически модифицировать или иным образом трансформировать поверхность носителя, чтобы облегчить связывание фермента? В табл. 4.10 перечленены некоторые носители, используемые для иммобилизации ферментов путем создания ковалентных связей, и приведены функциональные группы, участвующие в этих связях. В качестве носителей иммобилизованных ферментов применяются также керамические материалы, стекло и оксиды ряда металлов.
Таблица 4.9. Носители, применяемые для иммобилизации ферментов методом адсорбции, и типы взаимодействий между ферментом и носителем
Взаимодействие |
Адсорбенты |
Физическая адсорбция |
Активированный уголь, силикагель, оксид алюминия, крахмал, глина, стекло Модифицированные носители: таннинаминогексилцеллюлоза, конканавалин А — сефароза |
Ионное связывание |
Катионообменники: карбоксиметилцеллюлоза, амберлит CG-50, дауэкс 50 Анионообменники: диэтиламиноэтилцеллюлоза, диэтиламиноэтилсефадекс, полиаминополистирол, амберлит IR-45 |
Описание методики ковалентной иммобилизации фермента часто начинается со стадии модификации или активации поверхности носителя. В случае неорганических носителей для этой цели широко применяется силанизация, т. е. обработка поверхности кремнийорганическими реагентами (например, (CH3CH2O)3Si (CH2)3R, где R чаще всего NH2). Обработанный таким способом носитель содержит на поверхности аминогруппы, которые (как и аминогруппы других носителей) можно перевести в альдегидные группы конденсацией с глутаровым альдегидом или в ариламинные группы с помощью n-нитробензоил-хлорида, или в карбоксильные группы конденсацией с янтарным ангидридом. Другой способ модификации поверхности носителей основан на введении гибких, сравнительно длинных цепей (например, остатка n-пропиламина). Ввиду отсутствия пространственных препятствий последующее присоединение фермента к этим гибким группировкам позволяет в основном сохранить нативную структуру фермента, что в свою очередь способствует сохранению и стабилизации его каталитической активности. С помощью подобных модификаций можно также изменять гидрофобность или гидрофильность поверхности носителя.
Таблица 4.10. Нерастворимые носители, применяемые для ковалентного связывания ферментов (указаны участвующие в связывании функциональные группы, расположенные на поверхности носителей)
Носители природного происхождения |
Синтетические носители |
Целлюлоза (—ОН) Карбоксиметилцеллюлоза (—СООН) Агароза (сефароза) (—ОН) Декстран (сефадекс) (—ОН) |
Полиакриламиды и их производные (биогель, энзакрил и др.) (ароматические аминогруппы) Полиаминополистирол (—NH2) Сополимеры малеинового ангидрида |
На рис. 4.6 суммированы типичные реакции иммобилизации ферментов с участием функциональных групп на поверхности носителей, в том числе перечисленных в табл. 4.10. Следует отметить, что каждая из указанных реакций протекает только в строго определенных условиях, в частности при заданных величинах pH, ионной силы и концентраций реагентов. Подробные сведения об условиях конкретных реакций, в том числе обширные табличные данные о различных методах иммобилизации ферментов на различных носителях, можно найти в литературе, приведенной в конце главы. Химическая природа функциональных групп на поверхности носителя определяет и функциональные группировки белка, с участием которых он образует ковалентные связи. Благодаря наличию достаточно большого числа методов поверхностной модификации носителей иммобилизацию какого-либо определенного фермента на конкретном носителе обычно можно осуществить несколькими способами. Конденсация фермента с носителем, очевидно, не должна затрагивать аминокислотные остатки, входящие в активный центр фермента или расположенные вблизи него.
Решая вопрос о выборе носителя и способе модификации его свойств, нельзя забывать и о взаимодействиях между поверхностью носителя и реакционной смесью, благодаря которым непосредственно примыкающие к носителю, а следовательно, и к ферменту слои реакционной смеси могут существенно отличаться по своим свойствам от основного объема реакционной смеси. Например, вокруг частиц носителя с ионизированными группами образуется зона с повышенной концентрацией противоположно заряженных ионов, что в свою очередь приводит к существенному изменению зависимости наблюдаемой каталитической активности от pH жидкой фазы в сравнении с аналогичной зависимостью для ферментативной реакции в растворе (рис. 4.7). Аналогично гидрофобные или гидрофильные свойства носителя будут влиять на локальные концентрации растворенных веществ и растворителей в соответствии с их гидрофобностью (или. гидрофильностью).
Другая важная функция поверхности носителя связана с ее прямым или косвенным влиянием на молекулярное окружение фермента. В какой-то степени фермент всегда взаимодействует с поверхностью носителя на молекулярном уровне и в то же время контактирует с реакционной средой, на которую так же, как только что было показано, влияет носитель. Молекула фермента построена таким образом, что она принимает определенную конформацию и проявляет соответствующую активность только в свойственной ей природной среде. Очевидно, что путем подбора носителя для иммобилизации фермента можно попытаться как сохранить свойственное данному ферменту окружение, так и направленно изменить его с тем, чтобы повлиять на активность, а также на селективность и стабильность фермента. В настоящее время большое внимание уделяется изучению взаимодействий ферментов с их окружением на молекулярном уровне и выяснению возможности использования таких взаимодействий для углубления наших знаний о поведении ферментов в природных условиях и для оптимизации соответствующих биокаталитических процессов.
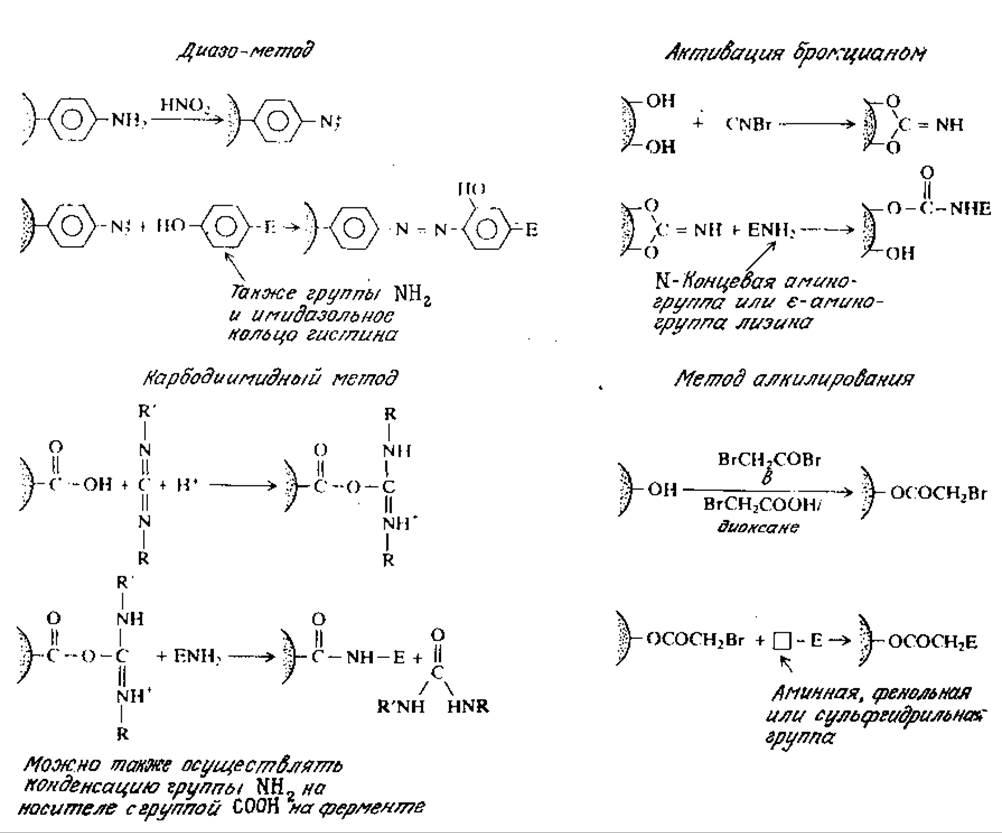
РИС. 4.6. Некоторые методы ковалентного связывания ферментов с носителями (Е — фермент).
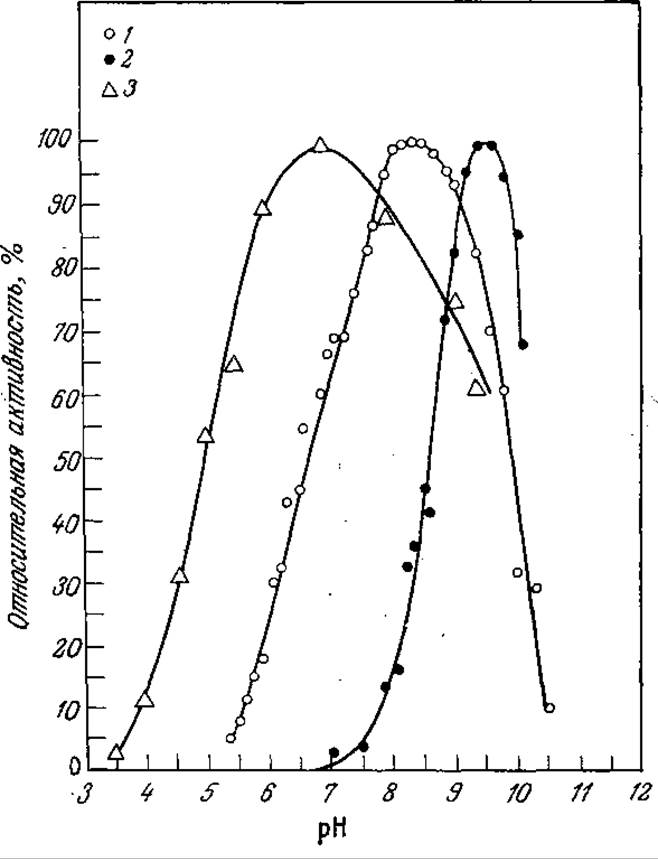
РИС. 4.7. Различные зависимости каталитической активности от pH свободного фермента и фермента, иммобилизованного на ионизированном носителе. Субстратом является этиловый эфир ацетил-L-тирозина. [Воспроизведено с разрешения из статьи: Goldstein L. et al., A Water-Insoluble Polyanionic Derivative of Trypsin. II Effect of the Polyelectrolyte Carrier on the Kinetic Behavior of Bound Trypsin, Biochemistry, 3, 1913 (1964). (C) American Chemical Society.] 1 — химотрипсин (свободный); 2 — ЕМА-химотрипсин (иммобилизованный на отрицательно заряженном носителе — сополимере этилена с метакриловой кислотой); 3 — полиорнитилхимотрипсин (иммобилизованный на положительно заряженном носителе).
На активность и другие параметры иммобилизованного фермента оказывают влияние также физические и механические свойства носителя. Пористость носителя и распределение пор по размерам определяют количество фермента, которое может быть иммобилизовано на этом носителе, и доступность субстрата для молекул фермента, связанных с внутренними поверхностями. Механическая прочность носителя в существенной степени влияет на возможность его использования в реакторах определенных конструкций. Например, в реакторе с перемешиваемой взвесью твердого катализатора нецелесообразно использовать носители, склонные к механическому истиранию, а легко сжимаемые материалы нельзя применять в насадочных колоннах крупномасштабных производств. Важна и способность носителя к набуханию. Другие сведения о физических свойствах различных носителей, а также о способах их изучения можно найти в приведенной в конце главы литературе.
Для создания ковалентных связей между молекулами ферментов можно использовать некоторые реагенты, содержащие две (или более) функциональные группы. Из таких реагентов чаще всего применяют глутаровый альдегид, образующий межмолекулярные (и, возможно, внутримолекулярные) связи с участием аминогрупп фермента:
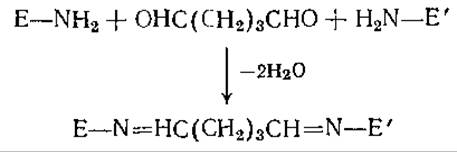
В качестве бифункциональных реагентов используют также, бис-диазобензидин, цианурхлорид и гексаметилендиизоцианат. Сшитые поперечными связями ферменты обычно представляют собой желатинообразную массу, механические свойства которой не отвечают требованиям большинства процессов. Как показано на рис. 4.5, адсорбция фермента на носителе и последующая его сшивка бифункциональными реагентами способствуют улучшению механических свойств катализатора и облегчают доступ субстрата к ферменту.
Метод иммобилизации фермента путем его включения выгодно отличается относительной независимостью от природы фермента (и, следовательно, возможностью применения одной методики для иммобилизации различных ферментов), а также сравнительно небольшими нарушениями нативной структуры фермента. Методы включения можно разделить на две группы: к первой группе относят методы, основанные на включении фермента в полимерную матрицу, а ко второй — методы, в которых раствор фермента отделяют мембраной, проницаемой для субстратов и (или) продуктов реакции, но непроницаемой для фермента.
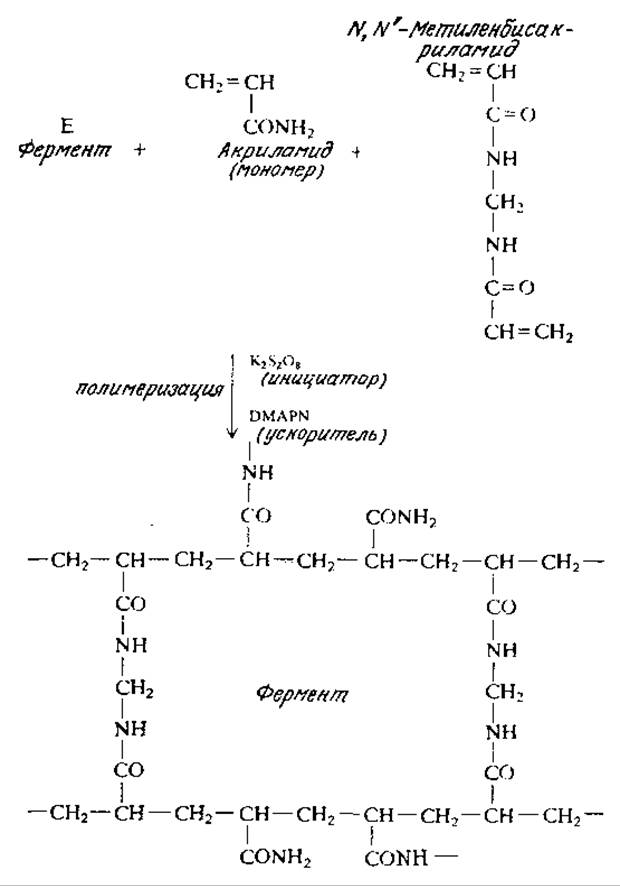
РИС. 4.8. Метод иммобилизации фермента путем его включения в полимер. В данном случае полимерная матрица представляет собой полиакриламид, сшитый поперечными связями.
Чаще всего фермент иммобилизуют в трехмерной полимерной решетке полиакриламидного геля путем полимеризации акриламида в присутствии сшивающих мономеров и фермента (Е) (рис. 4.8). Как указано на рисунке, инициатором полимеризации может быть персульфат калия (K2S2O8), а ее ускорителем — ß-диметиламинопропионитрил (DMAPN). Сообщалось, что с помощью этих реагентов можно получать гели иммобилизованных ферментов с диаметром пор от 100 до 400 нм, которые надежно удерживают многие ферменты, имеющие обычно диаметр- молекул от 300 до 2000 нм.
В альтернативном способе иммобилизации раствор фермента отделяют мембраной таким образом, чтобы фермент постоянно находился в объеме, ограниченном этой полупроницаемой мембраной. Биологическим прототипом этого метода иммобилизации являются лизосомы, в которых сконцентрированы гидролитические ферменты, вызывающие при попадании в цитоплазму мгновенную гибель клетки. В одном из вариантов этого способа, называемом микрокапcулированием, ферменты заключают в крохотные капсулы диаметром до 300 мкм. Капсулы заключены в сферические мембраны с порами, через которые в любом направлении могут транспортироваться небольшие молекулы субстратов и продуктов реакции и в то же время не могут проникать ферменты и другие высокомолекулярные соединения.
Известны два метода изготовления полупроницаемых микрокапсул. В первом методе формируют постоянную полимерную мембрану. Для этой цели на границе раздела двух фаз — органической и водной, содержащей фермент, проводят реакцию сополимеризации. Если в качестве одного из реагентов взять водонерастворимый мономер, а в качестве другого — мономер, обладающий заметной растворимостью в той и другой фазах, то их сополимеризация будет осуществляться только вблизи границы раздела фаз. Устойчивые полимерные микрокапсулы, можно получить также путем коацервации, т. е. посредством, выделения из раствора полимера в виде микрокапель новой, жидкой фазы, обогащенной полимером. Неустойчивые микрокапсулы получают путем эмульгирования водного раствора фермента в присутствии поверхностно-активного вещества; при этом образуются капсулы, заключенные в мембрану из поверхностно-активного вещества, которые можно затем добавлять к. водному раствору субстрата.
Оба метода микрокапсулирования выгодно отличаются высокой удельной поверхностью катализатора (характерная величина составляет 2500 см2 на 1 мл суспензии фермента) и возможностью повышения специфичности — иногда удается изготовить мембраны, селективно пропускающие одни субстраты и задерживающие другие. В принципе эти методы применимы к любым ферментам. В то же время мембрана представляет собой определенное препятствие для массопередачи, поэтому «коэффициент эффективности» заключенных в микрокапсулу ферментов, может быть очень низким. Кроме того, эти методы вообще неприменимы, если размеры молекулы субстрата сравнимы с размерами молекулы фермента.
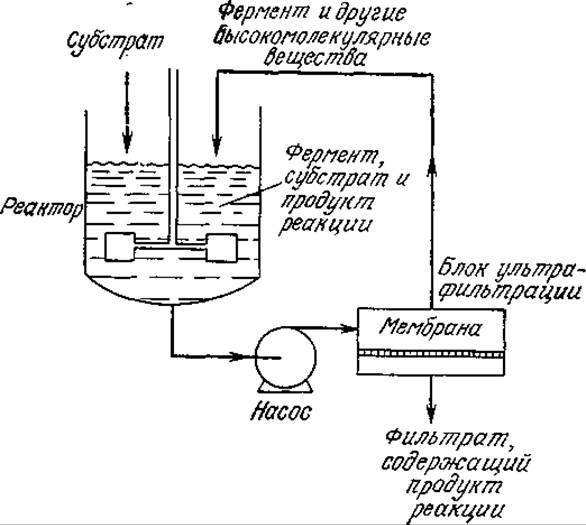
РИС. 4.9. Локализация фермента в масштабе всего реактора. Полупроницаемая мембрана удерживает фермент и другие высокомолекулярные соединения в реакторе.
Для иммобилизации ферментов можно использовать и устройства, основанные на ультрафильтрации через полупроницаемые мембраны, которые не мешают обмену молекулами небольшого диаметра между раствором фермента и соседним раствором. На рис. 4.9 изображена принципиальная схема непрерывной ультрафильтрации, где, как и в случае микрокапсулирования, фермент удерживается в определенном объеме. В то же время в отличие от метода микрокапсулирования в этом случае площадь поверхности, разделяющей два раствора, невелика, и к тому же здесь возникает опасность индуцированной потоком денатурации фермента. Скорость массообмена через мембрану довольно низка, что может лимитировать скорость всего процесса. К преимуществам метода иммобилизации ферментов с помощью полупроницаемых мембран можно отнести возможность применения практически любого фермента и смесей любых ферментов, а также высокомолекулярных или нерастворимых субстратов (по отношению к которым связанные с полимерными носителями ферменты обычно малоэффективны). Кроме того, в реакциях гидролиза полимеров через полупроницаемые мембраны проникают только низкомолекулярные соединения, а все вещества с относительно большой молекулярной массой остаются в растворе фермента. На этом принципе основан интересный метод регулирования молекулярно-массового распределения продуктов реакции на выходе из реактора. Изучен целый ряд вариантов принципиальной схемы, изображенной на рис. 4.9. Так, вместо реактора с перемешиванием можно использовать трубчатый реактор. Блок с одной полупроницаемой мембраной можно заменить на устройство с множеством параллельных пустотелых нитей, в котором один поток, направляется во внутреннюю полость нитей, а другой — в омывающий нити объем. Процесс ультрафильтрации и его количественную трактовку мы рассмотрим подробнее в гл. 11.
Таблица 4.11. Сравнение основных характеристик различных методов иммобилизации ферментова
|
Метод связывания с носителем |
|||||
Характеристики |
Физическая адсорбция |
Ионное связывание |
Ковалентное связывание |
Сшивка бифункциональными реагентами |
Методы включения |
Методика иммобилизации |
Простая |
Простая |
Сложная |
Сложная |
Сложная |
Ферментативная активность |
Низкая |
Высокая |
Высокая |
Умеренная |
Высокая |
Субстратная специфичность |
Не изменяется |
Не изменяется |
Может изменяться |
Может изменяться |
Не изменяется |
Связывающие силы |
Слабые |
Умеренные |
Сильные |
Сильные |
Сильные |
Регенерация |
Возможна |
Возможна |
Невозможна |
Невозможна |
Невозможна |
Область применения |
Узкая |
Умеренная |
Умеренная |
Узкая |
Широкая |
Стоимость процесса иммобилизации |
Низкая |
Низкая |
Высокая |
Умеренная |
Низкая |
а Воспроизведено с разрешения из работы: Immobilized Enzymes, Research anc Development, Chibata I. (ed.), p. 72, Kodansha Ltd., Tokyo, 1978.
Важнейшие характеристики различных методов иммобилизации ферментов суммированы в табл. 4.11. Здесь под «ферментативной активностью» понимается собственная каталитическая активность иммобилизованных ферментов по отношению к активности тех же ферментов в растворе. В общем случае методы химической иммобилизации снижают активность ферментов, поскольку создающиеся в процессе иммобилизации ковалентные связи могут в какой-то мере нарушать третичную структуру, свойственную нативным белкам. С другой стороны, ковалентные связи обеспечивают надежное, прочное связывание фермента.
а иногда снижают скорость его инактивации и изменяют специфичность в нужном направлении. Иммобилизация ферментов путем их включения или адсорбции обычно в меньшей степени сопровождается нарушением их структуры, и поэтому свойства иммобилизованных такими методами ферментов мало отличаются от их свойств в растворах. В то же время не надо забывать, что все сказанное выше относится только к собственным свойствам ферментов, а на практике в силу эффектов массопередачи соответствующие параметры иммобилизованного фермента могут иметь совершенно другие значения. Этот важный вопрос мы изучим подробнее в разд. 4.4. Диффузионные эффекты обычно сильнее проявляются в случае сшитых поперечными связями и включенных ферментных катализаторов и в меньшей степени — у ферментов, иммобилизованных на носителях.