Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Применение реакций, катализируемых ферментами
Технологические процессы с участием иммобилизованных ферментов
Применение иммобилизованных ферментов в медицине и химическом анализе
В настоящее время известно уже более 120 врожденных метаболических заболеваний человека; многие из этих дефектов связаны с отсутствием активности у какого-либо одного конкретного фермента, имеющегося в организме здоровых людей. Например, фенилкетонурия (болезнь, приводящая к задержке умственного развития), как полагают, вызывается недостатком фермента, превращающего фенилаланин в тирозин. В настоящее время терапевтический способ лечения фенилкетонурии сводится к специальной диете, не содержащей фенилаланина. Альтернативным способом лечения могло бы быть введение недостающего фермента, однако фермент с такой же активностью, выделенный из животных, вызывает резкую иммунологическую реакцию организма человека. Эту проблему, возможно, удастся решить, заключив фермент в микрокапсулы, волокна или гель. Вполне вероятно, что иммобилизованный таким образом фермент уже не вызовет защитной реакции иммунной системы, и в то же время небольшие молекулы субстрата смогут контактировать с ферментом, проникая через стенки микрокапсулы, волокна или гель. Защищенные мембранами ферменты не подвергаются действию антител, но в то же время концентрация биокатализаторов на поверхности природных мембран снижает эффективность массообмена, а следовательно, и скорость утилизации субстрата.
Таблица 4.13. Применение иммобилизованных ферментов в химических процессах и потенциальные сферы их использованияa
Тип катализируемой реакции |
Иммобилизованный фермент |
Область применения |
Окисление-восстановление |
Оксидаза L-аминокислот |
Производство D-амииокислот |
ß-Тирозиназа |
Производство L-дигидроксифенилаланина |
|
Производство L-тирозина |
||
∆1-Гидрогеназа |
Производство преднизолона |
|
Флавопротеиноксидаза |
N-Окисление лекарственных препаратов, содержащих аминные или гидразиновые группы |
|
Миграция групп |
Декстрансукраза |
Производство декстрана |
Фосфорилаза |
Полимеризация глюкозы |
|
Полинуклеотидфосфорилаза |
Получение полинуклеотидов |
|
Карбаматкииаза |
Регенерация АТР |
|
Гидролиз |
Рибонуклеаза |
Синтез тринуклеотидов |
а-Амилаза |
Производство глюкозы |
|
Глюкоамилаза |
Производство глюкозы |
|
Целлюлаза |
Производство глюкозы |
|
Иивертаза |
Производство инвертного сахара |
|
Лейцинаминопептидаза |
Разделение DL-аминокислот на оптические изомеры |
|
Карбоксипептидаза |
Разделение DL-аминокислот на оптические изомеры |
|
Папаин |
Гидролиз казеина |
|
Пенициллинамидаза |
Производство 6-аминопенициллановой кислоты |
|
Синтез пенициллинов и цефалоспоринов |
||
Амииоацилаза |
Разделение DL-аминокислот на оптические антиподы |
|
Аденозинмонофосфат-деаминаза |
Получение 5'-инозиновой кислоты |
|
Лиазные реакции (асимметрический синтез) |
Аспартаза |
Производство L-аспарагиновой кислоты |
Триптофаназа |
Производство L-триптофана |
|
D-Оксииитрилаза |
Производство нитрила D-миндальной кислоты |
|
Изомеризация |
Глюкозоизомераза |
Производство фруктозы |
а Воспроизведено с разрешения из работы: Immobilized Enzymes. Research and Development, Chibata I. (ed.), p. 164, Kodansha, Ltd., Tokyo, 1978.
Вариант изложенного выше подхода был положен в основу одного из предполагаемых проектов компактной искусственной почки. Согласно этому проекту, уреазу и ионообменную смолу или активированный уголь помещают в одну микрокапсулу; образующийся в процессе разложения мочевины аммиак адсорбируется внутри микрокапсулы:
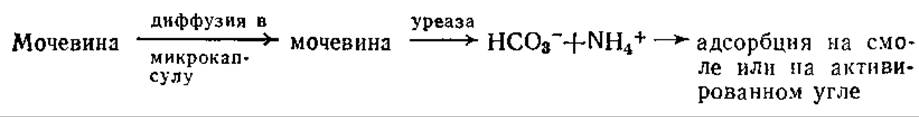
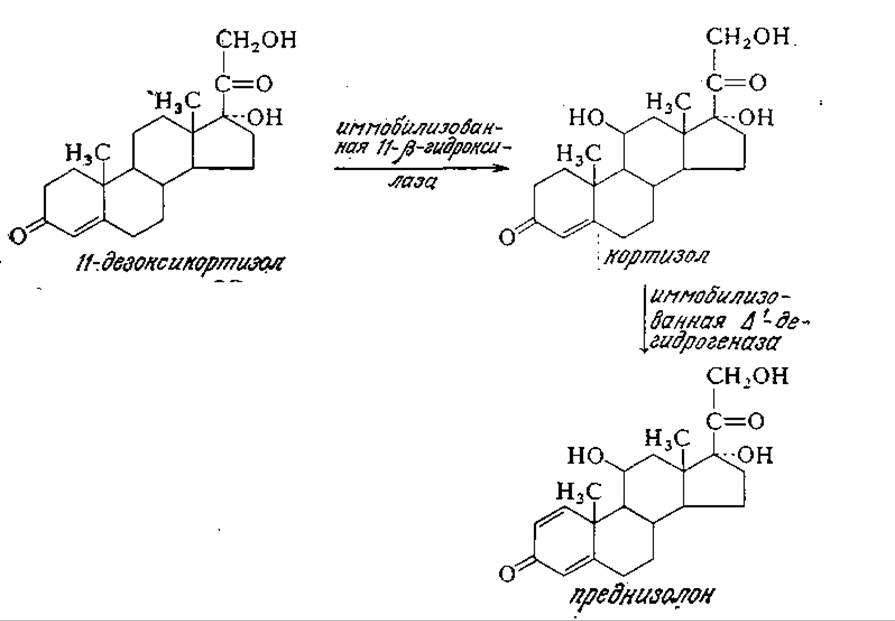
Из попыток применения иммобилизованных ферментов в мелкомасштабном производстве следует отметить их использование для трансформаций стероидов (разд. 2.1.2). Так, например, применяемый при лечении артрита кортизол можно получать из дешевого предшественника 11-дезоксикортизола в колонне с иммобилизованной 11ß-гидроксилазой, затем кортизол можно перевести в еще более ценный лекарственный препарат преднизолон в реакторе со слоем иммобилизованной ∆1-дегидрогеназы. Обратите внимание на чрезвычайно высокую специфичность этих ферментов. В настоящее время подавляющее большинство трансформаций стероидов в промышленном масштабе осуществляют микробиологическим путем.
Иммобилизованные ферменты уже сейчас широко применяются в аналитической биохимии, и сфера их использования в ближайшие годы, безусловно, еще больше расширится. Одним из примеров могут служить электроды с иммобилизованными ферментами, позволяющие осуществлять непрерывный контроль (мониторинг) за низкими концентрациями биохимически важных веществ. Так, в электроде для определения мочевины (рис. 4.13) иммобилизованная уреаза разлагает мочевину на ионы, которые могут быть обнаружены обычными электрохимическими методами. Электроды с иммобилизованными ферментами позволяют, как это показано схематически на рис. 4.14, автоматизировать стандартные биохимические анализы. Такая автоматизированная система может применяться, например, для определения концентраций глюкозы или лактата с помощью иммобилизованной глюкозооксидазы или лактатдегидрогеназы.
На таком же принципе основаны конструкции ферментных электродов, предназначенных для определения многих других биологически важных соединений (табл. 4.14). Для изучения ферментативных реакций в мембранах недавно был разработан также метод флуориметрии на поверхностях, позволяющий непосредственно определять концентрации различных ферментов, субстратов и кофакторов. В приведенной в конце главы литературе читатель найдет обширный дополнительный материал, детальнее освещающий эту проблему.
Использование иммобилизованных биохимических соединений в аффинной хроматографии мы рассмотрим в гл. 11. Этот метод, основанный на чрезвычайно высоком сродстве определенных веществ, находящихся в растворе, к иммобилизованному соединению, позволяет выделять, очищать и анализировать ингибиторы ферментов, кофакторы, антигены, антитела и другие вещества.
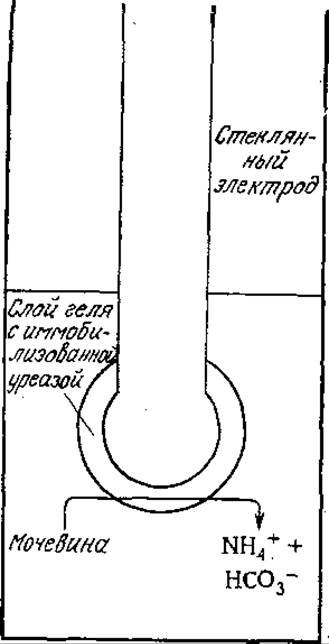
РИС. 4.13. Электрод для определения мочевины; в этом электроде уреаза иммобилизована в геле, нанесенном на поверхность стеклянного электрода.
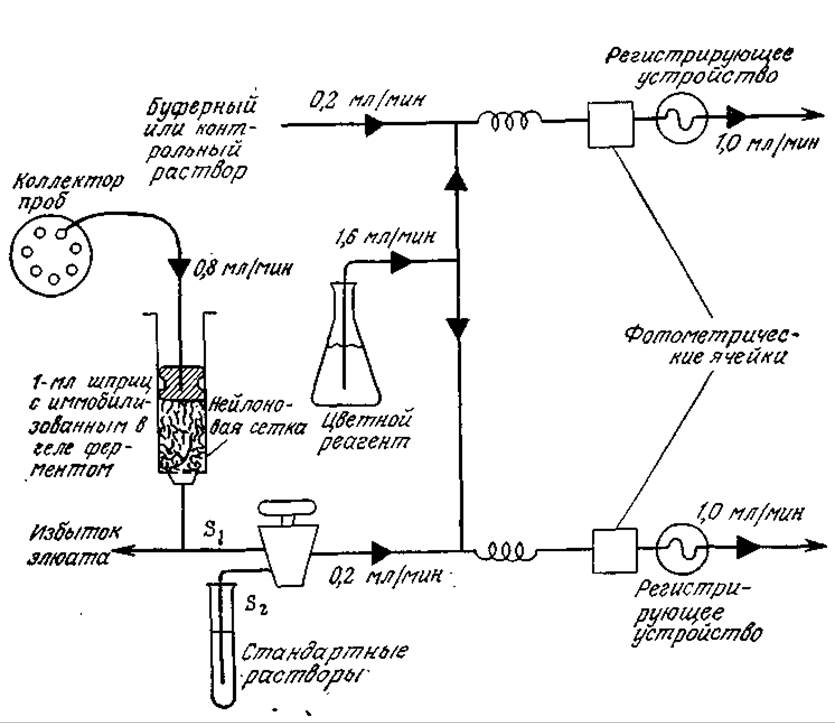
РИС. 4.14. Схема автоматической системы для определения глюкозы (с помощью иммобилизованной глюкозооксидази) или лактата (с помощью иммобилизованной лактатдегидрогеназы). [Воспроизведено с разрешения из статьи: Hicks G. Т., Updike S. J., The Preparation and Characterization of Lyophilized Polyacrylamide Enzyme Gels for Chemical Analysis, Anal. Chem., 38, 726 (1966). © American Chemical Society.]
Таблица 4.14. Некоторые соединения, которые можно определять с помощью электродов с иммобилизованными ферментами.
Ацетальдегид |
D-Галактоза |
Ацетилхолин |
D-Глюкоза |
D-Аланин |
D-Глутамат |
L-Аланин |
L-Гулоно-λ-лактон |
Алифатические иитросоединения |
Г ипоксантин |
Щелочная фосфатаза |
D-Лактоза |
L-Аргинин |
Лактатдегидрогеназа |
D-Аспартат |
L-Лактоза |
Бензальдегид |
NADH |
Холинэстераза |
Пенициллин |
Креатин |
Некоторые пестициды |
Креатинфосфокиназа |
L-Фенилаланин |
L-Цистеин |
Фосфат |
Дегидрогеназы |
Сульфат |
Диамины |
L-Триптофан |
2-Дезокси-D-глюкоза |
L-Тирозин |
Этанол |
Мочевина |
Формальдегид L-Галактонолактон |
Мочевая кислота |