Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Стехиометрия и энергетика метаболических превращений
Катаболизм углерода
Метаболический путь Эмбдена - Мейергофа - Парнаса
Процессы расщепления питательных веществ с целью извлечения энергии называются катаболизмом. В качестве источника углеродсодержащих питательных веществ в подавляющем большинстве случаев используются углеводы, хотя некоторые микроорганизмы могут также утилизировать аминокислоты, углеводороды и другие соединения. Иллюстрацией разнообразия мира микробов может служить тот факт, что практически любой углевод или родственное соединение может усваиваться тем или иным микроорганизмом. Большинство микроорганизмов, способных утилизировать углеводы, может перерабатывать и наиболее распространенный моносахарид глюкозу. В следующем разделе мы изучим основные пути деградации глюкозы. Существует по меньшей мере семь различных путей катаболизма глюкозы. Природа микроорганизма определяет, какой из этих механизмов реализуется и какие конечные продукты образуются. При этом основное внимание мы будем уделять участию рассмотренных выше процессов переноса энергии и электронов, общей стехиометрии метаболического пути, а также идентификации важнейших на данном пути промежуточных соединений.
Изображенный на рис. 5.1 метаболический путь Эмбдена — Мейергофа — Парнаса (ЭМП) включает десять катализируемых ферментами стадий, исходным веществом для которых является глюкоза, а конечным продуктом последовательности реакций — пируват (рис. 5.4). В настоящем разделе мы рассмотрим этот наиболее детально изученный путь катаболизма углерода, обращая особое внимание на энергетику и процессы восстановления.
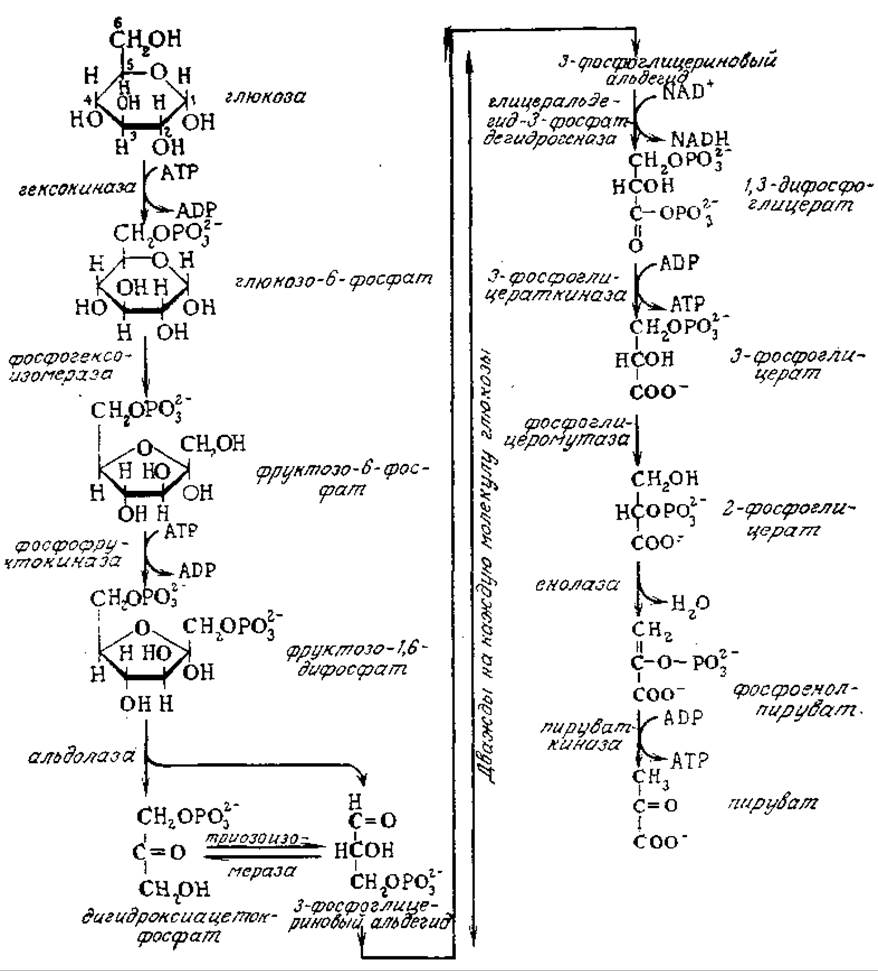
РИС. 5.4. Путь Эмбдена — Мейергофа — Парнаса (ЭМП). Обратите внимание на то, что из каждой шестиуглеродной молекулы субстрата (глюкозы) образуются два промежуточных соединения с тремя атомами углерода, каждое из которых претерпевает последовательные превращения, изображенные на правой стороне рисунка.
Анализ приведенной на рис. 5.4 последовательности реакций пути ЭМП показывает, что каждая стадия представляет собой простую реакцию изомеризации, расщепления кольца или миграции небольших групп, например атомов водорода или фосфатной группировки. В конечном счете из одного моля глюкозы образуются два моля пирувата. Первая и третья реакции осуществляются совместно с гидролизом АТР; спонтанно в необходимом направлении эти реакции не протекают. Две другие стадии связаны с высвобождением свободной энергии, достаточной для фосфорилирования ADP; эти две реакции осуществляются дважды в ходе превращения каждой молекулы исходной глюкозы, поэтому конечным итогом пути ЭМП является фосфорилирование ADP. Как показано на рис. 5.4, дегидрирование глицеральдегид-3-фосфата сочетается с восстановлением NAD+, причем эта реакция происходит дважды в ходе превращения каждой молекулы глюкозы. Таким образом, общую стехиометрию пути метаболизма ЭМП можно выразить следующим уравнением:
![]()
В результате превращения глюкозы в пировиноградную кислоту клетки обеспечиваются резервами химической энергии и восстанавливающих эквивалентов. Накапливание энергии за счет превращения этого или какого-либо другого субстрата называется фосфорилированием на уровне субстрата.
Метаболический путь ЭМП выполняет и другую важную функцию, связанную со снабжением исходными веществами ряда биосинтетических последовательностей реакций. В качестве биосинтетических субстратов (предшественников) используется не только пируват, но и ряд промежуточных веществ этого пути метаболизма (см. рис. 5.1). По этой причине метаболический путь ЭМП называют (как и некоторые другие пути метаболизма) амфиболическим, подразумевая при этом, что он обеспечивает клетку как источниками энергии, так и исходными веществами.
В клетках мышечных тканей и молочнокислых бактериях, а также в ряде других клеток путь ЭМП не завершается на этапе пирувата, а удлиняется еще на одну стадию:
![]()
Вся последовательность реакций, начинающаяся с глюкозы и завершающаяся молочной кислотой, называется гликолизом. Интересно сравнить изменение свободной энергии в гликолизе:
![]()
с изменением свободной энергии расщепления одной глюкозы
![]()
Из уравнений (5.13) и (5.14) следует, что в виде высокоэнергетических фосфатов сохраняется энергия, равная 14,6 ккал/моль глюкозы (или 7,3 ккал/моль АТР). Кажущаяся эффективность переноса свободной энергии равна 14/47x100 — 31%. Введение поправок на реальные концентрации и преобладающие in vivo pH (см. табл. 5.3) показывает, что эта оценка существенно занижена и истинная эффективность составляет около 53%. Причина столь существенного различия между кажущейся и действительной эффективностями становится понятной после коррекции приведенных в табл. 5.3 величин ∆G⁰' в соответствии с реальными концентрациями (см. упражнение 5.4); результаты коррекции показывают, что ∆G' примерно равно нулю для всех стадий, за исключением трех (превращение глюкозы в G6P, F6P в FDP и РЕР в Руr; расшифровка сокращений дана в табл. 5.3). Таким образом, большинство элементарных реакций в последовательности ЭМП являются практически равновесными и, следовательно, обратимыми. Значение неравновесных стадий для всего процесса мы поймем после изучения ферментативной регуляции пути ЭМП (разд. 5.7.2).
Таблица 5.3. Концентрации промежуточных веществ, участвующих в процессе гликолиза в эритроцитах человека, и соответствующие изменения стандартной свободной энергии. Обратите внимание на то, что концентрации всех веществ существенно отличаются от значения 1М, используемого при определении стандартной свободной энергии. Значения ∆G⁰' соответствуют стадиям, в которых участвует указанное в данной строке промежуточное соединениеа
Промежуточное соединение |
Концентрация, мкМ |
Изменение стандартной свободной энергии ∆С⁰', ккал/моль |
Глюкоза |
5000 |
-4,0 |
Глкжозо-6-фосфат (G6P) |
83 |
+0,4 |
Фруктозо-6-фосфат (F6P) |
14 |
-3,40 |
Фруктозо-1,6-дифосфат (FDP) |
31 |
+5,73 |
Дигидроксиацетонфосфат (DHP) |
138 |
+1,83 |
Глицеральдегнд-3-фосфат (GAP) |
18,5 |
-3,0 |
3-Фосфоглицерат (3PG) |
118 |
+1,06 |
2-Фосфоглицерат (2PG) |
29,5 |
+0,44 |
Фосфоенолпируват (РЕР) |
23 |
-7,5 |
Пируват (Руг) |
51 |
-6,0 |
Лактат (Lact) |
2900 |
|
АТР |
1850 |
|
ADP |
138 |
|
Фосфат |
1000 |
аИз книги: Lehninger A. L., Biochemistry, 2d ed., table 16.1, Worth Publishers, Inc., New York, 1975; есть перевод первого издания: Леиинджео А., Биохимия. — М.: Мир, 1976.