Основы биохимии - Филиппович Ю. Б. 1999
Ферменты
Строение ферментов
По строению ферменты могут быть однокомпонентными, простыми белками, и двухкомпонентными, сложными белками. Во втором случае в составе фермента обнаруживается добавочная группа небелковой природы.
В разное время возникли различные наименования белковой части и добавочной группы в двухкомпонентных ферментах. Все они до сих пор употребляются в литературе, например:
Фермент в целом |
Белковая часть |
Добавочная группа |
Симплекс |
Ферон (носитель) |
Агон (активная группа) |
Холофермент |
Апофермент |
Кофермент |
Добавочную группу, прочно связанную, не отделяемую от белковой части, называют простетической группой; в отличие от этого добавочную группу, легко отделяющуюся от апофермента и способную к самостоятельному существованию, обычно именуют коферментом.
Химическая природа важнейших коферментов была выяснена в 30-е годы нашего столетия благодаря трудам О. Варбурга, Р. Куна, П. Каррера и др. Оказалось, что роль коферментов в двухкомпонентных ферментах играют большинство витаминов (Е, К, Q, В1, В2, В6, В12, С, Н и др.) или соединений, построенных с участием витаминов (коэнзим А, НАД+ и т. п.). Формулы упомянутых коферментов приведены в гл. IV. Кроме того, функцию коферментов выполняют такие соединения, как HS-глутатион, многочисленная группа нуклеотидов и их производных, фосфорные эфиры некоторых моносахаридов и ряд других веществ.
Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам. Таким образом, хотя непосредственным исполнителем каталитической функции является простетическая группа, образующая каталитический центр, ее действие немыслимо без участия полипептидных фрагментов белковой части фермента. Более того, в апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый кофермент связывающий домен; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна. Таковы, например, пространственные структуры нуклеотидсвязывающих доменов ряда дегидрогеназ (см. рис. 53, с. 119).
Иначе обстоит дело у однокомпонентных ферментов, не имеющих добавочной группы, которая могла бы входить в непосредственный контакт с преобразуемым соединением. Эту функцию выполняет часть белковой молекулы, называемая каталитическим центром. Предполагают, что каталитический центр однокомпонентного фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Сказанное иллюстрирует рис. 34, Г, на котором приведена третичная структура химотрипсиногена — предшественника однокомпонентного фермента: аминокислотные радикалы остатка сер и двух остатков гис, расположенные в разных точках полипептидной цепи, сблизились здесь на расстояние в несколько десятых долей нанометра, предобразовав каталитический центр фермента. На этом же рисунке (Б и В) приведена третичная структура молекул еще двух ферментов — лизоцима и рибонуклеазы; у них ясно просматривается двухъядерная, двухлопастная конструкция молекул с углублением (щелью) на границе двух лопастей, в котором располагается каталитический центр.
Чаще всего в каталитических центрах однокомпонентных ферментов встречаются остатки сер, гис, три, арг, цис, асп, глу и тир. Радикалы перечисленных аминокислот выполняют здесь ту же функцию, что и кофермент в составе двухкомпонентного фермента.
Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи (см. рис. 34). Поэтому каталитический центр возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Следовательно, изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности.
Кроме каталитического центра, образованного сочетанием аминокислотных радикалов или присоединением кофермента, у ферментов различают еще два центра: субстратный и аллостерический (см. ниже, рис. 51).
Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение вещества (субстрата), подвергающегося ферментативному превращению. Часто этот участок называют «якорной площадкой» фермента, где, как судно на якорь, становится субстрат. Во многих случаях прикрепление субстрата к ферменту идет за счет взаимодействия с ε-аминогруппой радикала лиз, расположенного в субстратном центре. Эту же роль может выполнять СООН-группа глу, а также HS-группа цис. Однако работы последних лет показали, что гораздо большее значение здесь имеют силы гидрофобных взаимодействий и водородные связи, возникающие между радикалами аминокислотных остатков субстратного центра фермента и соответствующими группировками в молекуле субстрата.
Понятие о каталитическом и субстратном центре не следует абсолютизировать. В реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно сформироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго. Активный центр у ферментов располагается на дне щели при двухъядерной структуре, например у лизоцима и рибонуклеазы, или на дне глубокой впадины, как у химотрипсиногена (см. рис. 34).
Аллостерический центр представляет участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного (а иногда—и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Как следствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо снижением каталитической активности фермента. Это явление лежит в основе так называемой аллостерической регуляции каталитической активности ферментов.
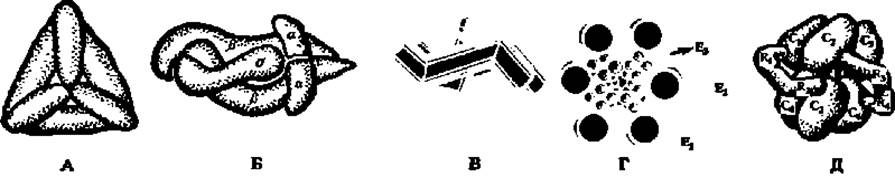
Рис. 46. Строение, некоторых ферментов-мультимеров:
А — молекула глутаматдегидрогеназы, составленная из 6 субъединиц (М = 56000), расположенных по граням правильного тетраэдра; молекулярная масса фермента 336000; Б — модель молекулы РНК-полимеразы из пяти субъединиц; две типа а (М — по 40000), две типа ß(ß — М = 150000 и ß' — M = 155000) и σ-фактор (М = 90000); В — схема строения половины молекулы каталазы; каждая субъединица представлена дважды изогнутой палочковидной частицей; Г — полиферментный комплекс, ускоряющий реакцию окислительного декарбоксилирования (см. с. 101, 160, 352—354); Д — аспартат-карбамилт-рансфераза, составленная из 6 каталитических (М = 33500, обозначены C1— С6) и 6 регуляторных (М = 17000, обозначены R1—R4; R5 и R6не видны) субъединиц
Значения молекулярных масс ферментов колеблются в широких пределах: от нескольких тысяч до нескольких миллионов. В природе насчитывается несколько десятков ферментов, обладающих сравнительно небольшими молекулами (до 50 тыс.). Строение некоторых из них показано на рис. 34. Однако большинство ферментов представлено белками более высокой молекулярной массы, построенными из субъединиц (рис. 46). Так, каталаза (М = 252 000) содержит в молекуле шесть протомеров с М = 42000 каждый. Молекула фермента, ускоряющего реакцию синтеза рибонуклеиновых кислот (РНК-полимераза, М = 475 000), состоит из 5 неравных субъединиц. Полная молекула глутаматдегидрогеназы, ускоряющей процесс окисления глутаминовой кислоты (М = 336 000), построена из 6 субъединиц с М = 56000.
Способы компоновки протомеров в мультимеры разнообразны. Некоторые из них показаны на рис. 46. Крайне важно, что построенный из субъединиц фермент проявляет максимальную каталитическую активность именно в виде мультимера: диссоциация на протомеры резко снижает активность фермента. Не все ферменты-мультимеры построены исключительно из каталитически активных протомеров. Наряду с каталитическими в их составе отмечены регуляторные субъединицы, как, например, у аспартат-карбамил- трансферазы (рис. 46).
Среди ферментов-мультимеров безусловно преобладают димеры и тетрамеры (их несколько сотен), в меньшей мере распространены гексамеры и октамеры (несколько десятков) и необыкновенно редко встречаются тримеры и пентамеры.
Молекулы ферментов-мультимеров в ряде случаев составлены из субъединиц двух типов, обозначаемых условно как субъединицы типа А и В. Они сходны друг с другом, но отличаются по некоторым деталям первичной и третичной структур. В зависимости от соотношения протомеров типа А и В в мультимере последний может существовать в виде нескольких изомеров, которые называют изозимами. Так, при четырех субъединицах возможны 5 изозимов:
![]()
Это явление хорошо изучено у фермента, ускоряющего в мышцах превращение молочной кислоты в пировиноградную и обратно:
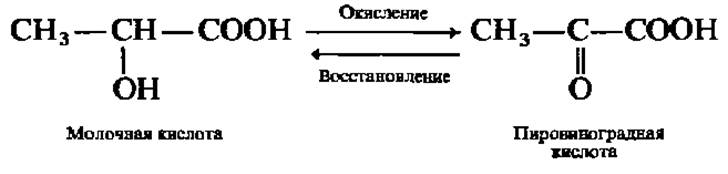
Так как окисление молочной кислоты (acidum lacticwn) сопровождается отнятием атомов Н, этот фермент называют лактатдегидрогеназой. Молекула лактатдегидрогеназы (М = 140 000) составлена из четырех субъединиц (М = 35000), которые условно обозначают Н и М (от англ. heart — сердце и muscle — мышцы), так как из сердца и скелетных мышц выделены І и V типы лактатдегидрогеназы. Следовательно, изозимы лактатдегидрогеназы таковы:
![]()
Они отличаются друг от друга по степени активности, некоторым физическим свойствам (например, молекулярной массе, электрофоретической подвижности), локализации в органах и тканях и т. п. В зависимости от возраста, физиологического состояния и других причин в организме устанавливается то или иное соотношение изозимов, которому соответствует определенный уровень активности фермента в целом. Изменение соотношения изозимов во всем организме или в отдельных тканях и органах представляет, таким образом, один из способов регуляции действия ферментов.
В настоящее время интерес к изозимам резко повысился. Оказалось, что кроме генетически детерминированных изозимов существует большая группа ферментов, обладающая множественными формами, возникающими в результате их посттранслякционной модификации (см. гл. VII). Множественные формы ферментов и изозимы в частности используются сейчас для диагностики болезней в медицине, прогнозирования продуктивности животных, подбора родительских пар при скрещивании для обеспечения максимального гетерозиса в потомстве и т. п.
Значение пространственной организации ферментов особенно ярко выявляется при изучении строения так называемых мультиэнзимов, т. е. ферментов, обладающих способностью ускорять одновременно несколько химических реакций и осуществлять сложные превращения субстрата. Примером может служить мультиэнзим, ускоряющий реакцию окислительного декарбоксилирования пировиноградной кислоты (см. гл. VIII). Этот многоферментный комплекс с М = 4 500000 состоит из трех видов ферментов. Первый из них (Е1) ускоряет реакцию декарбоксилирования пировиноградной кислоты. В состав комплекса входит 12 димерных молекул этого фермента (М = 192 000), изображенных на рис. 46, Г в виде крупных белых шаров, расположенных попарно по периметру рисунка. Второй и третий ферменты, катализирующие окислительно-восстановительные процессы при окислении пировиноградной кислоты, сосредоточены внутри мультиэнзимного комплекса. Один из них (Е3) представлен шестью димерными молекулами (М = 112 000), другой (Е2) — 24 протомерами (М = 70 000) (см. рис. 46, заштрихованные крупные и мелкие шары соответственно).
В тех случаях, когда мультиэнзимный комплекс обслуживает единый, многоступенчатый процесс биохимических превращений, его называют метаболоном (от слова метаболизм—обмен веществ). Таковы метаболоны гликолиза (см. гл. VIII), биосинтеза ряда аминокислот (см. гл. VII), цикла дикарбоновых и трикарбоновых кислот (см. гл. VIII) и др.
В результате слаженного во времени и пространстве действия всех трех видов входящих в его состав ферментов мультиэнзим с огромной скоростью осуществляет превращение пировиноградной кислоты. Именно в кооперативном характере каталитического процесса и кроется главное отличие биокатализаторов от катализаторов неорганической природы, именно поэтому интенсивность биокатализа в десятки, сотни и тысячи раз превосходит мощность действия неорганических катализаторов.
Сравнительно недавно выявлена еще одна своеобразная черта в строении ферментов: некоторые из них являются полифункциональными, т. е. обладают несколькими энзиматическими активностями, но всего лишь одной полипептидной цепью. Дело в том, что эта единая цепь при формировании третичной структуры образует несколько функционально и стерически обособленных глобулярных участков — доменов, каждый из которых характеризуется своей каталитической активностью. В последующих главах будут приведены соответствующие примеры.
При изучении мультиэнзимных комплексов и полифункциональных ферментов удалось понять наиболее важную особенность ферментативного катализа, а именно — эстафетную передачу промежуточных продуктов реакции от одного компонента каталитической системы к другому без их высвобождения.