Основы биохимии - Филиппович Ю. Б. 1999
Ферменты
Механизм действия ферментов
Механизм действия однокомпонентных и двухкомпонентных ферментов однотипен, так как активные центры в их молекулах функционально сходны между собой.
Ведущую роль в механизме ферментативного катализа играет образование фермент-субстратных комплексов, на существование которых впервые указал Д. Браун (1902). На первой фазе ферментативного катализа между субстратом (или субстратами) и ферментом возникает соединение, в котором реагенты связаны друг с другом ионной, ковалентной или иного типа связью. Затем (вторая фаза) субстрат под действием присоединенного к нему фермента претерпевает изменение, делающее его более доступным для соответствующей химической реакции. На третьей фазе происходит сама химическая реакция и, наконец, образовавшиеся продукты реакции на четвертой фазе освобождаются из фермент-продуктного комплекса. Если обозначить фермент Е, субстрат 5, активированный субстрат S' и продукт реакции Р, то указанная последовательность процессов выразится нижеследующей схемой:
![]()
Эта схема была первоначально разработана В. Генри (1903), затем Л. Михаэлисом и М. Ментен (1913) и подтверждена прямым выделением ES-, ES' и ЕР-комплексов.
Одним из примеров ферментативного катализа, осуществляемого в соответствии с приведенной схемой, может служить реакция гидролиза ацетилхолина. Это соединение служит медиатором (посредником) при передаче нервных импульсов: в ответ на выделение окончанием нервного волокна ацетилхолина следует ответная реакция возбуждения нервной клетки. Чтобы этот процесс протекал непрерывно, после каждого акта передачи нервного импульса вызвавшая возбуждение порция ацетилхолина (1—2 мкг) должна быть полностью разрушена. Это достигается посредством реакции гидролиза ацетилхолина при участии фермента ацетилхолинэстеразы. Гидролиз осуществляется с огромной скоростью: 1—2 мкг ацетилхолина за 0,1—0,2 мс:
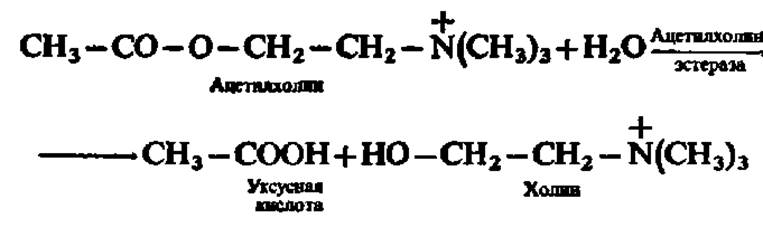
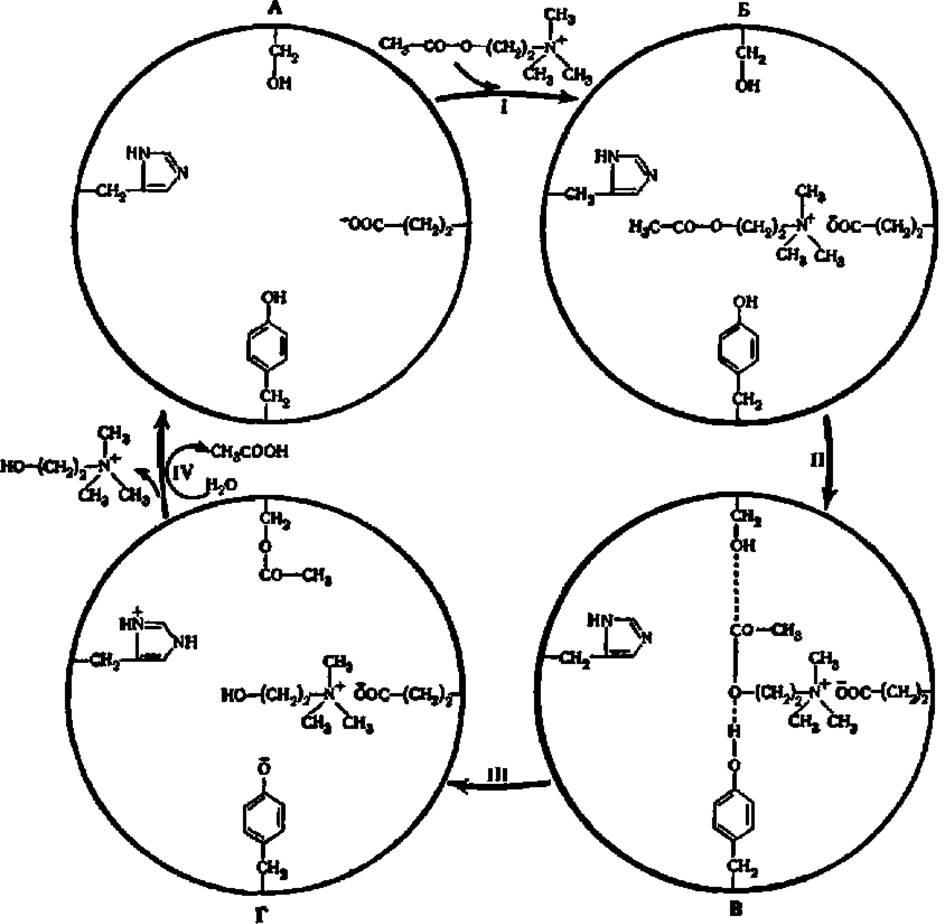
Рис. 47. Механизм действии ацетилхолинэстеразы:
А — активный центр фермента; Б — фермент-субстратный комплекс, В — подготовка к преобразованию (активирование) субстрата; Г — комплекс продуктов реакции с ферментом (пояснения в тексте)
Ацетилхолинэстераза — однокомпонентный фермент. В ее активном центре сосредоточены по меньшей мере 4 аминокислотных радикала — глу, сер, гис и тир, обеспечивающие последовательное осуществление перечисленных выше этапов ферментативного катализа.
Сначала между ферментом (ацетилхолинэстераза) и субстратом (ацетилхолин) возникает фермент-субстратный комплекс. Он образуется за счет электростатического взаимодействия между отрицательно заряженной ионизированной СООН-группой радикала глу и положительно заряженным атомом N молекулы ацетилхолина (рис. 47,1, Б). После образования фермент-субстратного комплекса вступают в действие остальные аминокислотные радикалы активного центра ацетилхолинэстеразы. В первую очередь замыкается связь между углеродом поляризованной СО-группы ацетильного радикала холина и кислородом ОН-группы остатка сер. Затем возникает водородная связь между кислородом сложноэфирной связи в молекуле ацетилхолина и ОН-группой радикала тир (рис. 47, ІІ, В).
Расположение молекулы ацетилхолина и радикалов сер и тир в активном центре фермента таково, что образование упомянутых связей ослабляет связь между СО-группой и атомом кислорода сложноэфирной связи в молекуле ацетилхолина (эффект «дыбы»). В результате для ее разрыва требуется гораздо меньше энергии, т. е. энергетический барьер оказывается сниженным вследствие активации молекулы ацетилхолина (ЕS'-комплекс). Поэтому под влиянием радикала гис, оттягивающего на себя протон от ОН-группы сер, упрочняется сложноэфирная связь между радикалом сер и ацетильной группой с одновременным разрывом сложноэфирной связи в молекуле ацетилхолина и переходом протона от радикала тир к остатку холина (рис. 47, ІІІ, Г). Последний высвобождается из активного центра (рис. 47, IV), а его место занимает молекула воды. Она образует связь с карбонильным кислородом ацетильной группы и кислородом тир (на рис. 47 этот этап не показан), после чего протон от остатка гис возвращается к кислороду ОН-группы сер, а протон воды — к радикалу тир. Одновременно выделяется второй продукт реакции — уксусная кислота и регенерируется свободный активный центр ацетилхолинэстеразы (рис. 47, IV, А), готовый к новому акту катализа.
В процессе образования фермент-субстратного комплекса и на дальнейших фазах ферментативного катализа происходят неоднократные изменения третичной структуры фермента, приводящие к последовательному сближению с субстратом и ориентации в пространстве тех активных групп, которые взаимодействуют друг с другом на различных этапах преобразования субстрата. Изменение третичной структуры белка невозможно без участия всей или почти всей полипептидной цепи, образующей белковую молекулу. Следовательно, в каталитическом акте принимает участие по существу вся или почти вся молекула фермента.
Отдельные этапы взаимодействия фермента и субстрата при ферментативном катализе все более проясняются. В частности, установлено, что за стадией адсорбции субстрата в активном центре фермента наступает «узнавание» субстратным центром фермента той части молекулы субстрата, которая непосредственно не подвергается химическому преобразованию. За счет возникающих при этом многоточечных контактов, реализующихся в виде сил слабого взаимодействия (гидрофобные, водородные и др.), связь субстрата с ферментом упрочняется. Одновременно с этим в активном центре фермента «стабилизируется» та часть субстрата, которая в дальнейшем участвует в химической реакции, —она фиксируется в напряженной конфигурации, близкой к переходному состоянию субстрата при превращении его в продукт. В результате реагирующий фрагмент молекулы субстрата и каталитические группы фермента образуют продуктивный комплекс, где уже частично осуществлены электронно-конформационные переходы, необходимые для протекания собственно химической стадии ферментативного процесса. Это приводит к понижению энергии активации, необходимой для осуществления химической реакции, благодаря энтропийному эффекту вследствие иммобилизации, закрепления, жесткой ориентации субстрата в активном центре фермента. Таким образом, каждое звено в многостадийной химической реакции, ускоряемой ферментом, создает почти оптимальные условия для прохождения ее следующего этапа. Как следствие, химическая реакция при ферментативном катализе идет в десятки, сотни тысяч раз быстрее.
Рассмотрение тонкого механизма ферментативного катализа позволяет понять специфику действия ферментов, отличающую их от катализаторов неорганического происхождения. Уникальная структура и взаимодействие каталитического, субстратного и аллостерического центров фермента обеспечивает кооперативное осуществление многостадийных процессов. Именно упорядоченность реакций в пространстве и времени, их кооперативный характер отличают действие биокатализаторов, обеспечивая высокую специфичность и скорость процесса в целом.