Основы биохимии - Филиппович Ю. Б. 1999
Ферменты
Применение ферментов
Ферменты способны осуществлять свою каталитическую функцию и вне клетки, вне организма. Хотя, находясь с составе соответствующих структур, ферменты обладают огромной мощностью действия, тем не менее, будучи выделены из биологических объектов, они сохраняют свою каталитическую активность. Естественно, что ряд ферментных препаратов используют в практике.
Практическое применение ферментов в народном хозяйстве нашей страны расширяется с каждым годом. В хлебопекарной промышленности применяют ферментные препараты (содержат амилазу и протеиназу), выделяемые из грибов, относящихся к роду Aspergillus. Будучи добавлены в количестве 20—25 г на 1 т муки, они улучшают качество и аромат хлеба, ускоряют созревание теста на 30%, сокращают расход сахара на производство высших сортов булочных изделий вдвое, увеличивают пористость мякиша и объем хлеба на 20%.
В пивоварении и спиртовой промышленности применяют амилазы — ферменты, ускоряющие реакцию осахаривания крахмала. Их производство приняло у нас промышленный характер. Экономический эффект применения амилаз весьма значителен. Так, в пивоварении использование ферментных препаратов позволяет экономить 165 г ячменя при производстве каждого декалитра пива. Применение амилазы при производстве спирта дает возможность полностью отказаться от зернового солода и одновременно увеличить выход спирта из сырья на 1,5% при снижении себестоимости декалитра спирта. Широкие перспективы сулит использование ферментов в виноделии. Пектинолитические ферменты повышают выход соков из плодов и ягод на 15—20%, виноматериалов — на 5—7%; они также необходимы для осветления фруктовых соков. Каталаза и глюкозооксидаза длительно сохраняют букет розовых и белых вин.
В кожевенном н меховом производстве для ускорения снятия волоса со шкур и размягчения кожевенного сырья применяют препараты протеиназ (протелин и протофрадин), являющихся внеклеточными протеиназами стрептомицетов. При этом время на осуществление необходимых процессов сокращается в несколько раз, сортность и качество шерсти и кож повышается, а условия труда в этой отрасли производства резко улучшаются. В текстильной промышленности процесс расшлихтовки тканей ферментными препаратами грибного и бактериального происхождения ускоряется в 7—10 раз; эти же препараты служат для удаления серицина при размотке коконов тутового шелкопряда в производстве натурального шелка. В кулинарии применение пептидгидролаз (протелин и проназа) для обработки мяса перед его приготовлением резко улучшает качество мясных блюд. В мясной промышленности протеолитические ферменты применяют для ускорения созревания мяса и повышения выхода мяса 1-го сорта с 15 до 40%. В молочной промышленности использование протеаз ускоряет созревание сыров вдвое и снижает их себестоимость на 10%. Подсчеты показывают, что если полностью обеспечить кожевенную, пищевую и текстильную промышленность ферментными препаратами (их потребуется несколько тысяч тонн в год), то за счет этого можно получить значительную экономию.
Ферменты применяют и в бытовой химии. Протеазы растительного происхождения, выдерживающие нагревание до 90° С без заметной потери активности, являются компонентами стиральных порошков и моющих средств. В стиральные порошки вводят также а-амилазу, глюкозооксидазу и липоксигеназу, а уратоксидаза в составе моющих средств способствует удалению винных и жирных пятен с одежды. Глюкозооксидазу, каталазу и некоторые другие ферменты добавляют в зубную пасту—они обеспечивают их антимикробные свойства и предохранение зубов от кариеса.
Крупномасштабным является производство глюкозы из отходов целлюлозы при посредстве целлолитического комплекса ферментов и из крахмала при помощи глюкоамилазы. Обработка дигестазой (комплекс протеолитических ферментов, выделяемый из печени крабов) повышает на 3.0% выход товарного продукта при обработке икры, извлеченной из рыб.
Ферменты находят большое применение в медицине. Пепсин, трипсин, химотрипсин, липазу и амилазу в виде ферментных препаратов и их смесей (бетацид, абомин, фестал, панзинорм и др.) применяют для лечения заболеваний желудочно-кишечного тракта. Гиалуронидазу (у нас выпускают два ее препарата, выделяемых из семенников быка, — лидазу и ронцдазу), деполимеризующую гиалуроновую кислоту и способствующую проникновению лекарственных средств в пораженную ткань — для лечения заболеваний суставов, отеков, ран, кровоподтеков и т. п. Протеолитические ферменты — плазмин (фибринолизин) и активирующие его стрептокиназу и урокиназу — для растворения тромбов в кровеносных сосудах. Дезоксирибонуклеазу из поджелудочной железы или стрептококка (стрептодорназа) — для лечения заболеваний верхних дыхательных путей и роговицы глаза, а также для удаления гноя из ран. Аспарагиназу, обеспечивающую дезамидирование аспарагина, незаменимого для роста ряда опухолей, — при лечении некоторых видов рака. Лизоцим — для лечения конъюнктивитов, цитохром — для устранения явлений кислородного голодания при заболеваниях сердца, коллагеназу — для рассасывания рубцовых образований, эластазу — для задержки развития атеросклероза, ß-галактозидазу — для снятия явления непереносимости молочных продуктов из-за недостаточности этого фермента в пищеварительном тракте ряда людей, галактокиназу — для выведения галактозы из тканей при ее патологическом накоплении в них, L-фенилаланин-аммиак-лиазу — для понижения содержания в крови фенилаланина при нарушениях его обмена, лизоамидазу — для лечения заболеваний, вызванных патогенными микроорганизмами (стафилококки, стрептококки и др.).
Специфическую область применения ферментов в медицине составляет энзимодиагностика: заболевание того или иного органа у человека может быть тестировано по уровню содержания фермента или соотношению его множественных форм (в том числе изозимов) в крови или реже в моче. Так, лактатдегидрогеназа (ЛДГ), аспартатаминотрансфераза (АсАТ), креатинкиназа, изоцитратдегидрогеназа и фруктозо-1,6-дифосфат-альдолаза служат для диагноза инфаркта миокарда; ЛДГ, АсАТ и аланинаминотранефераза — заболевания светлыми кружками и тонкой цветной линией обозначен ход кривой, отражающей ежегодные публикации по изучению иммобилизованных ферментов, темными и толстой цветной линией — число получаемых ежегодно патентов печени, у-глутамилтрансфераза — отторжения органов при их пересадке, щелочная фосфатаза — заболевания желтухой, кислая фосфатаза — нарушения функции предстательной железы и т. д.
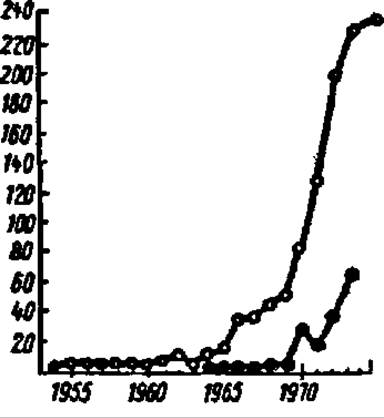
Рис. 57. Развитие работ по инженерной энзимологии:
Особенно широко в последние годы процессы ферментации применяют в химической промышленности. Использование ферментов для производства тех или иных химических продуктов стало массовым явлением. Для этого в большинстве случаев применяют иммобилизованные ферменты, т. е. ферменты, закрепленные на носителе, но сохранившие каталитическую активность, что позволяет использовать их повторно или непрерывно.
Еще в 1916 г. Дж. Нельсон и Е. Гриффин показали, что ферменты в водонерастворимой форме сохраняют каталитическую активность, однако первая попытка получить иммобилизованные ферменты с целью их практического применения была предпринята только в 1953 г. Н. Ірубхофером и Л. Шлейтом, закрепившими на диазотированном полиаминополистироле амилазу, пепсин, рибонуклеазу и карбоксипептидазу. В течение последующих 12 лет исследования в этой области были единичными и только начиная с 1965 г. приобрели широкий, а с 1971 г., после проведения первой конференции по инженерной энзимологии, массовый характер (рис. 57).
Для промышленных целей иммобилизуют ферменты в основном микробного происхождения ввиду их доступности, дешевизны (они в 100 раз дешевле, чем ферменты животного и растительного происхождения), независимости массового производства от сезона вегетации растений или сроков выращивания животных, короткого периода накопления бактериальной массы для выделения ферментов. Важно, что иммобилизация, как правило, сопровождается повышением в тысячи и десятки тысяч раз стабильности ферментов, что создает условия для их использования в качестве гетерогенных катализаторов. Кроме того, механическое изменение матрицы, на которой закреплен фермент, открывает возможность варьировать его активность и понять принцип работы природных механохимических систем.
Сейчас все более отчетливо вырисовывается огромное значение иммобилизации ферментов для осуществления процессов жизнедеятельности, ибо значительная часть их в клетке иммобилизована сепаратно или в составе ансамблей в липидном матриксе биологических мембран (например, аденилатциклаза, см. гл. XII, ансамбли оксидоредуктаз, см. гл. X, и многие другие ферменты).
Для иммобилизации ферментов используют захват их полиакриламидным гелем и иными полимерами при полимеризации составляющих их мономеров, а также захват гелями, возникающими при желатинизации природных полимеров, например полисахаридов морских водорослей; присоединение ферментов к целлюлозе, сефарозе, сефадексу, крахмалу, декстрану, агарозе и другим полисахаридам, активированным цианбромидом и другими агентами; привязку ферментов к стеклянным бусинкам через диазосоединение; ковалентное связывание фермента с азидными и гидразидными группами сополимера акриламида и акрилгидразина (энзакрила) и других носителей; соединение фермента с гидратированными оксидами металлов, производными поливинилового спирта, альдегидными и диазогруппами модифицированных фенольных полимеров, силикагелями и многими другими материалами.
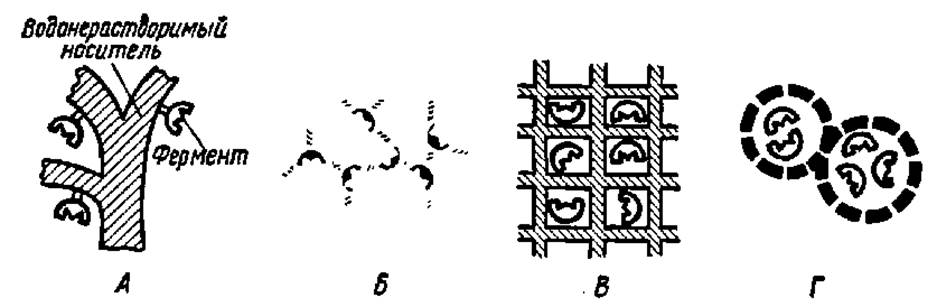
Рис. 58. Способы перевода фермента в иммобилизованное состояние:
А — присоединение к носителю; Б — Образование перекрестных связей между ферментом и носителем; В — включение в решетчатую структуру полимерного носителя; Г — микрокапсулирование
Представляет интерес иммобилизация ферментов на мембранах аппаратов для ультрафильтрации. Соответствующие способы перевода ферментов в иммобилизованное состояние показаны на рис. S8.
Почти из 2000 известных в настоящее время ферментов иммобилизовано и используется для целей инженерной этимологии примерно десятая часть (преимущественно оксидоредуктазы, гидролазы и трансферазы). Оптимальным методом иммобилизации считают включение ферментов в полимерные гели, массовым способом является адсорбционное и ковалентное присоединение ферментов к носителям, более или менее распространено включение в мембраны и микрокапсулирование, единичными остаются другие приемы.
Для осуществления химических процессов с помощью иммобилизованных ферментов применяют колоночные, трубчатые, пластинчатые, двухфазные и танкерные реакторы разного объема и производительности. Вероятно, первым реактором, где иммобилизованный фермент использовали в промышленном масштабе, был реактор для разделения рацемических смесей D- и L-аминокислот.
Он был введен в эксплуатацию в Японии (1969) на аминоацилазе, иммобилизованной на ДЕАЕ-сефадексе:
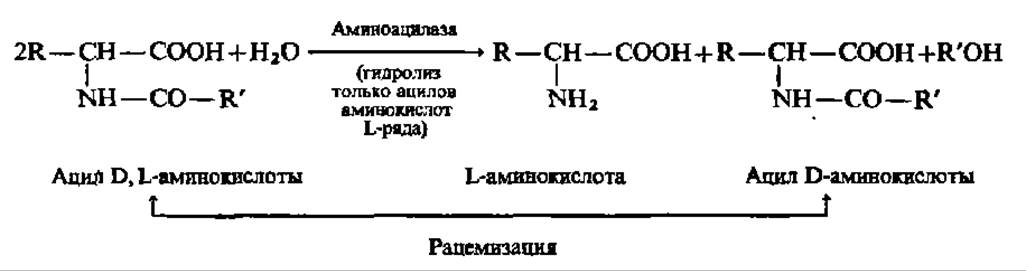
Одновременно или даже немного раньше началось промышленное получение инвертного сахара (смесь глюкозы и фруктозы, возникающая в результате гидролиза сахарозы) с помощью иммобилизованной ß-фруктофуранозидазы (сахараза или инвертаза), получившее сейчас широкое распространение. Иммобилизованная инвертаза очень устойчива и за десять лет непрерывной работы одного из реакторов ее активность упала всего на 10%.
Не меньшее промышленное значение имеет и другой процесс, приводящий к получению эквимолярной смеси глюкозы и фруктозы: превращение глюкозы в фруктозу с помощью иммобилизованной глюкозоизомеразы.
Соответствующие установки работают в США (начиная с 1972 г.), ФРГ, Дании и Голландии. В нашей стране изомеризацию глюкозы в фруктозу ведут
в трубчатом реакторе с глюкозоизомеразой из Actinomyces olivocinereus, иммобилизованной на силохроме; за месяц непрерывной работы реактора при 50%-ном уровне превращения глюкозы в фруктозу теряется не более 14% активности фермента.
В 1974 г. в Японии начат промышленный синтез L-аспарагиновой кислоты при посредстве аспартат-аммиак-лиазы, иммобилизованной на фенолформальдегидной смоле. Однако при высокой степени (99%) превращения фумарата аммония в L-аспарагиновую кислоту фермент менее устойчив, чем в. составе иммобилизованных клеток—время его полужизни равно 18 суткам. В этой же стране функционируют промышленные установки по синтезу L-триптофана из индола и серина при помощи включенной в волокна триптофансинтазы, а также по синтезу L-тирозина при посредстве иммобилизованной тирозинфенол-лиазы.
Упомянем еще одно крупномасштабное производство на базе иммобилизованной пенициллинамидазы, имеющее огромное значение для фармацевтической промышленности, так как оно обеспечивает исходным продуктом синтез аналогов природного пенициллина, отличающихся большей терапевтической ценностью. Это — синтез 6-аминопенициллановой кислоты:
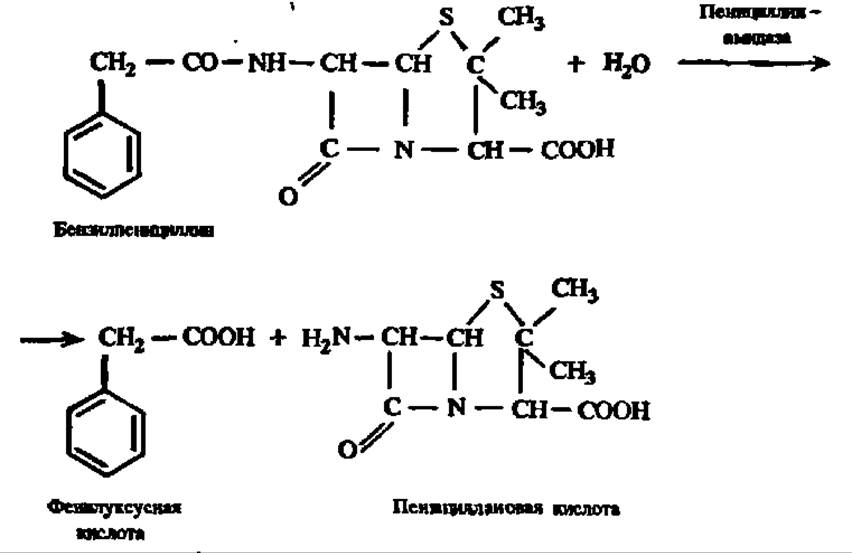
Присоединяя по ее аминогруппе иные, чем бензил, радикалы, получают пенициллины, отличающиеся специфическими качествами.
Сказанным далеко не исчерпывается список химических производств, базирующихся на применении достижений инженерной энзимологии, имеющей огромное будущее.
Наряду с использованием иммобилизованных ферментов продолжает развиваться переработка химического сырья при посредстве микроорганизмов, которые в этом случае являются как бы живыми ферментсодержащими лабораториями. Наиболее древним химическим производством такого рода является получение спирта путем брожения, когда примерно полтора десятка ферментов, содержащихся в дрожжевых клетках, с огромной скоростью превращают глюкозу в этиловый спирт. Характерно, что в настоящее время осуществляется интенсивный переход от классических схем бродильной промышленности на новую технологию с использованием иммобилизованных клеток различных микроорганизмов. Так, этанол получают из глюкозы с помощью иммобилизованных в полиакриламидном геле клеток Saccharomyces cerevisiae.
Первый в мире промышленный 1000-литровый реактор проточного типа по синтезу L-аспарагиновой кислоты из фумарата аммония был запущен в Японии (1973); в нем использованы иммобилизованные в полиакриламидном геле клетки кишечной палочки (Esherichia coli, штамм АТСС № 11303), содержащие аспартат-аммиак-лиазу:
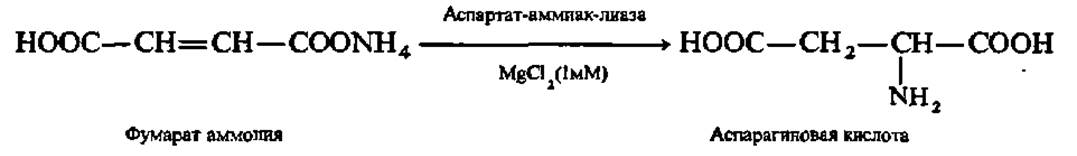
Он давал 1915 кг L-аспарагиновой кислоты/сут при 95%-ном уровне превращения в нее введенного фумарата аммония. При подкислении элюата до pH 2,8 и охлаждении до 15° С аспарагиновая кислота выкристаллизовывалась в виде препарата 100%-ной чистоты. Иммобилизованные клетки кишечной палочки сохраняют активность аспартат-аммиак-лиазы на 80% в течение 120 дней и на 50% — в течение 600 дней работы реактора, тогда как интактные клетки — всего в течение 10 дней и на уровне 25% от исходной. Отсюда ясен выигрыш, приносимый иммобилизацией. Годом позже на химическом факультете МГУ им. М. В. Ломоносова была опробована установка с иммобилизованными клетками кишечной палочки (штамм 85), обладающими аспартат-аммиак-лиазной активностью с производительностью несколько килограммов L-аспарагиновой кислоты особой чистоты. Такая установка в научно-исследовательском институте аминокислот (г. Ереван) масштабируется до промышленного уровня.
Другая аминокислота, производство которой налажено в индустриальном масштабе, — L-изолейцин. Ее синтезируют из треонина и глюкозы при посредстве иммобилизованных клеток Serratia marcescens с выходом до 4 г/л элюата с колонки реактора. Аналогичным образом получают еще одну незаменимую аминокислоту — L-лизин:
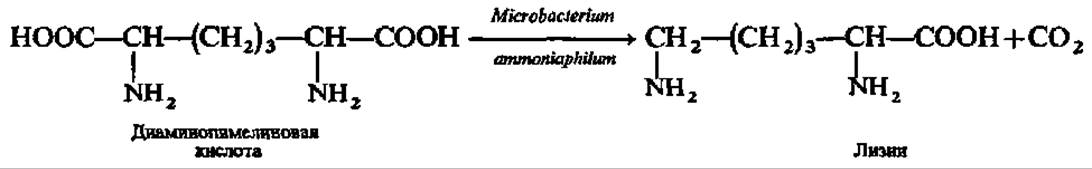
При посредстве иммобилизованных клеток Corynobacterium glutamicum производят L-глутаминовую кислоту из глюкозы; Esherichia coli — L-триптофан из индола; Streptococcus faecalis — L-орнитин из L-аргинина. Разработаны также методы синтеза L-аланина, L-фенилаланина, L-метионина и L-треонина тоже с помощью иммобилизованных микроорганизмов. Таким образом, наработка аминокислот L-ряда для питания человека и выращивания сельскохозяйственных животных осуществляется в настоящее время в основном в реакторах с иммобилизованными клетками.
С помощью иммобилизованных в полиакриламидный гель клеток Brevibacterium ammoniagens начиная с 1974 г. в Японии в промышленном масштабе производят яблочную кислоту из фумаровой. У нас в стране отработан регламент получения пропионовой, уксусной и пировиноградной кислот из глюкозы, лактозы или лактата натрия в проточной системе с клетками пропионовокислых бактерий (Propionibacterium shermanii), иммобилизованными в полиакриламидный гель.
. Опробованы на лабораторных установках, а частично и в крупномасштабных вариантах методы синтеза с помощью иммобилизованных клеток различных микроорганизмов АТФ, НАДФ, глюкозо-6-фосфата, глутатиона, глюконовой и 2-кетоглюконовой кислоты, фруктозы (изомеризацией глюкозы), смеси глюкозы и фруктозы (гидролизом сахарозы), коэнзима А и ацетил-КоА. Недавно японским химикам удалось этим же путем перевести пропилен в оксид пропилена прямым окислением кислородом — это крупное достижение внедрено в практику.
Особо следует упомянуть использование иммобилизованных клеток в фармацевтической промышленности для синтеза стероидных гормонов и их производных, синтеза пенициллинов пролонгированного действия и ряда других лекарственных препаратов. В последнее время развернулись перспективные работы по иммобилизации методами инженерной энзимологии клеток, которым при помощи приемов генетической инженерии придана способность продуцировать важнейшие лекарственные средства — инсулин, интерферон, а1-антитрипсин. К 2000 г. намечено резко увеличить производство лекарственных средств методами генетической инженерии.
Еще одна область применения ферментов — аналитическая химия. Она базируется на изготовлении электродов, покрытых иммобилизованными ферментами. Так, если на платиновый электрод нанести иммобилизованную глюкозооксидазу, то концентрацию глюкозы можно определить, регистрируя амперометрически количество выделяющегося на электроде пероксида водорода:
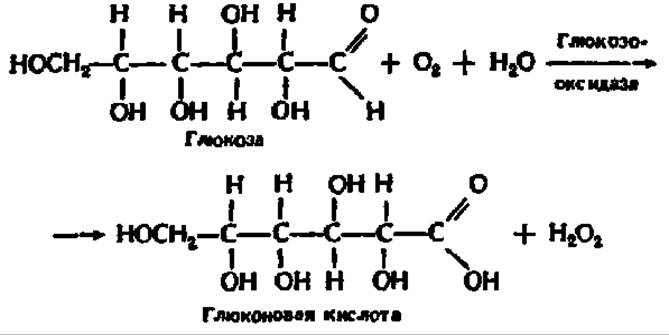
Определение высокоспецифично (на электроде реакция идет только с глюкозой) и осуществляется в течение 1 мин. На базе такого ферментного электрода создан автоматический анализатор глюкозы. При помощи ферментных электродов определяют сахарозу, мочевину, этиловый спирт, анализируют загрязнение среды остаточными пестицидами и т. п.
Не исключено, что использование ферментов позволит найти новые источники для добывания энергии. Опыты в этом направлении уже сделаны и наметились два пути решения этой насущной для человека проблемы.
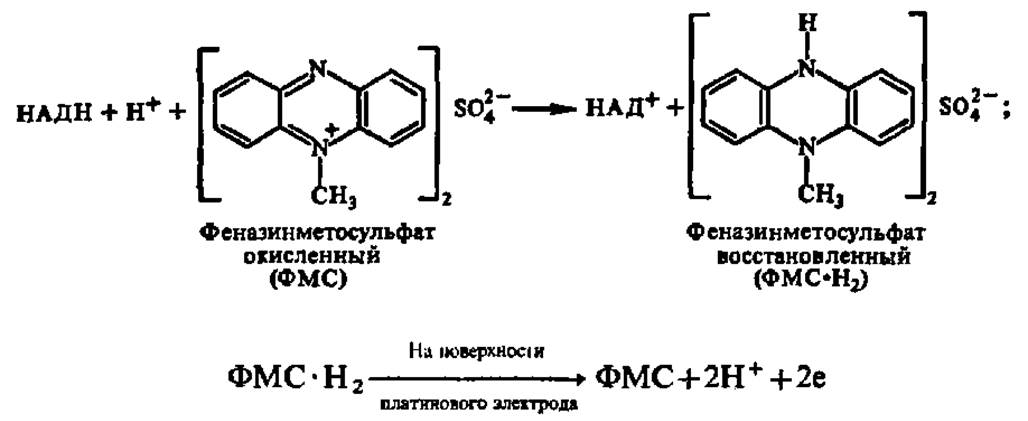
Первый состоит в прямом преобразовании химической энергии в электрическую в топливных элементах, где используются такие ферменты, как глюкозооксидаза, уреаза, гидрогеназа, формиат- и алкогольдегидрогеназа (субстраты — глюкоза, мочевина, водород, муравьиная кислота и этанол соответственно). В случае алкогольдегидрогеназы в качестве фермента и этанола в качестве субстрата схема получения электрического тока такова:
![]()
Второй путь сводится к использованию в качестве источника энергии продуктов ферментативной реакции, например водорода, выделяющегося при улавливании энергии солнца (рис. 59). Расчеты показывают, что квадрат размером 200x200 [км], где размещены акцепторы солнечной энергии — иммобилизованные хлоропласты, при КПД, равном 25%, обеспечит РФ энергией и исключит загрязнение внешней среды.
Во многих лабораториях мира ученые настойчиво разрабатывают одну из самых сложных, но вместе с тем практически наиболее важных проблем — проблему механизма ферментативного катализа. Когда она будет полностью решена, современная нам химическая промышленность уступит место совершенно новому химическому производству, основанному на принципе ферментативного катализа, — производству, где с огромными скоростями, 100%-ными выходами, избирательно, без побочных продуктов, в мягких условиях (низкая температура и давление и т.п.) будет осуществляться превращение одних веществ в другие. Более того, полная расшифровка ферментативных механизмов таких процессов, как фотосинтез, биосинтез белков, фиксация молекулярного азота и т. п., и воспроизведение их на этой основе в лаборатории и промышленности могут в корне изменить способы добывания пищевого и непищевого сырья и оказать огромное влияние на образ жизни человечества.
Круг химических процессов, ускоряемых ферментами, необычайно широк, а число их огромно. В природе осуществляется множество ферментативных превращений, еще недоступных воспроизведению в лабораторных условиях. Все это свидетельствует об огромном значении ферментов как истинных двигателей жизненных процессов. Изучая ферменты, мы невольно были вынуждены наряду с описанием их строения и свойств уделить большое внимание ускоряемым ими химическим превращениям. Этим мы сделали первый шаг к изучению ряда конкретных разделов динамической биохимии, изложенных в последующих главах учебника.
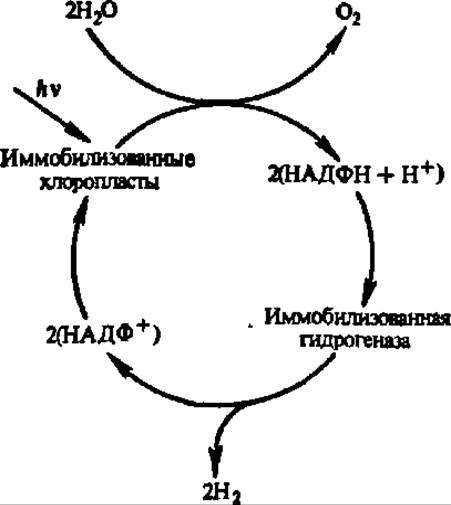
Рис. 59. Принципиальная схема акцептирования солнечной энергии для разложения воды и получения газообразного топлива