Основы биохимии - Филиппович Ю. Б. 1999
Нуклеиновые кислоты и их обмен
Обмен нуклеиновых кислот
Изучение обмена нуклеиновых кислот представляется принципиально важным в системе подготовки учителей на химико-биологических и биологохимических факультетах пединститутов, так как круг вопросов, которые при этом рассматриваются, далеко выходит за рамки биохимии нуклеиновых кислот и позволяет дать современную трактовку проблемам наследственности, изменчивости, естественного и искусственного мутагенеза, систематики и эволюции.
Изучение обмена нуклеиновых кислот имеет огромное значение и в другом аспекте. Oно исключительно важно для глубокого понимания процессов жизнедеятельности организмов. Исследование молекулярных механизмов биосинтеза пуриновых и пиримидиновых оснований позволило открыть ряд важнейших закономерностей в регуляции новообразования этих соединений и сформулировать некоторые общие принципы регуляции обмена веществ. Раскрытие механизма специфического биосинтеза огромных молекул полинуклеотидов, при осуществлении которого с изумительной точностью обеспечивается порядок чередования мононуклеотидных звеньев, их составляющих, привело к признанию ведущей роли в этом процессе взаимодействия комплементарных пуриновых и пиримидиновых оснований. Это, в свою очередь,
дало возможность впервые понять интимный механизм обеспечения специфического воспроизведения первичной структуры макромолекул при их биосинтезе. Данные о регуляции новообразования нуклеиновых кислот привели к фундаментальным открытиям, позволяющим сделать первые шаги к объяснению закономерностей не только воспроизведения специфических макромолекул, но также и морфогенеза.
Пути распада нуклеиновых кислот. Распад нуклеиновых кислот в организме идет достаточно энергично. Так, период полужизни молекул ДНК в тканях мыши составляет от 1 до 5 суток; период полужизни большинства мРНК у эукариот — несколько суток, а у прокариот — всего несколько секунд.
Нуклеиновые кислоты (РНК и ДНК) распадаются в организме при посредстве особых ферментов — нуклеаз. Они ускоряют реакцию разрыва межнуклеотидных фосфодиэфирных связей в молекулах нуклеиновых кислот и принадлежат, следовательно, к более широкой категории ферментов — фосфодиэстераз.
Нуклеазы, действующие на внутренние межнуклеотидные связи в молекулах ДНК и РНК, называются эндонуклеазами. При их участии осуществляется деполимеризация нуклеиновых кислот в основном до олигонуклеотидов. Нуклеазы, ускоряющие реакции последовательного отщепления нуклеотидов от РНК, ДНК или их фрагментов, начиная с конца полинуклеотидной цепи, называют экзонуклеазами. Они обеспечивают распад нуклеиновых кислот до свободных нуклеотидов.
В зависимости от специфичности действия среди нуклеаз различают рибонуклеази и дезоксирибонуклеазы. Первые ускоряют реакции распада как внутренних, так и внешних (концевых) межнуклеотидных связей в молекулах РНК. Вторые выполняют такую же функцию по отношению к ДНК. Вместе с тем существует большая группа неспецифических эндо- и экзонуклеаз, действующих одновременно и на РНК, и на ДНК.
По характеру действия на фосфодиэфирные связи в молекулах нуклеиновых кислот нуклеазы делят на две категории. Одни из них ускоряют реакцию гидролиза сложноэфирной связи межнуклеозидного фосфата с 3'-углеродным атомом остатка рибозы или дезоксирибозы, а другие — с 5'- углеродным атомом. Поэтому в названиях указанных ферментов всегда подчеркивается, гидролиз какой из связей ускоряет данная нуклеаза. Однако ведущим признаком является локализация фосфата в составе олиго- или мононуклеотидов, возникающих в результате гидролиза нуклеиновой кислоты. Поэтому нуклеазы, расщепляющие связь Р—5'С, называются 3'-нуклеазами, а расщепляющие связь Р—3'С именуют 5'-нуклеазами:
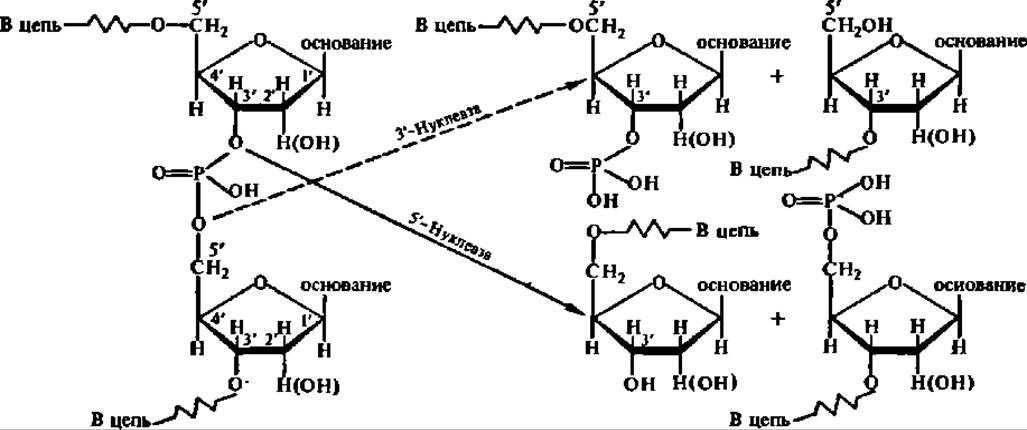
Важнейшими группами нуклеаз являются следующие.
Дезоксирибонуклеазы I (дезоксирибонуклеинат-5'-олигонуклеотидгидролазы) ускоряют гидролиз фосфодиэфирных связей в ДНК между остатком фосфата и 3'-углеродным атомом остатка дезоксирибози: ДНК+(n — 1) Н2O→n олигодезоксирибонуклеотидов.
Представителями ДНКаз I являются панкреатические ДНКазы (М~31000). Первичная структура панкреатической ДНКазы быка расшифрована: она представлена одной полипептидной цепью из 257 аминокислотных остатков. Оптимум pH лежит между 6,8 и 8,0. Фермент активируется ионами Мn2+ и Mg2+ и ингибируется анионами, связывающими указанные катионы, а также олигонуклеотидами. Механизм действия панкреатических ДНКаз на ДНК таков, что вначале осуществляются в основном разрывы фосфодиэфирных связей в одной из цепей ДНК. Парные разрывы очень редки, поэтому деполимеризация идет не сразу. Конечный продукт переваривания ДНК панкреатической ДНКазой содержит следы дезоксирибонуклеозид-5'-фосфатов, немного динуклеотидов и большое количество олигодезоксирибонуклеотид-5'- фосфатов, составленных в среднем из 4 мономерных звеньев. Панкреатическая ДНКаза быка существует в виде четырех множественных форм.
Дезоксирибонуклеазы II (дезоксирибонуклеинат-3'-олигонуклеотидгидролазы) в качестве конечного продукта действия образуют олигодезоксирибонуклеотид-3'-фосфаты со средней длиной молекул в 6 звеньев и небольшие количества дезоксирибонуклеозид-3'-фосфатов. Молекулярная масса ДНКазы II селезенки 38 000, оптимум pH 4,5—5,5. Ее молекула состоит из 343 аминокислотных остатков и содержит углеводную компоненту, структурной единицей которой является глюкозамин. Фермент активируется ионами Mg2+, ингибируется ионами SO2-4, РО3-4, AsO3-4, АУ-кополимером, тРНК. Деполимеризация ДНК осуществляется путем парных разрывов фосфодиэфирных связей в молекуле ДНК, в результате чего быстро накапливаются ее большие фрагменты; особенно хорошо атакуются связи, составленные из парных сочетаний ГГ и АЦ. Предполагают, что ДНКазы II являются димерами.
Кроме ДНКазы I и II существует большая группа эндонуклеаз, атакующих как дву-, так и одноцепочечную ДНК. Так, например, у кишечной палочки их 7, среди них—4 низкомолекулярные (12—33 тыс. Да) и 3 высокомолекулярные (68—114 тыс. Да).
Экзодезоксирибонуклеазы ускоряют реакцию гидролиза молекул ДНК с образованием дезоксирибонуклеозид-5'-фосфатов. Из кишечной палочки выделено и очищено в разной степени 8 экзодезоксирибонуклеаз (I—VIII), отличающихся друг от друга по определенным показателям. В частности, экзодезоксирибонуклеаза III (М = 30000) обладает способностью отщеплять 3'-фосфат, если он есть, от концевого нуклеотида фрагментов молекулы ДНК.
Рестриктазы — ДНКазы бактериального происхождения, расщепляющие чужеродные (фаговую) ДНК в строго определенных зонах, которые «узнаются» ферментом. Эти зоны имеют палиндромную структуру. Ниже приведены два примера, где стрелками указаны точки гидролиза фосфодиэфирных связей:

В зависимости от взаимного расположения места узнавания и точки расщепления ДНК рестриктазами, их относят к I типу (сайт узнавания далеко, на расстоянии сотен н. о. от точки расщепления), II типу (расщепление внутри сайта узнавания) или III типу (расщепление вблизи сайта узнавания). К 1993 году выделено и охарактеризовано 2393 рестриктазы I типа, 188 рестриктаз II типа и только 4 рестриктазы III типа. Всего следовательно изучено 2585 рестриктаз.
Так как рестриктазы расщепляют ДНК на ограниченное число фрагментов, они нашли применение для определения первичной структуры ДНК. Однако еще более важная область их практического использования — генетическая инженерия, так как именно благодаря действию рестриктаз из ДНК выщепляются фрагменты, которые далее встраиваются в бактериальную ДНК, становятся интегральной частью бактериального генома и приносят бактерии новые, не свойственные ей ранее биохимические признаки, такие, например, как способность синтезировать интерферон, инсулин и другие белки, находящие широкое применение в медицине (рис. 81). В принципе, такие процессы возможны и в геноме высших организмов. Легкое встраивание рестрикционных фрагментов ДНК в реципиентную ДНК (т. е. ДНК, включающую эти фрагменты в свой состав) объясняется тем, что при действии рестриктаз в точке разрыва молекулы ДНК получаются «липкие», комплементарные концы. Ввиду огромной теоретической ценности и большого практического значения этих работ в нашей стране начиная с 1975 г. осуществляются комплексные исследования по проекту «Рестриктаза», который планируют на последующих этапах работы превратить в более широкий проект «Нуклеаза» и привлечь к его разработке различные научно-исследовательские институты. В 1980 г. большая группа советских ученых была удостоена Государственной премии за разработку регламентов получения 30 рестриктаз и внедрение их в практику работ по генетической инженерии.
Рибонуклеази I (рибонуклеинат-3'-пиримидино-олигонуклеотидгидролазы) — эндонуклеазы, ускоряющие реакцию гидролиза РНК по пиримидиновым нуклеотидным остаткам. Ранее их относили к рибонуклеат-нуклеотидо-2'-трансферазам циклизующим, но, поскольку 2', 3'-циклофосфаты в процессе их действия образуются как промежуточные продукты, гидролиз которых до 3'-фосфатов ускоряется тем же ферментом, в настоящее время рибонуклеазы (РНКазы) I включены в класс гидролаз.
Представителями РНКаз I являются панкреатические РНКазы, выделенные из многих объектов. Установлена первичная структура панкреатической РНКазы быка, свиньи, овцы, жирафа, марала, косули, северного оленя, лани, шиншиллы, мыши, крысы, морской свинки, одногорбого верблюда и нутрии. Во всех случаях, за исключением двух последних, фермент состоит из 124 аминокислотных остатков. Выяснена третичная структура некоторых панкреатических РНКаз. Панкреатические РНКазы могут быть однокомпонентными (рибонуклеаза А) и дьухкомпонентными (рибонуклеаза В, содержащая углеводный остаток с М = 1350). Механизм действия их на РНК детально исследован и является ярким дополнением к материалам гл. III, касающимся механизма действия ферментов.
Полипептидная цепь РНКазы, замкнутая четырьмя дисульфидными мостиками (рис. 82,А), принимает вследствие этого пространственную конфигурацию (рис. 82,2Б), в определенной мере предопределяющую третичную структуру (рис. 82,2В) этого фермента. Понять механизм действия панкреатической РНКазы помогли данные о структуре ее активного центра (рис. 82, Г). В нем связываются участки молекулы РНК, содержащие в своем составе пиримидиновые (цитидиловые и уридиловые) нуклеотидные остатки, причем парные сочетания ЦА, ЦГ, ЦЦ и ЦУ атакуются в пропорции 3000:500:240:27. В активном центре фермента остаток пиримидинового нуклеотида РНК размещается таким образом, что пиримидиновое основание закрепляется в субстратном центре за счет водородных связей с радикалами тре и сер, занимающими 45-е и 123-е положения в полипептидной цепи и за счет гидрофобного взаимодействия с радикалом фен (120-й аминокислотный остаток). Вследствие этого остаток фосфата, расположенный между 3'-углеродным атомом рибозы пиримидинового нуклеотида и 5'-углеродным атомом соседнего в цепи РНК нуклеотида, фиксируется между 12-м и 119-м остатками гис каталитического центра. Фиксации межнуклеозидного фосфата в этом положении способствует также радикал лиз, занимающий в молекуле РНКазы 41-е положение, но расположенный в ее активном центре на расстоянии 0,5 нм от вышеупомянутых остатков гис. Вслед за этим наступает непосредственно каталитический акт, осуществляемый в результате согласованной передачи протонов и сводящийся к разрыву межнуклеотидной фосфатной связи, образованию 2', 3'-циклофосфата рибозы пиримидинового нуклеотида и последующего гидролиза 2', 3'-циклофосфатной связи с восстановлением исходной структуры активного центра (см. схему реакции).
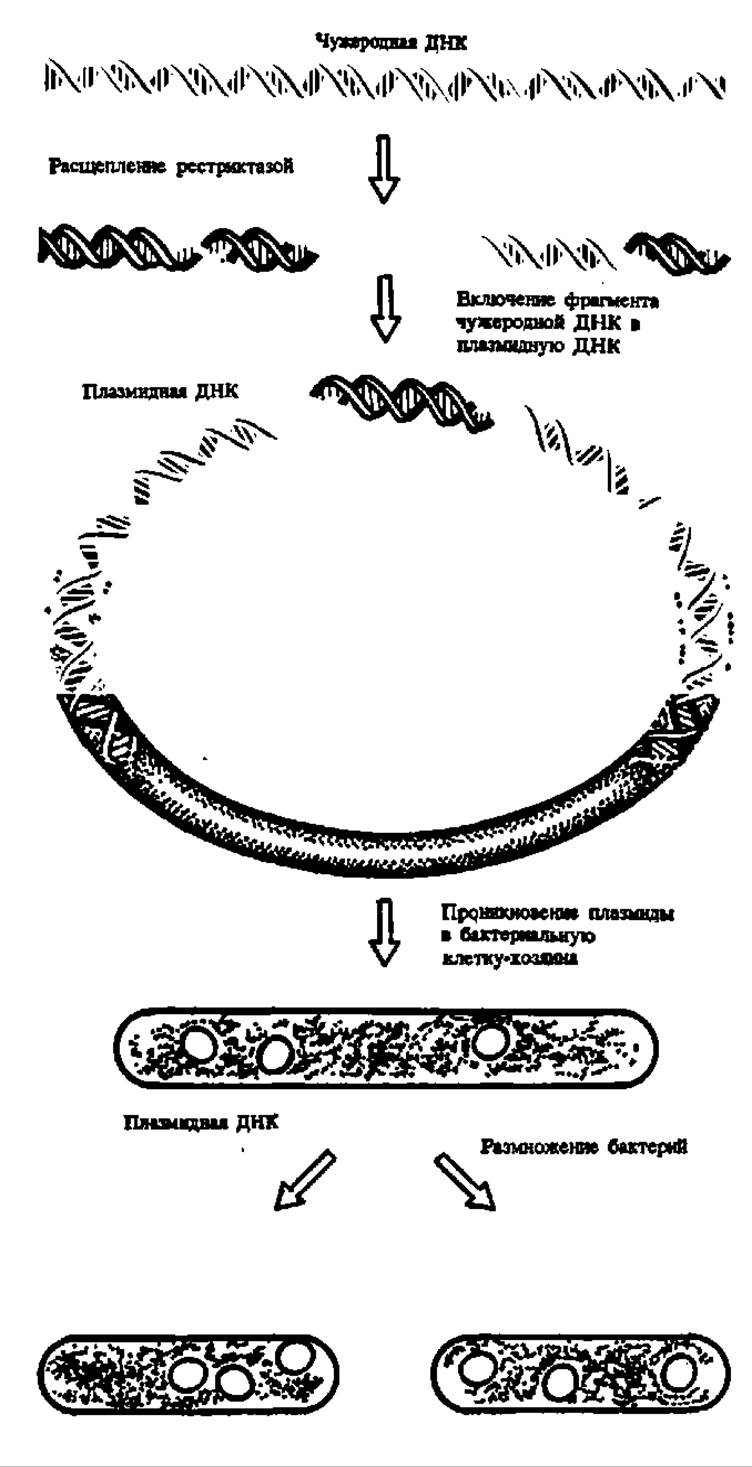
Рис. 81. Принципиальная схема проведения работ по генетической инженерии
В качестве фрагментов чужеродных ДНК используют гены, ответственные за биосинтез биологически значимых белков; их экспрессия может быть использована для биосинтеза этих белков после интеграции плазмидной ДНК в бактериальный геном или дли клонирования генов и их последующей экспрессии ж иных, чем бактериальные, белоксинтезирующих системах
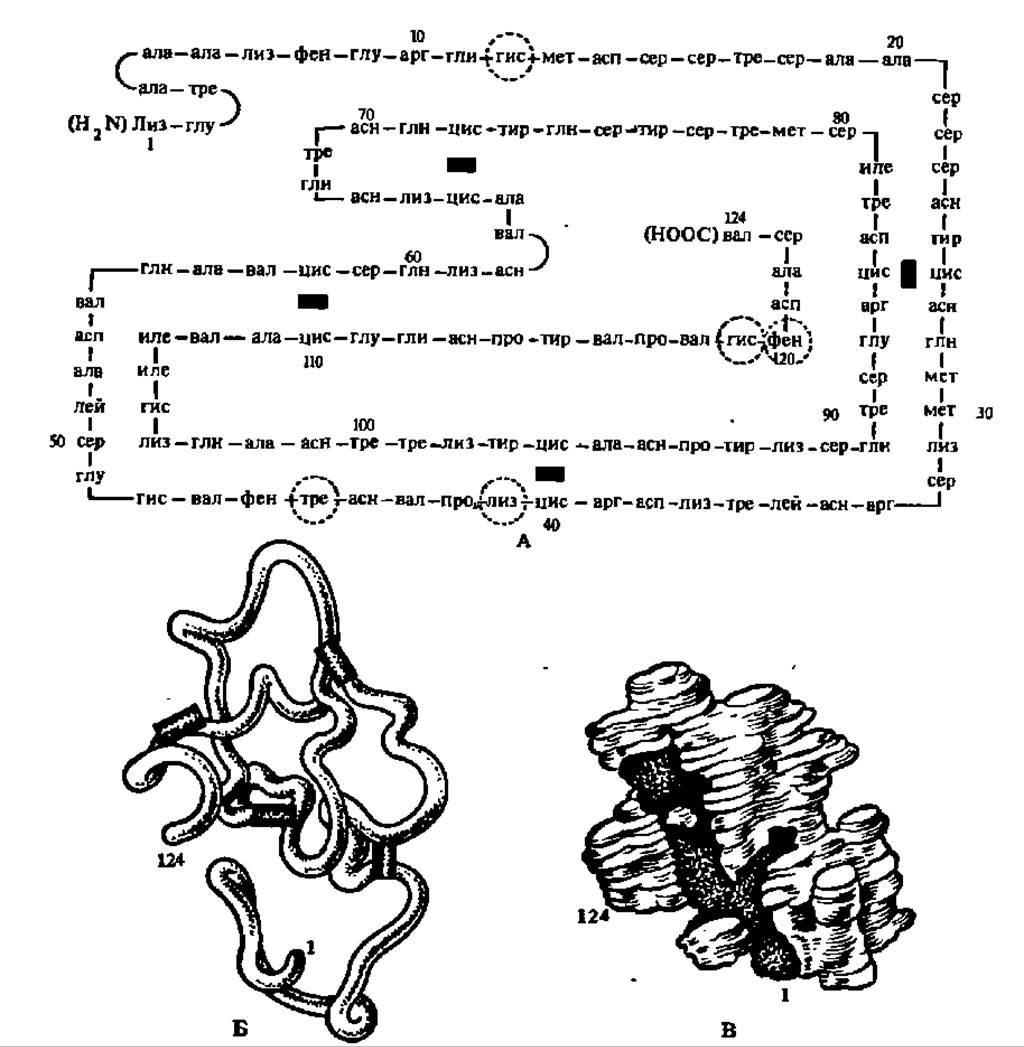
Рис. 82. Структура бычьей панкреатической рибонуклеази и ее активного центра:
А — первичная структура; черными прямоугольниками обозначены—S—S-связи, арабскими цифрами — номера аминокислотных остатков, пунктиром обведены аминокислотные остатки, входящие в состав активного центра; Б — расположение в пространстве полипептидной цепи; В — трехмерная модель молекулы при разрешении в 0,5 нм; зачернена впадина, на дне которой располагается активный центр; Г — структура активного центра, в котором радикалы гис, лиз, фен, сер и тре (их порядковые номера
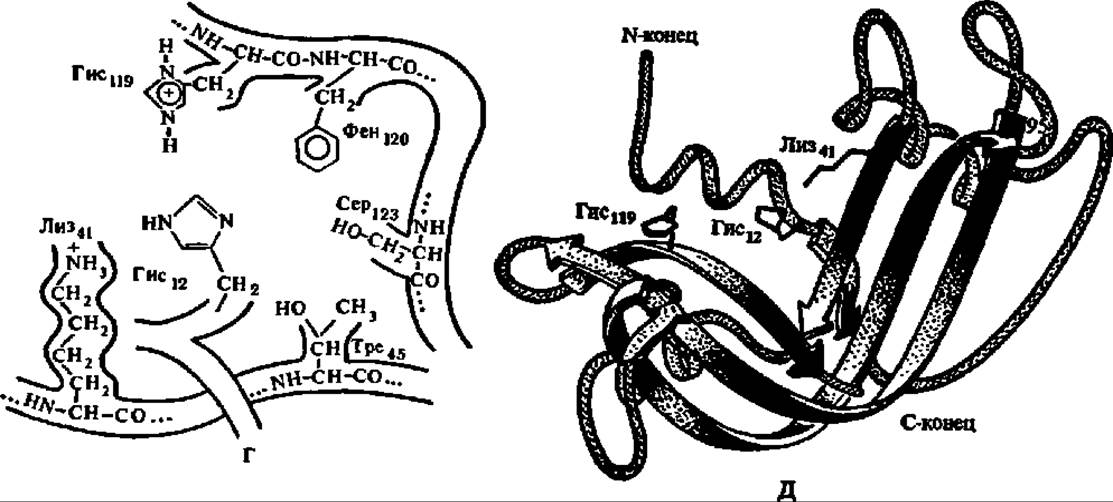
Рис. 82. Продолжение в полипептидной цепи указаны цифровыми индексами) сближены на расстояние в несколько десятых долей нанометра; Д — пространственная структура активного центра
Существенно, что именно остатки гис, находящиеся в 12-м и 119-м положениях в полипептидной цепи и сближенные в каталитическом центре фермента, обеспечивают перенос протонов.
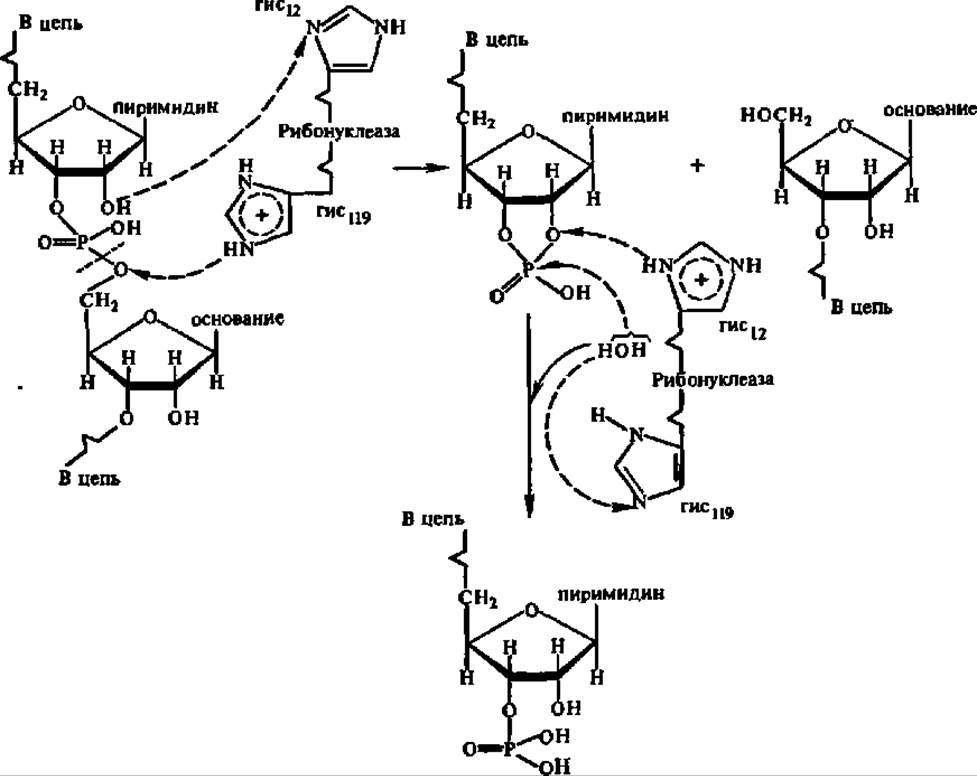
Эта функция имидазольных радикалов гистидина воспроизводится при рассмотрении механизма действия многих других ферментов, особенно гидролаз (см раздел о гидролизе пептидной связи — с. 263, гликозидной связи — с. 331).
Гуанилрибонуклеазы (рибонуклеинат-3'-гуапило-олигонуклеотидгидролазы) ускоряют гидролиз связей по 5'-углеродному атому рибозы остатка гуаниловой кислоты и межнуклеотидного фосфата в молекуле РНК, образуя гуанозин-3'-фосфат и олигонуклеотиды с остатком гуанозин-3'-фосфата в качестве концевого нуклеотида. Первичная структура гуанилрибонуклеазы, выделенной из плесневого гриба аспергилла (Т1-РНКаза), расшифрована (М = 11000; 104 аминокислотных остатка).
Фермент нашел широкое применение для деструкции РНК при определении их первичной структуры, и именно при посредстве T1-РНКазы Р. Холли с сотр. (1965) впервые получили крупные фрагменты тРНКала (см. с. 213).
Охарактеризовано еще 10 эндорибонуклеаз, выделенных из бактерий, микроскопических грибов, растений и животных.
Как и в случае ДНКаз, существует большая группа (более десяти) экзорибонуклеаз, ускоряющих реакции отщепления рибонуклеотидов по концевым остаткам РНК, и олигорибонуклеотидов, возникающих при селективном гидролизе РНК под действием эндорибонуклеаз. Таким образом, в результате деятельности разнообразных нуклеаз нуклеиновые кислоты при распаде дают сложную смесь индивидуальных рибо- и дезоксирибонуклеозид-3' и 5'-фосфатов.
Кроме перечисленных ферментов в деструкции нуклеиновых кислот принимают участие еще некоторые энзимы, не являющиеся гидролизами фосфодиэфирных межнуклеотидных связей, например полинуклеотидфосфорилаза и урацил-ДНК-гликозидаза.
Полинуклеотидфосфорилаза (полинуклеотид: ортофосфат-нуклеотидил-трансфераза) в отличие от всех ранее рассмотренных ферментов, участвующих в деструкции нуклеиновых кислот, является нуклеотидилтрансферазой, т. е. переносит нуклеотидные остатки с 3'-конца РНК на неорганический фосфат с образованием нуклеозиддифосфатов (НДФ):
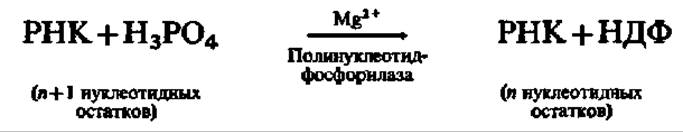
Фермент открыт М. Грюнберг-Монаго и С. Очоа (1955) и выделен из многих источников. Он сосредоточен главным образом в микросомальной и рибосомальной фракциях клеточного содержимого. По грубой оценке его молекулярная масса близка к 230 000. Скорость реакции фосфоролиза зависит от конформации и нуклеотидного состава РНК: двухцепочечные и метилированные участки устойчивы к действию фермента. Предполагают, что in vivo полинуклеотидфосфорилаза обеспечивает деградацию клеточных РНК, особенно мРНК, до нуклеозиддифосфатов, регулирует концентрацию неорганического фосфата в клетке и поставляет необходимое количество НДФ для превращения их в дезоксиНДФ.
Фермент обладает замечательной особенностью: из нуклеозиддифосфатов и их смесей in vitro он обеспечивает синтез полирибонуклеотидов с соотношением в их составе мономерных звеньев в той же пропорции, как в исходном растворе. Поэтому полинуклеотидфосфорилазу широко применяли для синтеза полирибонуклеотидов того или иного состава, что сыграло выдающуюся роль в расшифровке кода белкового синтеза.
Урацил-ДНК-гликозидаза ускоряет реакцию отщепления остатка У от поврежденной ДНК, где произошло дезаминирование остатка Ц. На возникшем апиримидиновом участке одной из цепей ДНК фосфодиэфирная связь гидролизуется с элиминированием дезоксирибозы, 3'-фосфат отщепляется при участии экзодезоксирибонуклеазы III и вместо отсутствующего нуклеотидного остатка встраивается новый, в данном случае остаток цитидиловой кислоты, при посредстве ДНК-полимеразной и ДНК-лигазной реакции (см. с. 251 и рис. 84).
ДНК-гликозидазы представляют новую группу ферментов, участвующих в обмене ДНК. При их посредстве удаляются и иные модифицированные пуриновые и пиримидиновые основания, после чего в серии последующих реакций восстанавливается исходная структура ДНК, т. е. эта группа ферментов имеет существенное значение в репарации (восстановлении структуры) ДНК. Это происходит, в частности, при замене метилированных пуриновых и пиримидиновых оснований, так как наряду с урацил-ДНК-гликозидазой изучена 3-метиладенин-ДНК-гликозидаза. Всего открыто уже 8 ДНК-гликозидаз.
Обмен нуклеозидфосфатов. Дезоксирибонуклеозидфосфаты и рибонуклеозидфосфаты, представляющие собой конечные продукты ферментативной деструкции нуклеиновых кислот, распадаются далее до еще более простых соединений. Первая ступень этого распада состоит в отщеплении остатка фосфорной кислоты:
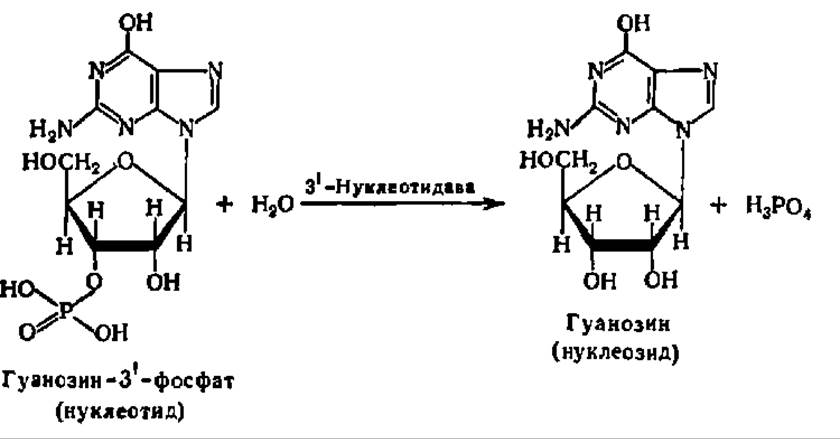
На второй ступени распада осуществляется перенос остатка рибозы от нуклеозида на фосфорную кислоту. Эта реакция ускоряется специфическими для каждого вида нуклеозидов рибозилтрансферазами. Примером может служить фосфоролиз уридина:
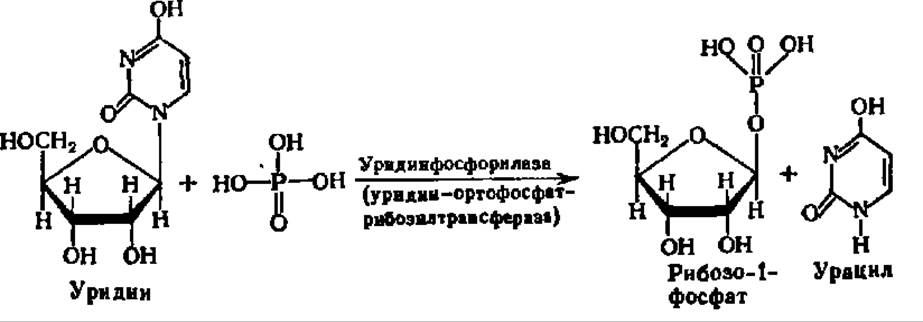
Уридинфосфорилаза имеет М = 165кДа, содержит 6 субъединиц по 27,5 кДа, каждая из которых составлена из 253 аминокислотных остатков, в том числе из семи остатков гистидина; два из них (8-ой и 122-ой) входят в активный центр фермента.
Следовательно, в результате распада нуклеозидфосфатов выделяются в свободном состоянии рибозо-1-фосфат и все виды пуриновых и пиримидиновых оснований, участвующих в построении нуклеиновых кислот. Приведенная схема распада нуклеозидов не является единственной. Возможны и другие пути распада нуклеозидов. Один из них состоит в гидролизе нуклеозидов, например:
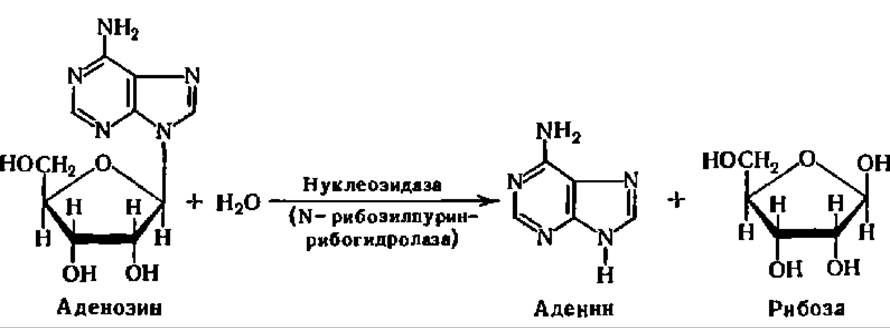
В свою очередь, и углевод и азотистые основания видоизменяются далее. Рибоза и рибозо-1-фосфат включаются в реакции обмена, характерные для углеводов. Эти реакции будут рассмотрены ниже. Пуриновые и пиримидиновые основания претерпевают дальнейший распад и превращаются в те или иные простейшие азотсодержащие продукты, которые далее либо выводятся из организма, либо откладываются в нем.
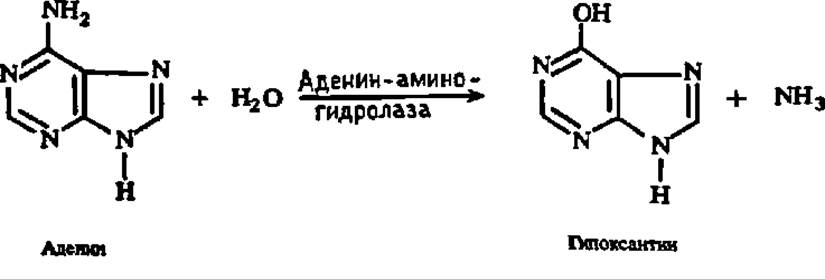
Распад пуриновых и пиримидиновых оснований. Первая фаза распада пуриновых и пиримидиновых оснований заключается в дезаминировании тех из них, которые обладают аминогруппами. Этот процесс осуществляется при посредстве специфических аминогидролаз. В результате аденин превращается в гипоксантин:
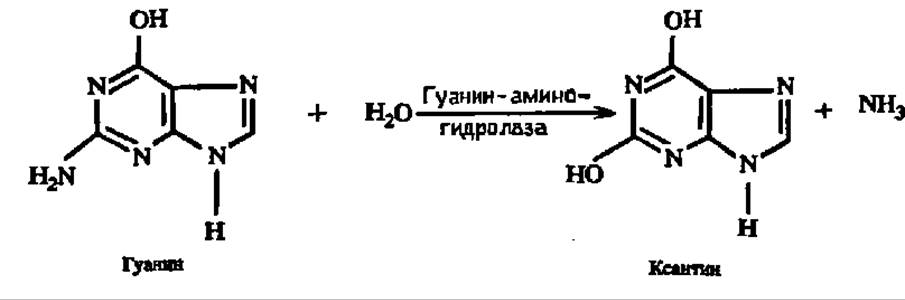
Гуанин переходит в ксантин:
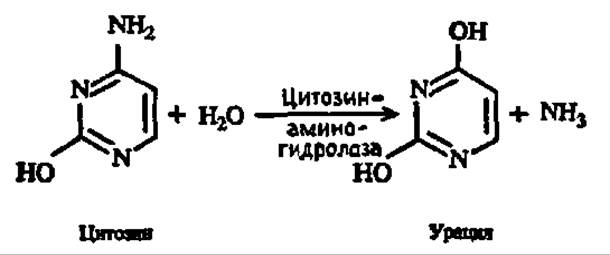
Цитозин преобразуется в урацил:
Дезаминирование идет не только на уровне свободных пуриновых и пиримидиновых оснований, но и на уровне нуклеозидов и нуклеотидов, причем во втором случае с большей интенсивностью, так как соответствующие нуклеозид- и нуклеотид-аминогидролазы более активны, чем пурин- или пиримидин-аминогидролазы. Так, аденозин и аденозинфосфат более энергично превращаются в инозин и инозинфосфат, чем аденин в гипоксантин:
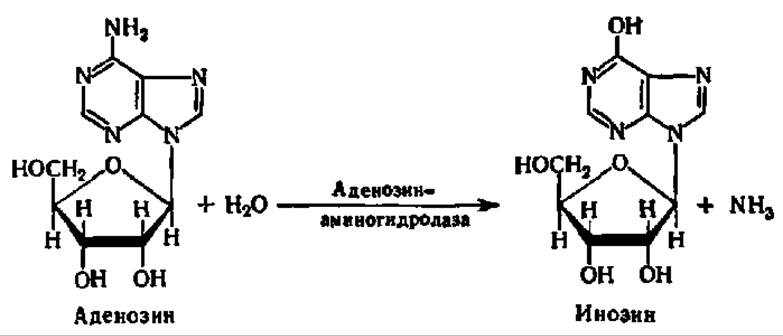
При дальнейшем распаде дезаминированных нуклеозидов и нуклеотидов из их состава освобождаются гипоксантин, ксантин или урацил.
Дальнейшая судьба дезаминированных пуриновых и пиримидиновых оснований различна. Гипоксантин и ксантин окисляются в мочевую кислоту:
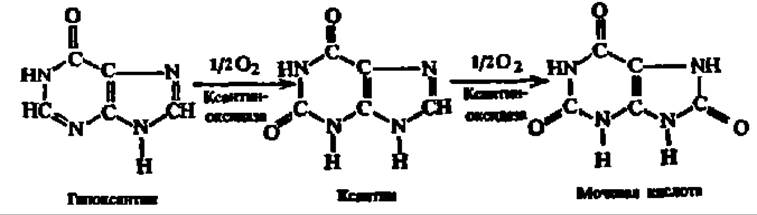
Реакция окисления гипоксантина в ксантин, а последнего — в мочевую кислоту ускоряется ксантиноксидазой — оксидоредуктазой с широким спектром действия, представляющей собой молибденсодержащий флавопротеин.
Фермент из разных источников обладает молекулярной массой от 280 тыс. до 360 тыс. Да и при действии диссоциирующих агентов распадается на две идентичные субъединицы, каждая из которых содержит одну молекулу ФАД, один атом Мо и 4 атома негеминового железа, связанных с лабильными атомами серы в кластеры типа Fe2S2. Активированные гипоксантин и ксантин восстанавливают молибден, последний быстро восстанавливает F2S2-клacтep и, наконец, флавин восстанавливает молекулярный кислород.
У ряда животных (человекообразные обезьяны, птицы, рептилии, тутовый шелкопряд) и человека конечным продуктом распада пуриновых оснований является мочевая кислота, которая и выводится из организма. Однако у большинства животных и растений есть ферменты и ферментные системы, способные ускорять реакции дальнейшего распада мочевой кислоты. От названия мочевой кислоты acidum uricum и по характеру действия, выражающемуся в расщеплении (лизисе) ее, эти ферменты получили наименование ферментов уриколиза. В одних случаях (млекопитающие, насекомые) уриколиз сводится к окислению мочевой кислоты в аллантоин; в других (костистые рыбы) — процесс более сложен: аллантоин превращается в аллантоиновую кислоту, а последняя (амфибии, большинство растений) распадается на мочевину и глиоксиловую кислоту:
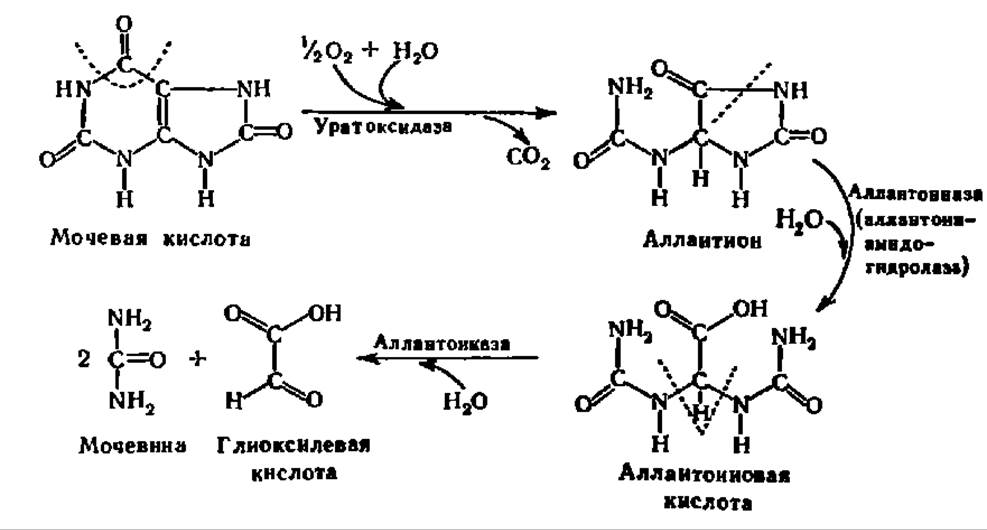
В отличие от гипоксантина и ксантина дезаминированные пиримидиновые основания подвергаются восстановлению. Так, урацил переходит в дигидроурацил; донором атомов Н в этой реакции служит НАДН. В свою очередь, дигидроурацил претерпевает гидролиз и превращается в N-карбамил-β-аланин, который далее гидролизуется до ß-аланина и карбаминовой кислоты. Последняя либо используется для синтеза мочевины, либо распадается до СО2 и NH3. Все перечисленные реакции ускоряются соответствующими ферментами:
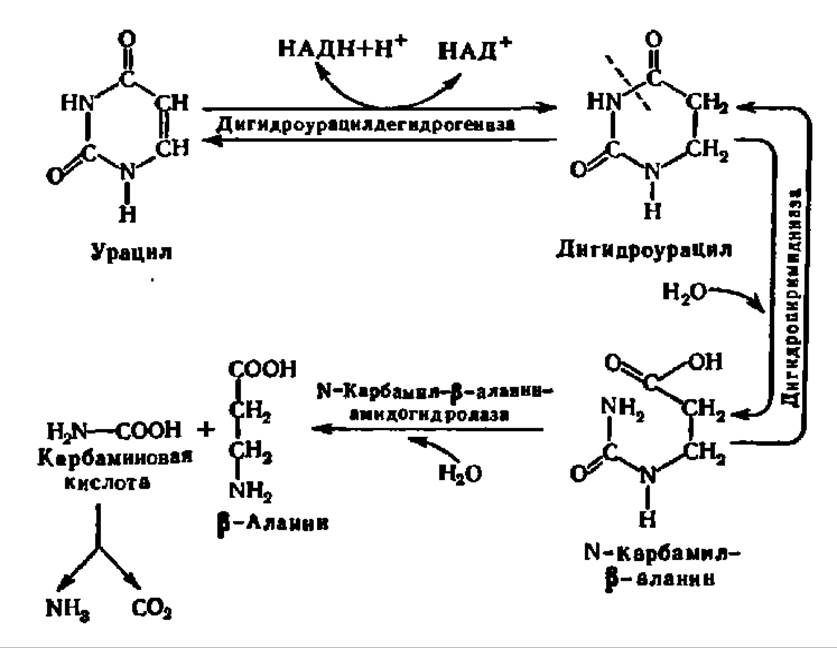
Карбаминовая кислота и ß-аланин являются конечными продуктами распада двух пиримидиновых оснований — У и Ц. В случае Т, распадающегося по такой же схеме, вместо ß-аланина образуется ß-аминоизомасляная кислота.
Итак, огромные, сложные молекулы полидезоксирибонуклеотидов и полирибонуклеотидов в процессе распада в организмах животных и растений превращаются в очень простые соединения — главным образом фосфорную кислоту, СО2 и NH3. У организмов, расположенных на нижних ступенях эволюционной лестницы, представлен всегда полный набор ферментов, обеспечивающих распад нуклеиновых кислот именно до этих простейших продуктов. При переходе к более высокоорганизованным формам ряд ферментов, участвующих в превращении пуриновых и пиримидиновых оснований, выпадает и конечными продуктами обмена нуклеиновых кислот у некоторых групп организмов являются более сложные соединения, чем NH3 и СО2; это мочевина, аллантоиновая кислота, аллантоин и мочевая кислота.
Механизм биосинтеза нуклеозидфосфатов. Для обеспечения биосинтеза нуклеиновых кислот организм должен располагать полным набором дезоксирибо- и рибонуклеозидтрифосфатов. Поэтому в любой клетке любого организма независимо от положения его на эволюционной лестнице беспрепятственно осуществляется процесс новообразования всех видов нуклеозидтрифосфатов, нуклеозиддифосфатов и нуклеозидмонофосфатов.
Из трех основных частей нуклеотида — азотистого основания, пентозы и фосфорной кислоты — последняя в норме всегда присутствует в клетках, а вторая неминуемо возникает в процессе распада углеводов. Таким образом, только первая составная часть нуклеотида — пуриновое или пиримидиновое основание, должна создаваться специфическим путем.
Пути возникновения пуриновых и пиримидиновых оснований различны. Но есть некоторые черты сходства в механизмах их синтеза. К их числу относятся: 1) широкое использование гли, асн и глн в качестве источников азота гетероциклических колец; 2) включение в состав пуриновых и пиримидиновых циклов атомов углерода из СО2 и формиата; 3) построение пуринового основания и завершение синтеза пиримидинового основания на рибозо-5-фосфате, в результате чего конечными продуктами биосинтеза являются сразу нуклеозид-5'-фосфаты, а не свободные А, Г, У, Ц и Т; 4) ферментативный характер всех реакций, осуществляющихся в процессе новообразования нуклеотидов; 5) возникновение на определенном этапе биосинтеза предшественников, из которых потом формируются уже индивидуальные нуклеозид-5'-фосфаты.
Рассмотрим сначала механизм биосинтеза пиримидиновых оснований. Подготовительной реакцией, открывающей этот синтез, является реакция образования карбамилфосфата из NH3 и СО2 при участии АТФ:
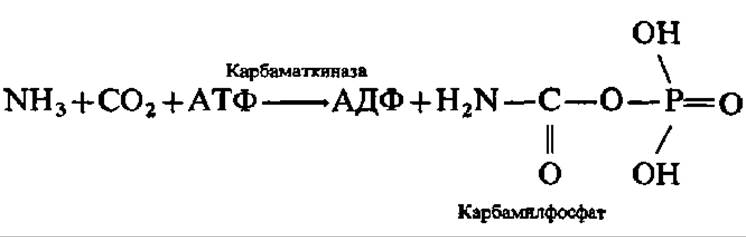
Далее при участии специфического фермента остаток карбаминовой кислоты (карбамил) переносится на аминогруппу аспарагиновой кислоты с образованием карбамиласпарагиновой кислоты. Эту реакцию рассматривают как первую специфическую реакцию в синтезе пиримидиновых нуклеотидов:
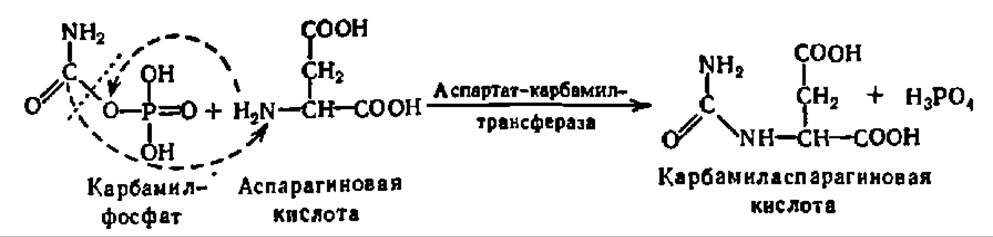
При сближении NH2- и СООН-групп в молекуле карбамиласпарагиновой кислоты между ними осуществляется взаимодействие с выделением молекул воды. Эта реакция катализируется ферментом из класса гидролаз — дигидрооротазой, названной так от дигидрооротовой кислоты, гидролиз которой она ускоряет вследствие обратимости данной реакции:
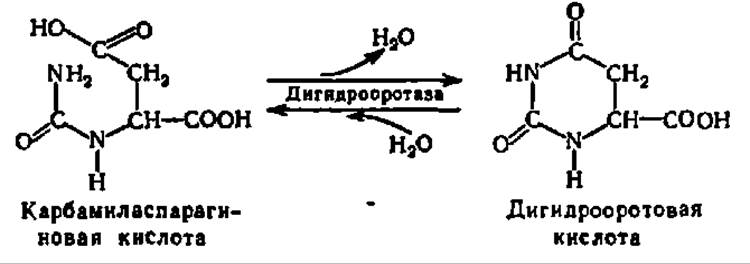
Дигидрооротовая кислота ферментативно окисляется. Снятие двух атомов Н осуществляется первичной дегидрогеназой либо с НАД+ или НАДФ+, либо с ФАД в качестве кофермента:
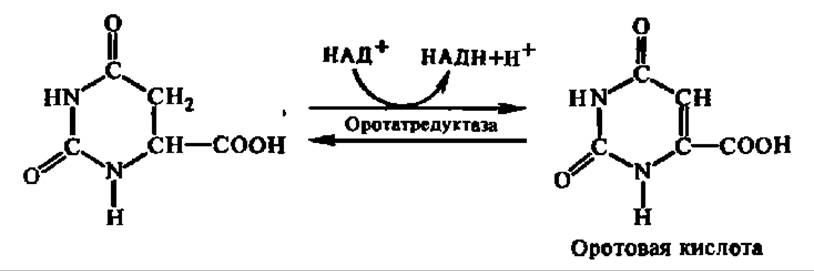
В молекуле оротовой кислоты, как видно из ее формулы, уже предобразована структура одного из пиримидиновых оснований, а именно урацила. Достаточно осуществить реакцию декарбоксилирования, и оротовая кислота превратится в урацил. Однако этот процесс происходит лишь после того, как оротовая кислота соединится с рибозой, образуя нуклеозид, где агликоном является остаток оротовой кислоты. Нуклеозид такого строения называется оротидином (по аналогии с цитидином и уридином). Так как реакция идет непосредственно между оротовой кислотой и 5-фосфорибозилпирофосфатом, то в ее результате возникает оротидин-5'-фосфат. Процесс ускоряется соответствующей трансгликозидазой. Уравнения реакций, приводящих к синтезу оротидин-5'-фосфата, таковы:
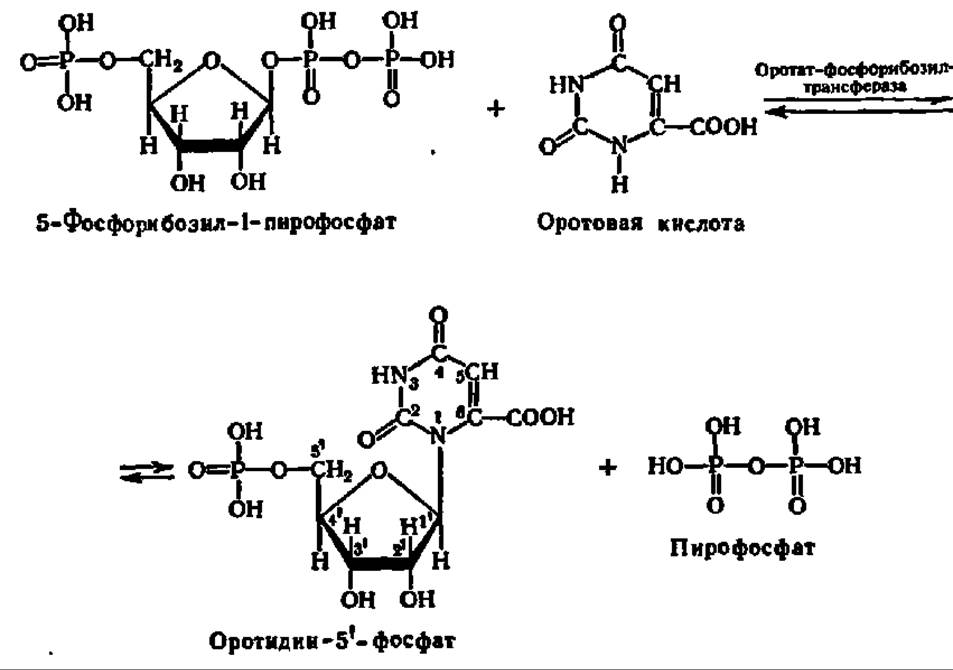
Последнее преобразование состоит в декарбоксилировании оротидин-S'-фосфата:
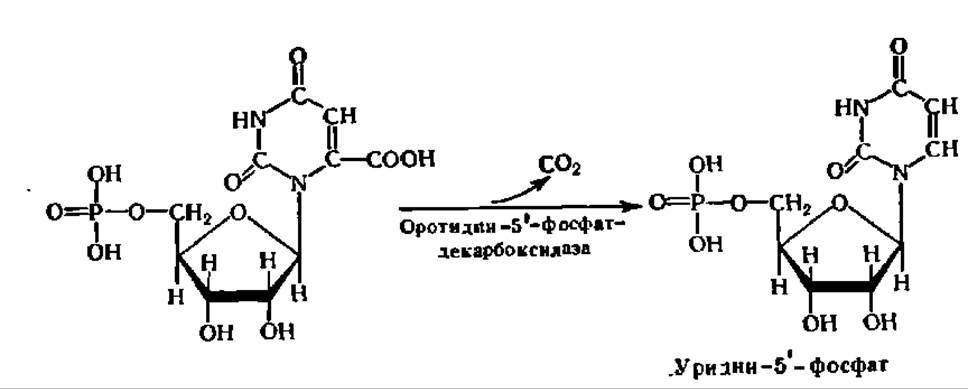
В результате возникает один из пиримидиновых нуклеотидов — уридин-5'-фосфат. Уридин-5'-фосфат занимает центральное место в биосинтезе пиримидиновых нуклеотидов, так как далее может превращаться в другие пиримидиновые нуклеотиды в соответствии со следующей схемой:
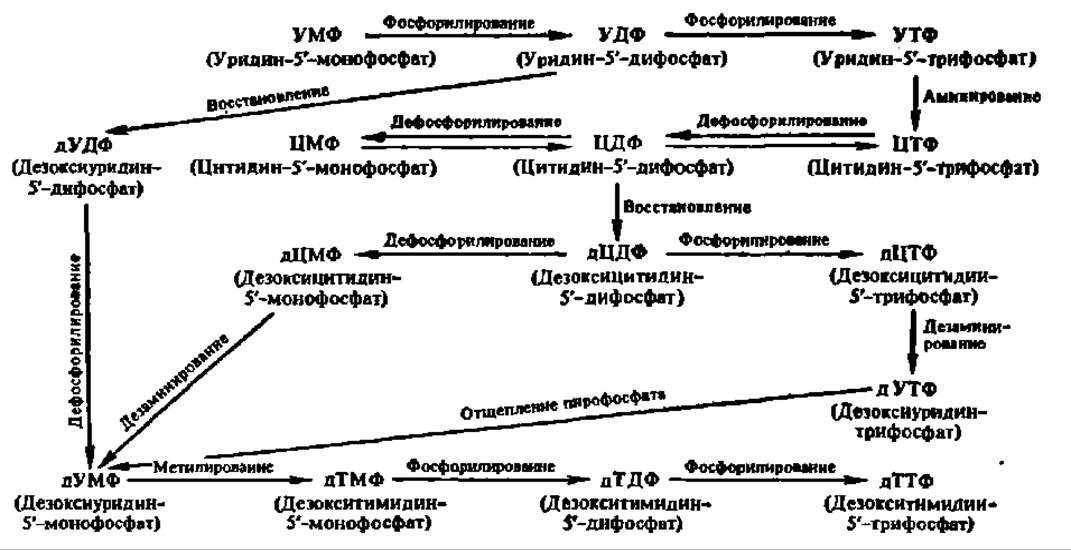
Схема 2. Пути превращений пиримидиновых нуклеотидов
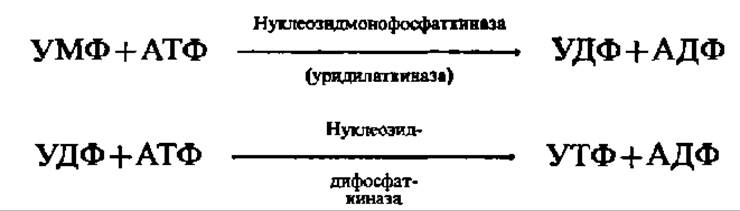
Эти превращения пиримидиновых нуклеотидов осуществляются путем реакций восстановления, аминирования и метилирования моно-, ди- и трифосфорных эфиров нуклеозидов. Последние образуются при взаимодействии нуклеозидмонофосфатов с АТФ, запасы которой в клетках непрерывно пополняются за счет реакции окислительного фосфорилирования. Например:
Восстановление протекает по гидроксильной группе при 2-м углеродном атоме рибозы, благодаря чему остаток рибозы переходит в остаток дезок- сирибозы. Эта реакция свойственна нуклеозиддифосфатам:
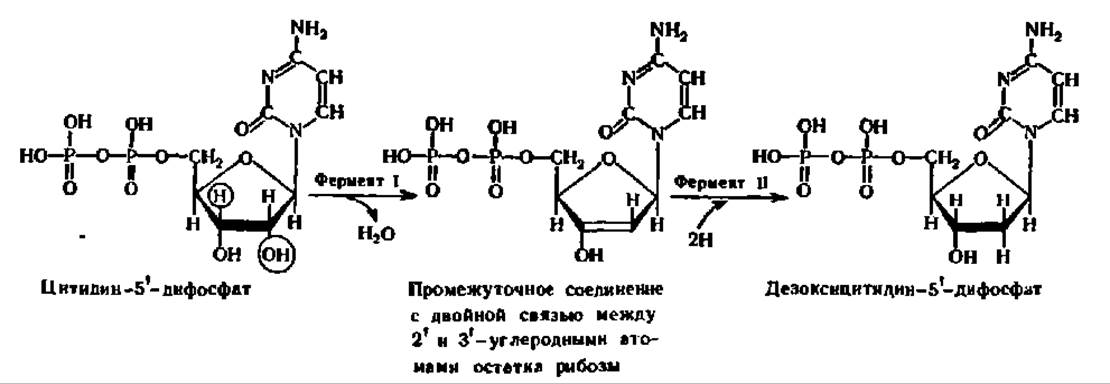
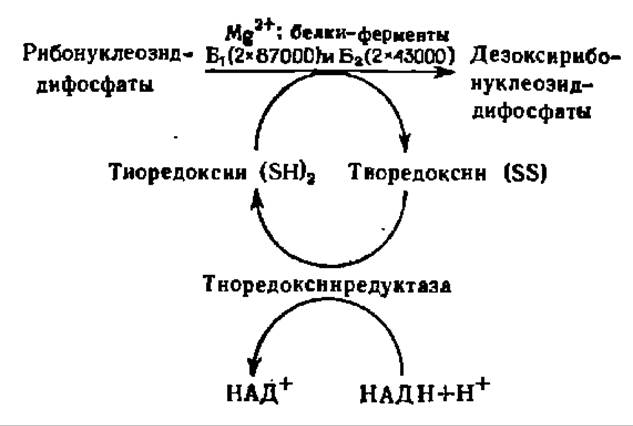
Донором атомов Н для восстановления рибозы при превращении рибонуклеозиддифосфата в дезоксирибонуклеозиддифосфат служит специальный белок — тиоредоксин. Будучи составлен из 108 аминокислотных остатков, тиоредоксин содержит в 32-м и 35-м положениях остатки цис и располагает, следовательно, двумя HS-группами. Именно они и поставляют атомы Н, образуя дисульфидный мостик. Окисленный тиоредоксин немедленно переводится в восстановленную форму, получая атомы Н от НАДН при посредстве фермента тиоредоксинредуктазы.
Кроме обеспечения атомами Н реакции восстановления остатка рибозы, тиоредоксин в восстановленном состоянии способен соединяться с двумя другими каталитически активными белками и Б2. Последние при этом активируются и непосредственно ускоряют процесс восстановления остатка рибозы. Они же подвержены сильному влиянию других аллостерических регуляторов активности, в частности АТФ, ГТФ, ТТФ, дАТФ, дГТФ и др.
Таким образом, превращение рибонуклеозиддифосфатов в дезоксирибонуклеозиддифосфаты идет в соответствии со следующей схемой:
Что касается реакций аминирования (переход от УТФ к ЦТФ) и метилирования (переход от дУМФ к дТМФ), то в первом случае источником аминогруппы у бактерий служит NH3, а у млекопитающих — глн, причем введение аминогруппы осуществляется сопряженно с распадом АТФ; во втором случае источником метильной группы является N5-метилтетрагидрофолиевая кислота, а реакция переноса ее ускоряется тимидилат-синтазой (димер; каждая полипептидная цепь — 316 аминокислотных остатков; первичная и третичная структуры расшифрованы).
В результате всех этих реакций обеспечивается создание в организме фонда свободных пиримидиновых нуклеозидтрифосфатов (УТФ, ЦТФ, дЦТФ, дТТФ), необходимых для синтеза ДНК и РНК.
Важной особенностью биосинтеза пиримидиновых нуклеотидов является саморегуляция этого процесса. Установлено, что такие конечные продукты биосинтеза пиримидиновых нуклеотидов, как ЦТФ и дЦТФ, ингибируют деятельность аспартат-карбамилтрансферазы — фермента, ускоряющего первую реакцию в цепи тех взаимодействий, которые приводят к формированию пиримидинового цикла. Выявлено, что понижение активности фермента вызывается присоединением ЦТФ по аллостерическому центру фермента Таким образом, накопление в клетке избыточного количества ЦТФ и дЦТФ немедленно сказывается на активности аспартат-карбамилтрансферазы и биосинтез пиримидиновых нуклеотидов замедляется. Антагонистом ЦТФ в ингибировании деятельности этого фермента является АТФ, активирующая фермент. Следовательно, торможение или стимулирование биосинтеза пиримидиновых нуклеотидов зависит от соотношения в клетках организма АТФ и ЦТФ, т. е. от энергетического баланса клетки, от уровня в ней обмена веществ, в частности от уровня реакций окислительного фосфорилирования, при посредстве которых высвобождающаяся в процессе окисления органических веществ энергия запасается в макроэргических связях АТФ.
Двусторонний контроль деятельности первого в цепи реакций биосинтеза фермента представляет очень четкий механизм регуляции обмена веществ и используется во многих системах биосинтеза в организме. Именно на примере биосинтеза пиримидиновых нуклеотидов он исследован наиболее детально.
В заключение отметим, что одно из производных пиримидиновых нуклеотидов, а именно 3'-азидо-2', 3'-дидезокситимидин, подавляет развитие ретровирусов, в том числе вызывающих синдром приобретенного иммунодефицита (СПИД):
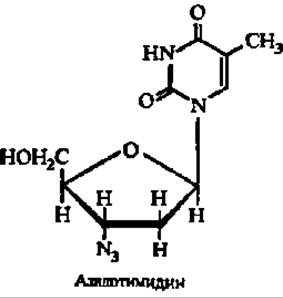
Предложены и другие производные нуклеотидов для борьбы с этим грозным заболеванием.
Перейдем теперь к рассмотрению механизма биосинтеза пуриновых оснований. Формирование пуринового кольца сразу идет на рибозо-5-фосфате. Поэтому первой реакцией является взаимодействие глутамина с 5-фосфорибозил-1-пирофосфатом при каталитическом воздействии гликозилтрансферазы, ускоряющей перенос остатка 5-фосфорибозы на амидогруппу глутамина. Видимо, одновременно протекает гидролиз возникающего 5-фосфорибозилглутамина, вследствие чего выделяется 5-фосфорибозиламин:
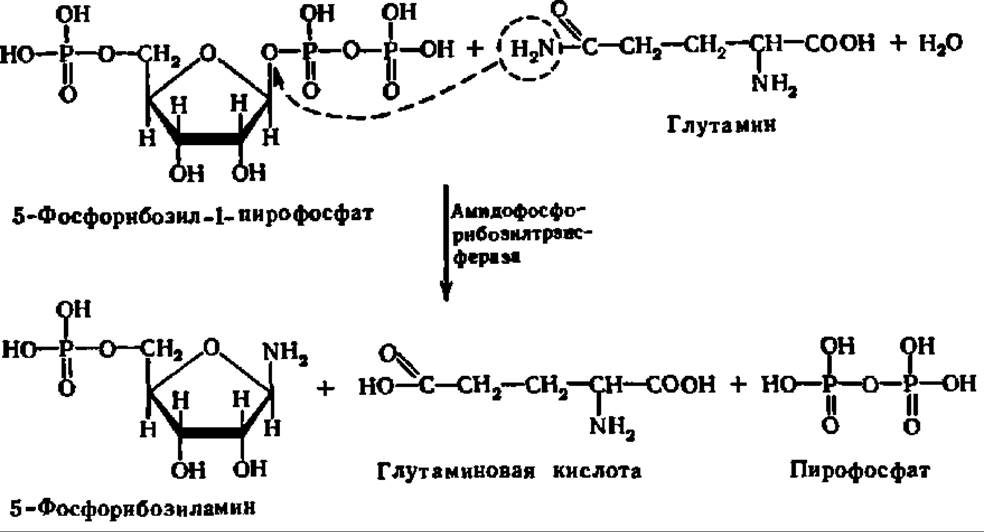
В присутствии АТФ при участии специфической лигазы (аминосинтетаза) к 5-фосфорибозиламину присоединяется глицин, причем возникает пептидная связь:
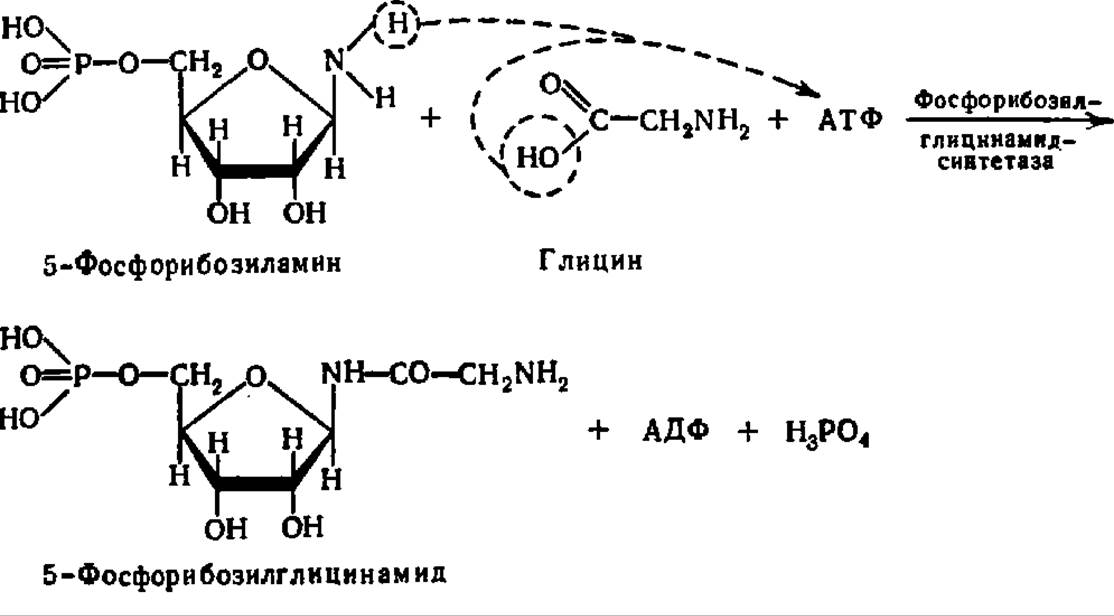
Молекула 5-фосфорибозилглицинамида удлиняется на один углеродный атом при посредстве фосфорибозилглицинамид-формилтрансферазы. Ее коферментом служит тетрагидрофолиевая кислота, присоединяющая формильную группировку по атому азота, занимающему 5-е положение в молекуле кофермента.
С N-формилтетрагидрофолиевой кислоты осуществляется перенос формильного остатка на H2N-гpyппy 5-фосфорибозилглицинамида. Получившийся в результате этой реакции 5-фосфорнбозилформилглицинамцд взаимодействует с глутамином в присутствии сопряженно распадающейся АТФ и соответствующей лигазы (см. два первых уравнения на схеме 3 (с. 242)).
Продуктом реакции является производное, где карбонильный кислород пептидной связи замещен на иминогруппу. Затем в результате ряда преобразований возникшего при этом соединения замыкается имидазольный цикл. Данный процесс также идет сопряженно с распадом АТФ и ускоряется специфическим ферментом, который, будучи выделен и очищен, характеризуется относительно невысокой устойчивостью к денатурации.
Весьма существенно, что реакция, в результате которой образуется имидазольная часть будущего пуринового остатка, практически необратима в отличие от подавляющего большинства остальных стадий рассматриваемого процесса.
Вслед за этим на имидазольном цикле путем ряда ферментативных реакций отмеченного выше типа из аспарагиновой кислоты, СО2 и формиата строится пиримидиновое кольцо, т. е. в конце концов создается пуриновый нуклеотид. Схема, включающая главные этапы этого синтеза, такова:
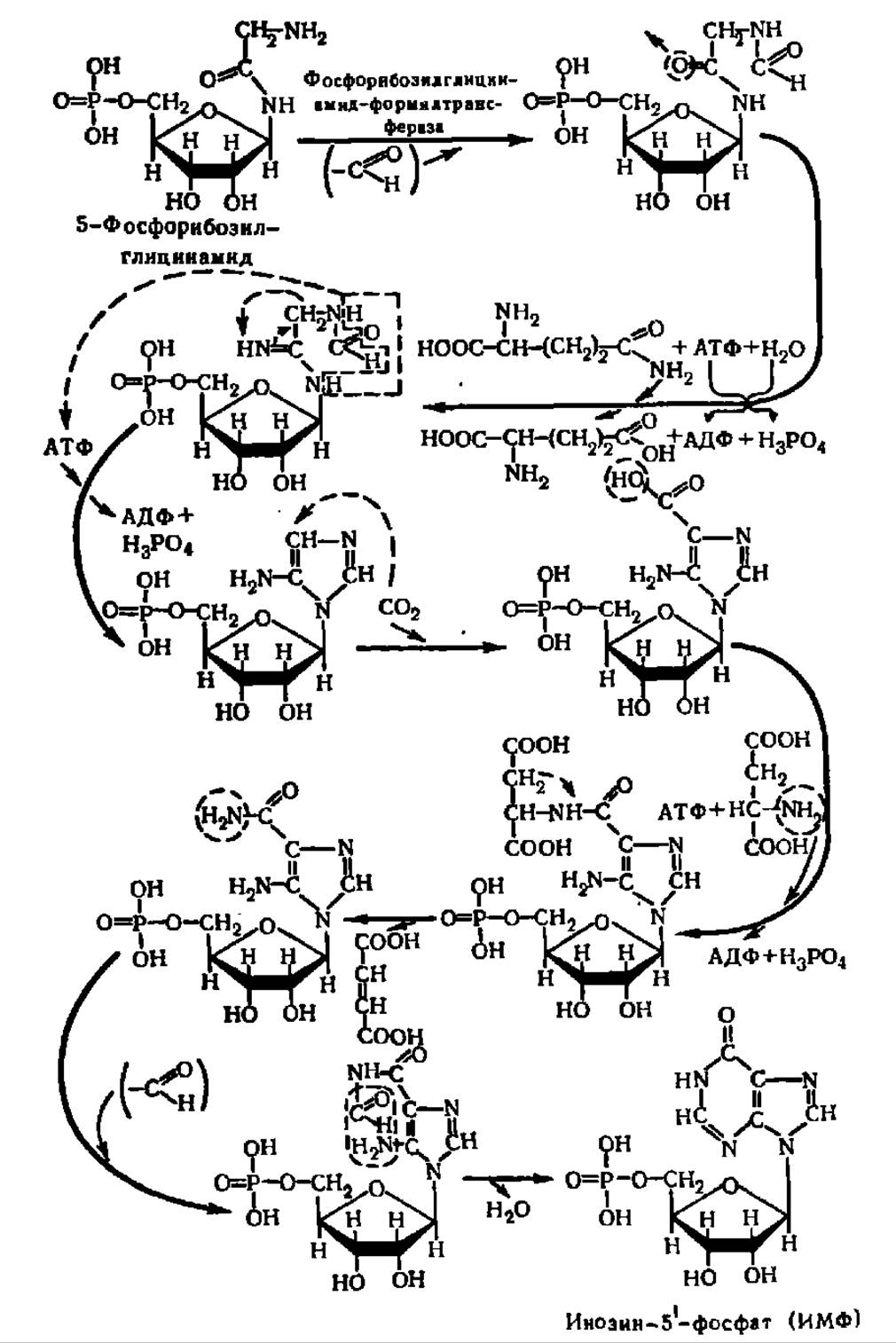
Схема 3. Механизм биосинтеза пуриновых нуклеотидов
Если подытожить, из каких соединений строится пуриновый цикл, то окажется, что он возникает из очень простых веществ:
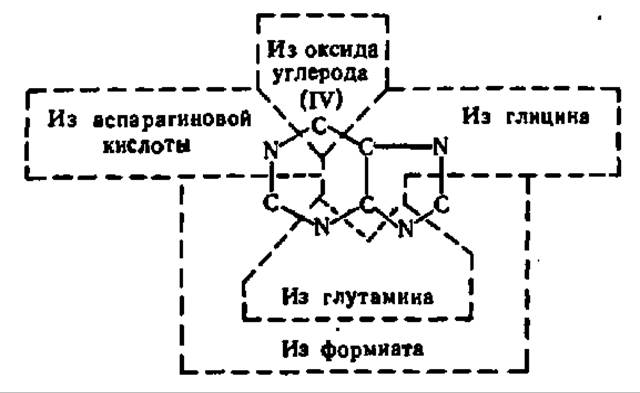
Из приведенной схемы ясно, что 1-й атом азота пуринового цикла ведет свое происхождение от аспарагиновой кислоты, 3-й и 9-й — от глутамина, а 7-й — от глицина. Что касается происхождения атомов углерода пуринового кольца, то видно, что источниками их явились формиат (2-й и 8-й атомы углерода), глицин (4-й и 5-й) и СО2 (6-й атом). Химические уравнения, приведенные на схеме 3, показывают детали включения тех или иных атомов N и С из состава перечисленных соединений в пуриновую часть нуклеотида в процессе его биосинтеза.
Пиримидиновое кольцо пиримидиновых нуклеотидов синтезируется в организме из аналогичных соединений: NH3, СО2 и аспарагиновой кислоты. Таким образом, исходные вещества для биосинтеза пуриновых и пиримидиновых оснований в организме исключительно доступны, всегда присутствуют в нем, так как аммиак, формильная группа и оксид углерода (IV) образуются в процессе деструкции разнообразных органических соединений или поступают в организм извне, а глутаминовая и аспарагиновая кислоты и их амиды представляют первичные в большом объеме синтезируемые аминокислоты, что имеет большое значение для обеспечения беспрепятственного синтеза этих важнейших для организма соединений.
Как следует из схемы 3, пуриновые нуклеотиды в результате последовательных реакций наращивания пуринового цикла на рибозо-5-фосфате возникают в виде инозин-5'-фосфата. Последний способен окисляться в ксантозин-5'-фосфат. В результате аминирования первого синтезируется аденозин-5'-фосфат, а второго — гуанозин-5'-фосфат. И тот и другой процессы ускоряются специфическими ферментами (см. уравнение реакции на с. 244).
В свою очередь, пуриновые нуклеозидмонофосфаты превращаются далее в нуклеозидтрифосфаты. При этом гуанозин-5'-фосфат переходит в гуанозин-5'-трифосфат по двойной обменной реакции с АТФ:

При взаимодействии аденозин-5'-фосфата с АТФ возникает аденозиндифосфорная кислота; эта реакция открыта А. В. Котельниковой в начале 60-х годов нашего века:
![]()
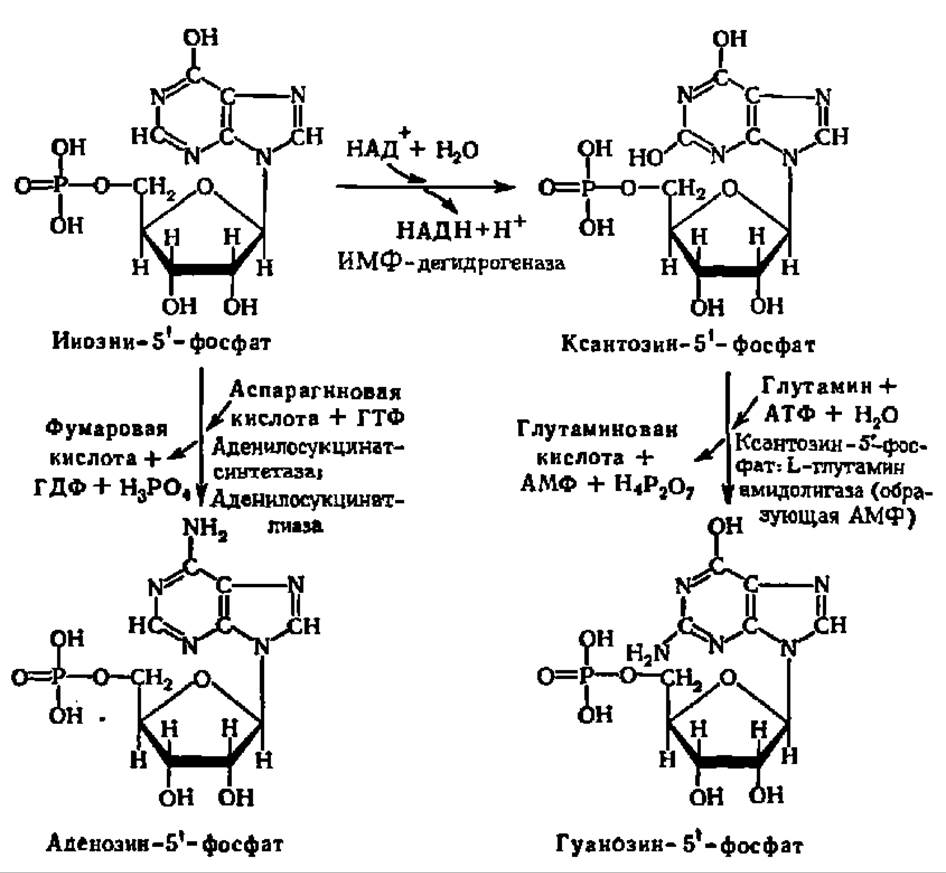
Она служит субстратом при окислительном фосфорилировании, в результате которого запасы АТФ в организме непрерывно пополняются, что обеспечивает достаточное ее количество для превращения всех остальных нуклеозидмонофосфатов в нуклеозидтрифосфаты.
Синтез дезоксиаденозин-5'-трифосфата (дАТФ) и дезоксигуанозин-5'-трифосфата (дГТФ) осуществляется посредством реакции восстановления рибозы по гидроксильной группе при втором углеродном атоме. В случае дГТФ реакция восстановления идет на уровне ГДФ с последующим превращением дГДФ в дГТФ:

Механизм реакции восстановления остатка рибозы в остаток дезоксирибозы в случае пуриновых рибонуклеозиддифосфатов идентичен рассмотренному ранее для пиримидиновых нуклеотидов. Сам же процесс восстановления стимулируется дГТФ и дТТФ, но ингибируется дАТФ.
Как и в случае пиримидиновых нуклеотидов, конечные продукты биосинтеза пуриновых нуклеотидов (ИМФ, АМФ, АДФ, АТФ, ГМФ, ГДФ и ГТФ) угнетают действие амидофосфорибозилтрансферазы — фермента, ускоряющего 1-ю реакцию в цепи процессов, приводящих к новообразованию пуринового кольца. Таким образом, осуществляется саморегуляция образования пуриновых нуклеотидов. Кроме того, при помощи специфического перекрестного участия АТФ и ГТФ в реакциях, ведущих к превращению ИМФ в ГМФ и АМФ соответственно, последние синтезируются в организме всегда в строго определенном соотношении:
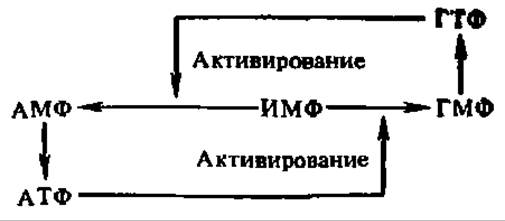
Схема эта весьма показательна: она дает представление о принципах саморегуляции, используемых в организме, когда обеспечивается синтез ряда веществ в определенной пропорции по отношению друг к другу. Обеспечение строго определенного соотношения нуклеозидтрифосфатов в организме имеет исключительное значение, так как из них образуются нуклеиновые кислоты. Сходные регуляторные процессы отмечены также в синтезе пиримидиновых нуклеотидов.
Существует еще один путь синтеза пуриновых и пиримидиновых нуклеотидов в организмах — из свободных пуриновых и пиримидиновых оснований и 5-фосфорибозил-1-пирофосфата. Он не является, конечно, способом синтеза данных нуклеотидов заново, так как при этом используются готовые пуриновые и пиримидиновые циклы, освободившиеся при распаде нуклеиновых кислот; он лишь сберегает пуриновые и пиримидиновые основания от их распада до соответствующих конечных продуктов. Эта реакция ускоряется специфическими ферментами — фосфорибозилтрансферазами:
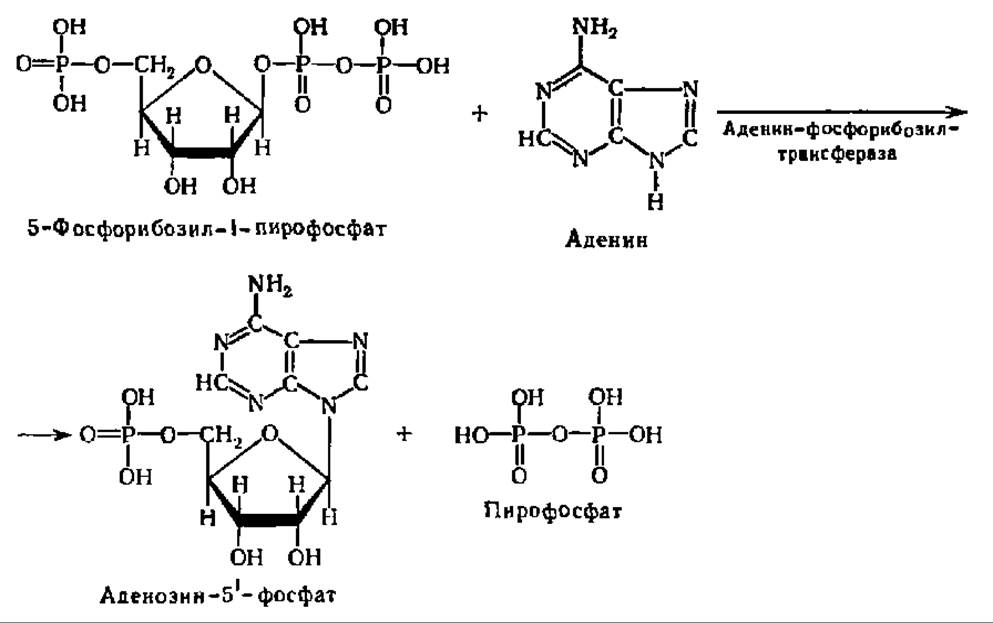
Этот путь, в частности, ярко представлен в злокачественных опухолях.