Основы биохимии - Филиппович Ю. Б. 1999
Нуклеиновые кислоты и их обмен
Биосинтез ДНК и РНК
Выше было показано, что в живой природе осуществляются реакции, обеспечивающие беспрепятственный синтез дезоксирибо- и рибонуклеозид-5'-трифосфатов всех видов: дАТФ, дГТФ, дЦТФ и дТТФ, а также АТФ, ГТФ, ЦТФ и УТФ. Характерно, что новообразование этих соединений регулируется таким образом, что они возникают зависимо друг от друга в строго определенной пропорции. Следовательно, в организме всегда обеспечено существование всех их одновременно в необходимых концентрациях. Именно из нуклеозидтрифосфатов и осуществляется биосинтез нуклеиновых кислот.
Первой характерной чертой специфического биосинтеза нуклеиновых кислот является то, что он протекает только при наличии всех четырех видов дезоксирибонуклеозидтрифосфатов (дАТФ, дГТФ, дЦТФ и дТТФ) в случае синтеза ДНК или же в присутствии всех четырех видов рибонуклеозидтрифосфатов (АТФ, ГТФ, ЦТФ и УТФ) в случае синтеза РНК. Вторая — состоит в том, что биосинтез идет при каталитическом воздействии ферментов — ДНК- или РНК-полимераз. Третья весьма своеобразная черта — необходимость для его осуществления затравки в виде уже готового полинуклеотида, который играет роль матрицы. Последнее имеет принципиальное значение, так как именно благодаря этому обеспечивается специфический биосинтез нуклеиновых кислот со строго заданной последовательностью нуклеотидных остатков в молекуле.
Общая схема биосинтеза дезоксирибонуклеиновых кислот может быть представлена в следующем виде:
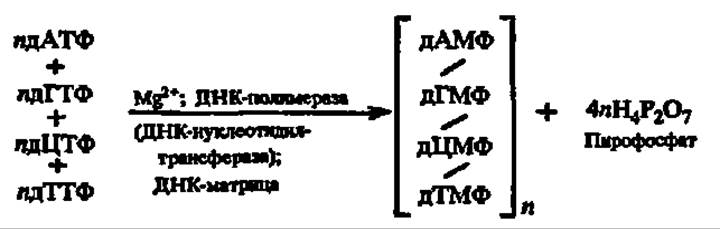
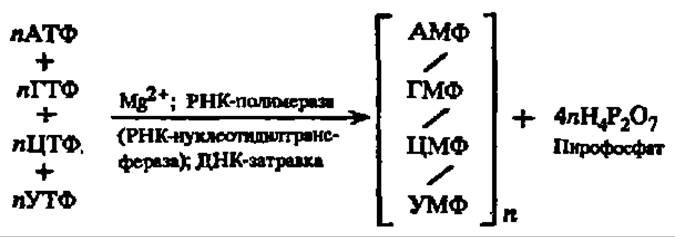
Она была впервые предложена А. Корнбергом (1958) на основании опытов, проведенных с ДНК-полимеразой, выделенной из кишечной палочки. В том же году С. Шпигельман тоже из кишечной палочки получил РНК-полимеразу (см. рис. 46). Позже она была изолирована из тканей млекопитающих и других животных. РНК-полимераза in vitro обеспечивает синтез РНК по аналогичной схеме:
Химизм реакции образования нуклеиновых кислот. Механизм происходящей при биосинтезе нуклеиновых кислот химической реакции заключается в переносе остатка нуклеозидмонофосфата от нуклеозидтрифосфата на концевой нуклеотидный остаток растущей в процессе синтеза полинуклеотидной цепи. Перенос идет на место атома Н гидроксильной группы, стоящей при 3-м углеродном атоме рибозы или дезоксирибозы концевого нуклеотида, и сопровождается выделением пирофосфата; поэтому фермент, осуществляющий ускорение реакции переноса нуклеотидного остатка, называют нуклеотидил-трансферазой:
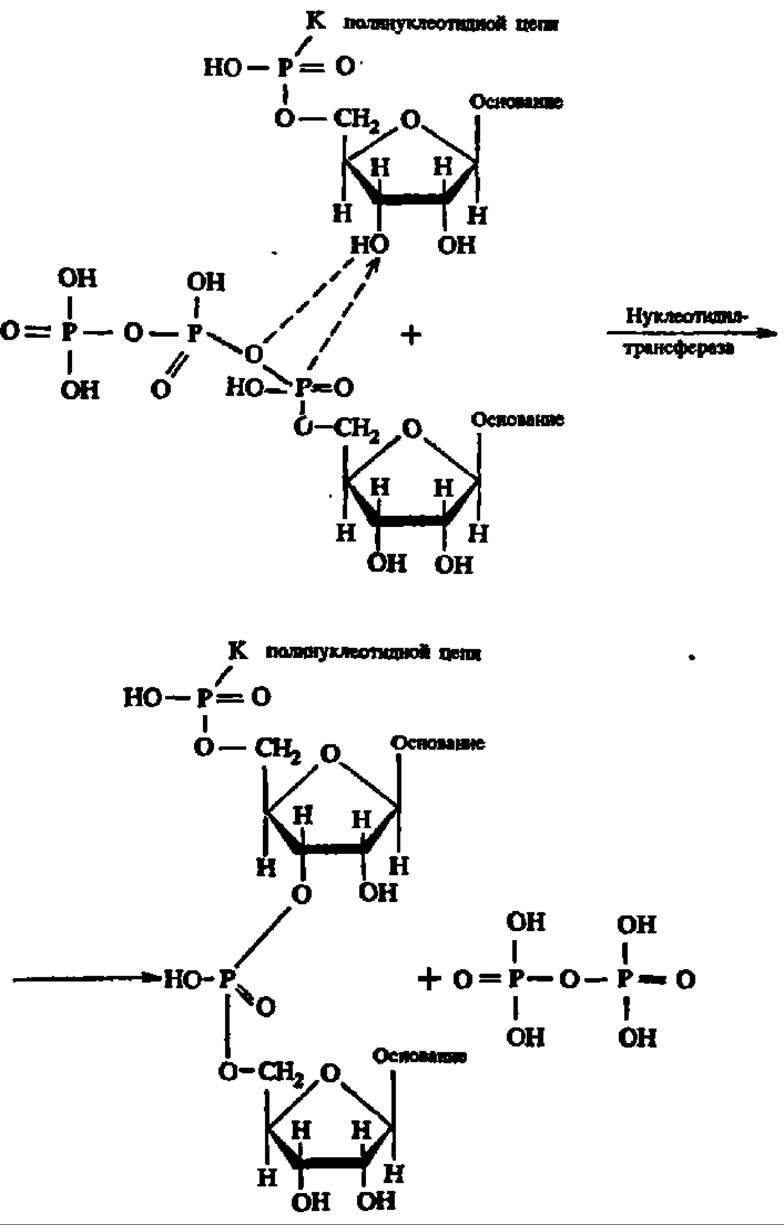
На свободную гидроксильную группу при 3-м углеродном атоме рибозы или дезоксирибози вновь присоединенного нуклеотидного остатка может поступить следующий нуклеотидный остаток, и, таким образом, будет осуществляться ступенчатый (градуальный) биосинтез полинуклеотида путем наращивания его с одного конца. Энергия для синтеза поступает за счет распада макроэргической связи в трифосфатной группировке при освобождении пирофосфата.
Механизм воспроизведения первичной структуры при биосинтезе нуклеиновых кислот. Процесс ступенчатого синтеза полинуклеотидной цепочки осуществляется на матрице, вдоль которой располагаются один за другим те или иные дезоксирибо- или рибонуклеозидтрифосфаты, вступающие затем в реакцию конденсации с выделением пирофосфата (рис. 83, А). Порядок расположения нуклеозидтрифосфатов вдоль полинуклеотидной матрицы задается чередованием нуклеотидных звеньев, присущим ДНК или иногда РНК, выполняющим матричную функцию. При этом к определенному пуриновому или пиримидиновому основанию полинуклеотида (матрица) присоединяется комплементарное пуриновое или пиримидиновое основание соответствующего нуклеозидтрифосфата. В результате вновь синтезируемая полинуклеотидная цепь в целом будет комплементарна полинуклеотидной цепи матрицы (рис. 83, А).
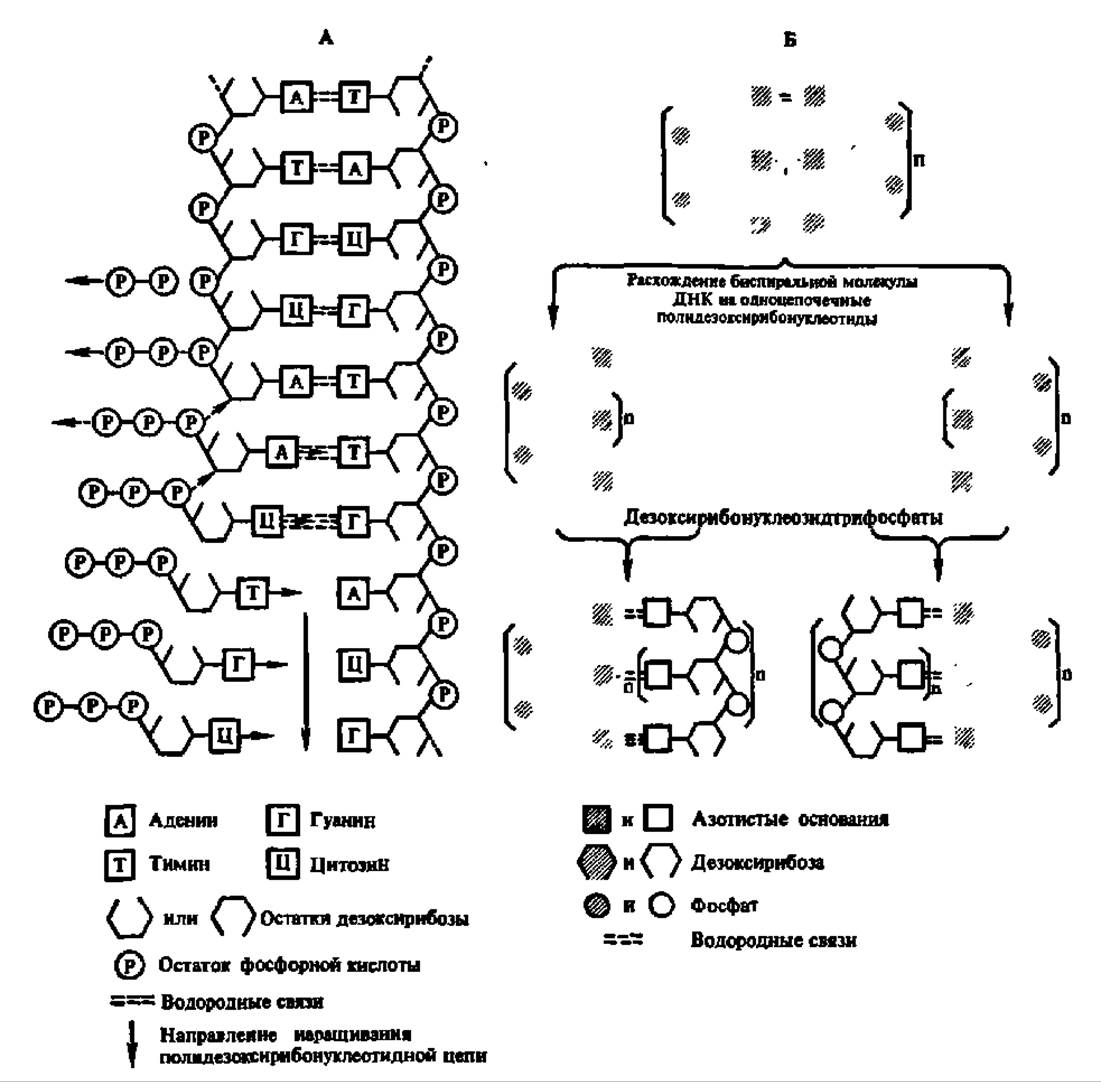
Рис. 83. Схема матричного биосинтеза нуклеиновых кислот (А) и удвоения молекул ДНК (А) при их репликации (пояснение в тексте)
Так как формирование нового полинуклеотида идет на полинуклеотидной матрице при непрерывном замыкании водородных связей между комплементарными пуриновыми и пиримидиновыми основаниями матрицы и нуклеозидтрифосфатов, то условием функционирования этого механизма является одноцепочечная структура матрицы. Поэтому в случае биосинтеза молекул ДНК, характеризующихся биспиральной структурой, существенным моментом в биосинтезе следует признать расхождение биспирального полидезоксирибонуклеотида на одиночные полинуклеотидные цепи, на которых, собственно, и осуществляется сборка комплементарных им полинуклеотидов. В итоге из одной биспиральной молекулы ДНК образуются две биспиральные молекулы ДНК, совершенно идентичные друг другу и исходной молекуле ДНК (рис. 83, Б). Как качественный состав, так и количественное содержание нуклеотидных остатков в матричной и вновь синтезированной на ней нуклеиновой кислоте совпадают (табл. 21).
Таблица 21 Молярные соотношения оснований в составе ДНК, синтезированной в присутствии разных матриц
Происхождение ДНК |
Характер образца |
Аденин |
Тимин |
Гуанин |
Цитозин |
А+Т Г+Ц |
А+Г Т+Ц |
Кишечная палочка |
Затравка |
1,00 |
0,97 |
0,98 |
1,05 |
0,97 |
0,98 |
Продукт |
1,04 |
1,00 |
0,97 |
0,98 |
1,02 |
1,01 |
|
Зобная железа |
Затравка |
1,14 |
1,05 |
0,90 |
0,85 |
1,25 |
1,05 |
Продукт |
1,19 |
1,19 |
0,81 |
0,83 |
1,46 |
0,99 |
|
Бактериофаг Т2 |
Затравка |
1,31 |
1,32 |
0,67 |
0,70 |
1,92 |
0,98 |
Продукт |
1,33 |
1,29 |
0,69 |
0,70 |
1,90 |
1,01 |
Это дает основание рассматривать изложенный выше механизм биосинтеза нуклеиновых кислот как гомологическую репликацию, т. е. бесконечное повторение процесса удвоения числа молекул путем прямого, непосредственного копирования их структуры.
Описанный выше (см. рис. 83, Б) механизм удвоения молекул ДНК был доказан в опытах, где исходную ДНК родительских клеток метили тритием или 15N. В дочерних клетках после 1-го деления метку обнаруживали во всех молекулах ДНК, но в меньшем количестве, так как она содержалась здесь лишь в одной из полидезоксирибонуклеотидных спиралей ДНК. Такой способ удвоения молекул ДНК называется полуконсервативным. После 2-го деления половина молекул ДНК во вновь образованных «внучатых» клетках оказывается немеченой, так как гомологическая репликация в процессе 2-го деления идет как на меченых, так и на немеченых одноцепочечных полидезоксирибонуклеотидах, возникающих при расхождении биспиральных молекул ДНК, меченных только по одной из цепей.
Ферменты биосинтеза ДНК. В биосинтезе ДНК участвуют не только ДНК-полимеразы, но и РНК-полимераза, эндонуклеаза, ДНК-лигаза и другие ферменты.
Впервые ДНК-полимераза была выделена из кишечной палочки А. Корнбергом и сотр. (1958). Поскольку в последующие годы из этой же бактерии были выделены еще две полимеразы, она получила название полимеразы I.
В клетке кишечной палочки содержится около 400 молекул ДНК-полимеразы I — белка (М = 109 000), содержащего один атом Zn и представленного одной полипептидной цепью. ДНК-полимераза I хорошо связывается с одноцепочечной ДНК или с зонами разрыва фосфодиэфирных связей в биспиральной ДНК. Она обладает ясно выраженной ДНК-полимеразной активностью, т. е. способна ускорять реакцию переноса дезоксирибонуклеотидильных остатков с дезоксирибонуклеозид-5'-трифосфатов на растущий конец полидезоксирибонуклеотида — 3'-гидроксильную группу дезоксирибозы его концевого нуклеозида.
Кроме того, ей присуща экзодезоксирибонуклеазная активность в отношении одноцепочечной ДНК в направлении 3'→5', т. е. тоже со стороны концевого дезоксирибонуклеозида, а также в направлении 5'→3' со стороны начального дезоксирибонуклеотида молекулы. В 1-м случае достигается удаление с наращиваемого в процессе синтеза ДНК 3'-конца молекулы неправильно (ошибочно) присоединенных нуклеотидных остатков, во 2-м — разрушение праймера, необходимого для синтеза фрагментов Оказаки (см. ниже). Последнее очень важно. Так, у мутантов кишечной палочки, утративших эту функцию ДНК-полимеразы I, накапливаются фрагменты Оказаки и биосинтез ДНК приостанавливается. Сейчас полагают, что ДНК-полимераза I имеет большее отношение к «созреванию» реплицирующейся ДНК, нежели непосредственно к полимеразным процессам в репликационной вилке. Последняя функция более присуща ДНК-полимеразе III.
ДНК-полимераза II присутствует в клетке кишечной палочки в количестве около 40 молекул (М = 90000). Она представлена одной полипептидной цепью. ДНК-полимераза II плохо соединяется с одноцепочечными ДНК, но отлично оккупирует точки разрыва в одной из цепей биспиральной ДНК. Обладает лишь 10%-ной ДНК-полимеразной активностью по сравнению с ДНК-полимеразой I.
Считают, что основной функцией ДНК-полимеразы II является достраивание поврежденных участков в молекуле ДНК, т. е. репарация ДНК. Предполагают, что ДНК-полимераза I in vivo несет эту же функциональную нагрузку.
Главной полимеразой кишечной палочки является ДНК-полимераза III. Это — сложный, термолабильный белок (М = 300 000), состоящий из субъединиц а (140000), ß (37000), у (52000), δ (32000), ε (25000) и Θ (10000); полимеразную реакцию осуществляет каталитический кор из а-, в- и Θ-субъединиц, в котором главную роль играет а-субъединица; ß-, у- и 6-субъединицы являются регуляторными и усиливают действие каталитического ядра ДНК-полимеразы III. В клетке кишечной палочки всего 20 молекул этого белка. Именно ДНК-полимераза III ответственна у кишечной палочки за процесс репликации ДНК. Она работает в ее клетке в комплексе с белковыми факторами, тоже принимающими участие в репликации ДНК, полностью обеспечивая главную ступень ее биосинтеза — элонгацию (продолжение) сборки дезоксиполирибонуклеотидной цепи.
Не менее сложен вопрос о ДНК-полимеразах эукариот. Их номенклатура оказалась крайне запутанной, поэтому на международной конференции по ДНК-полимеразам эукариот (США, 1975) она была унифицирована; условились называть их ДНК-полимеразы-а, -ß и -у.
ДНК-полимераза-а впервые обнаружена у млекопитающих (М = 150 000—200 000). Фермент, полученный из тимуса теленка, содержит каталитическую (М = 118 000) и регуляторную (М = 54 000—64000) субъединицы. Это — кислый белок (pІ 5,5), сильно ингибируемый агентами, блокирующими HS-группы. Ее полимеразная активность максимальна при pH 7,2 в присутствии биспиральной ДНК, но не АТ-кополимера. Хотя она и обнаруживается в цитоплазме, ее истинная локализация — в ядре, где сосредоточено ~ 25 000 ее молекул.
ДНК-полимераза-ß (М = 45000) характеризуется устойчивостью к действию агентов, блокирующих HS-группы, хорошо выраженной способностью ускорять при pH 8,4 реакцию копирования и ДНК, и АТ-кополимера, является основным белком (pІ 9,2). В клетке содержится в количестве ~8000 молекул, локализованных в ядре и участвующих в репарации ДНК.
ДНК-полимераза-у — кислый белок (pІ 5,8) с М = 180000, тетрамер из идентичных субъединиц; ее полимеразная активность, зависит от целостности HS-гpyпп. При pH 8,5 энергично ускоряет репликацию АТ-кополимера и гораздо менее активна с природной ДНК. В клетке присутствует в количестве ~ 1000 молекул, локализована в митохондриях, где обеспечивает репликацию митохондриальной ДНК.
Ни одна из ДНК-полимераз эукариот, в отличие от таковых прокариот, не обладает нуклеазной активностью. Их биологические функции выяснены пока недостаточно. Механизм действия ДНК-полимераз представлен на рис. 83.
Кроме ДНК-полимераз, обладающих у прокариот к тому же нуклеазной активностью, в биосинтезе ДНК принимает участие ДНК-лигаза. Она открыта в 1967 г. одновременно в пяти лабораториях. Это белок с М = 96000. В клетке кишечной палочки, например, насчитывается около 2000 молекул ДНК-лигазы. Ее функция состоит в обеспечении каталитического ускорения реакции образования фосфодиэфирной связи между 3'- и 5'-концами цепей ДНК, сближенных на расстояние одного нуклеотидного звена и закрепленных на комплементарной им, но непрерывной другой цепи ДНК. Такая ситуация возникает во многих случаях: при устранении разрывов в одной из цепей ДНК, вызванных облучением, действием нуклеаз и т.п.; при соединении новообразованного при репарации или в процессе нормальной репликации фрагмента с предшествующими или вновь созданными при этом фрагментами ДНК; при ковалентном замыкании линейной молекулы ДНК в кольцевую структуру и т. п. Механизм ДНК-лигазной реакции представлен на рис. 84. ДНК-лигаза нашла применение в работах по синтезу генов и их фрагментов.
Белковые факторы, необходимые для биосинтеза ДНК. Наряду с перечисленными выше ферментами в биосинтезе ДНК принимают участие белковые факторы, каждый из которых выполняет собственную функцию.
ДНК-связывающий белок впервые выделен В. Альбертсом и Л. Фреем (1970) из лизатов кишечной палочки, зараженной фагом Т4. Вначале он был назван белком 32—по номеру гена в хромосоме фага Т4, ответственного за биосинтез этого белка. Белок характеризуется молекулярной массой 35000 (собственный ДНК-связывающий белок кишечной палочки имеет М = 22000), высокой степенью асимметрии молекулы (b/a = 4), преобладанием дикарбоновых аминокислот над диаминокислотами. Белок представлен одной полипептидной цепью и обладает ярко выраженной способностью связываться с одноцепочечной ДНК или дефектными участками биспиральной ДНК, резко ослабляя взаимодействие полидезоксирибонуклеотидных цепей в ее молекуле, что выражается в понижении температуры плавления ДНК на 30—40°.
ДНК-связывающий белок активирует ДНК-полимеразы II и III. Сейчас он выделен и из клеток эукариот. В противоположность ДНК-связывающему белку существует и выделен белок, биосинтез которого у кишечной палочки кодируется геном № 5 фаговой хромосомы. Этот белок полностью блокирует матричную активность ДНК, т. е. является антагонистом ДНК-связывающего белка.
ДНК-раскручивающий белок описан Дж. Янгом (1971) и назван белком ω. Предполагают, что он обладает нуклеазной активностью и, присоединяясь к ДНК, разрывает фосфодиэфирную связь одной из ее цепей, вследствие чего обеспечивается свободное вращение вокруг фосфодиэфирной связи другой цепи и раскручивание суперспиральной молекулы ДНК. Его антагонист — ДНК-закручивающий белок вызывает суперспирализацию ДНК, ему присущи ДНК-зависимая АТФазная активность и механохимические свойства.
При изучении биосинтеза ДНК у кишечной палочки и ее мутантов тестировано еще несколько белков, участвующих в репликации ДНК (рис. 85), и функции некоторых из них уже выяснены. Среди них особый интерес представляет хеликаза — фермент, расплетающий двойную спираль ДНК. При молекулярной массе около 75 000 Да его полипептидная цепь из 650 аминокислотных остатков (первичная структура выяснена) организована в виде двух крупных доменов из 286 и 364 аминокислот (в каждом по 2 субдомена) и пространственно организована так, что может охватывать биспиральную молекулу ДНК, расплетая ее за счет энергии распадающейся АТФ.
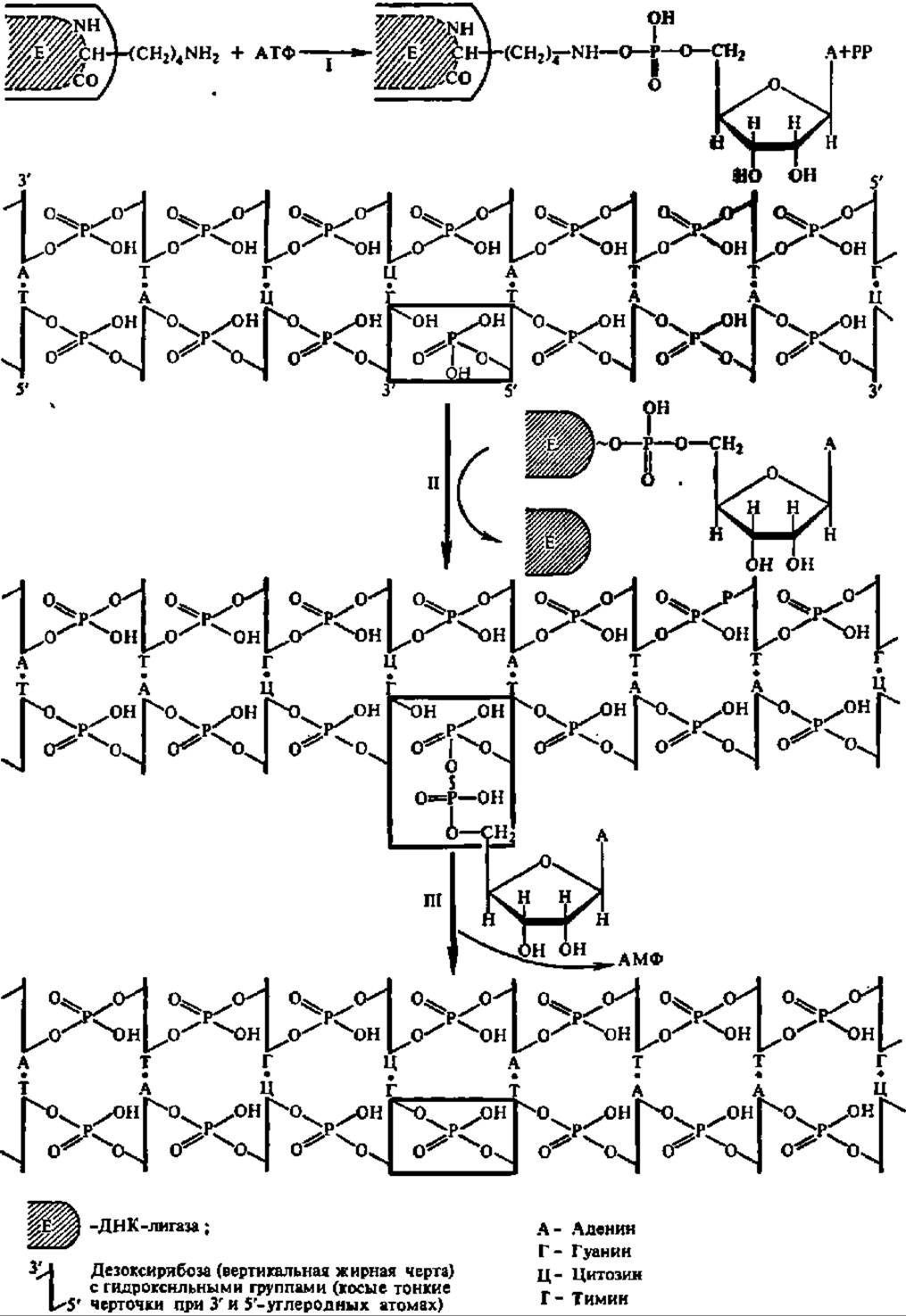
Рис. 84. Механизм ДНК-лигазной реакции
Реакция идет в три стадии: I — ДНК-лигаза взаимодействует с АТФ (или НАД+) с образованием ферментадепилатного производного по εNH2-гpyппe остатка лизина полипептидной цепи фермента и выделением пирофосфата (или иикотинамидрибозофосфата); II — остаток адениловой кислоты с крайне активной в химическом отношении аденилатлигазы перебрасывается на свободную фосфатную группу 5'-углеродного атома рибозы концевого нуклеотида; ДНК-лигаза при этом высвобождается; III — между сближенными активированной аденилатом 5'-фосфатной группой и 3'-гидроксильной группой фрагментов цепи ДНК происходит спонтанное взаимодействие с образованием фосфодиэфирной связи с выделением АМФ
Этапы биосинтеза ДНК. Исходя из приведенных выше данных о ферментах и белковых факторах, принимающих участие в биосинтезе ДНК, постулирована схема этого процесса. Она базируется на представлении о существовании репликативного комплекса ферментов и белковых факторов, необходимых для осуществления биосинтеза ДНК, локализованных в репликативной вилке, т. е. той зоне ДНК, где происходит распаривание биспирального полидезоксирибонуклеотида и сборка дочерних, новообразуемых цепей ДНК (рис. 85): В соответствии с этой схемой биосинтез ДНК распадается на 3 этапа: инициацию, элонгацию и терминацию. Следует подчеркнуть, что многие вопросы, касающиеся механизма биосинтеза ДНК, еще не до конца выяснены и рассматриваемая модель является в определенной мере условной.
Инициация биосинтеза ДНК, понимаемая в узком смысле как начало биосинтеза дочерних полидезоксирибонуклеотидных цепей на материнских, сводится к созданию на материнской цепи ДНК затравочного олигонуклеотида со свободной гидроксильной группой на 3'-конце этого олигонуклеотида. Без него не работает ни одна из ДНК-полимераз. Этот короткий (несколько десятков звеньев) олигорибонуклеотид, заканчивающийся пиримидиновым нуклеозидом, является праймером, т. е. предшественником будущей цепи ДНК, и синтезируется при участии фермента типа РНК-полимеразы, получившего название праймазы (М = 60000, 100 молекул в клетке кишечной палочки). Только после его создания в синтез включается ДНК-полимераза III, при посредстве которой синтезируется далее на материнской цепи ДНК дочерняя цепь ДНК. Впоследствии ковалентно присоединенный к этой новообразованной цепи ДНК фрагмент РНК (праймер) «вырезается» при помощи нуклеаз и одноцепочечная брешь застраивается олигодезоксинуклеотидным фрагментом тоже при посредстве ДНК-полимеразной (репаразной) реакции (рис. 85).
Инициация биосинтеза ДНК, понимаемая в более широком смысле как комплекс процессов, приводящих к старту в биосинтезе ДНК, сводится к возникновению репликативного комплекса ферментов и белковых факторов и формированию репликативной вилки (рис. 85). Она включает присоединение к биспиральной ДНК (к одноцепочечному ее фрагменту в момент распаривания биспиральной структуры в результате флухтуаций) ДНК-связывающего белка, ДНК-раскручивающего белка, ДНК-полимеразного комплекса, ДНК- зависимой РНК-полимеразы (праймазы), а также комплекса белковых факторов, называемого праймосомой и обеспечивающего продвижение репликативной вилки (рис. 85), ее пространственную организацию и функционирование.
Элонгация биосинтеза ДНК складывается по меньшей мере из двух процессов: репликации участков материнских цепей ДНК и соединения друг с другом синтезированных при репликации фрагментов новообразуемых цепей ДНК. Первый осуществляется при посредстве ДНК-полимеразной реакции (см. рис. 83), идущей со скоростью (в н. о./с) в среднем около 1000 у бактерий, 100 — у животных и 10 — у растений. Своеобразие его состоит в том, что репликация идет не непрерывно, а фрагментарно: за один раз у прокариот синтезируется полидезоксирибонуклеотид с коэффициентом седиментации 8—10S, т.е. молекулярной массой в несколько сотен тысяч дальтон (примерно из 1000 н. о.). У эукариот фрагменты Оказаки короче, около 200 н. о., что сопоставимо с длиной нуклеосомной ДНК, в чем, по-видимому, есть определенный смысл. Эти фрагменты получили название фрагментов Оказаки в честь японского биохимика, впервые в 1967 г. на VII Международном биохимическом конгрессе в Токио предложившего схему биосинтеза ДНК, в которой были преодолены трудности, связанные с антипараллельностью цепей ДНК в ее биспиральной молекуле. Дело в том, что ДНК-полимеразы способны наращивать полинуклеотидную цепь в направлении только 5'→3', т. е. путем переноса нуклеотидного остатка с дезоксирибонуклеозидтрифосфата на гидроксильную группу 3'-углеродного атома растущей полидезоксирибонуклеотидной цепи. Но так как цепи материнской ДНК антипараллельны, т. е. направление чередования нуклеотидных звеньев в них противоположно (см. рис. 85), то один и тот же фермент, т. е. ДНК-полимераза, не может обеспечить сборку дочерних цепей одновременно в направлениях 5'→3' и 3'→5' в соответствии с перемещением репликационной вилки при расплетании биспиральной молекулы ДНК. Т. Оказаки предположил, что ДНК-полимераза ведет синтез ДНК челночным способом: сначала передвигаясь вперед в направлении 5'→3' по одной цепи, а затем в том же направлении 5'→3', но передвигаясь в обратную сторону по другой цепи. Те фрагменты Оказаки, у которых олигорибонуклеотидные праймеры заменены при участии ДНК-полимеразы I на дезоксирибонуклеотидные фрагменты, при посредстве ДНК-лигазы объединяются вместе (см. рис. 84 и 85) и дают начало дочерней цепи ДНК. Есть и другой взгляд на механизм преодоления антипараллельности цепей ДНК; суть его ясна из рассмотрения рис. 85, Б и легенды к нему.
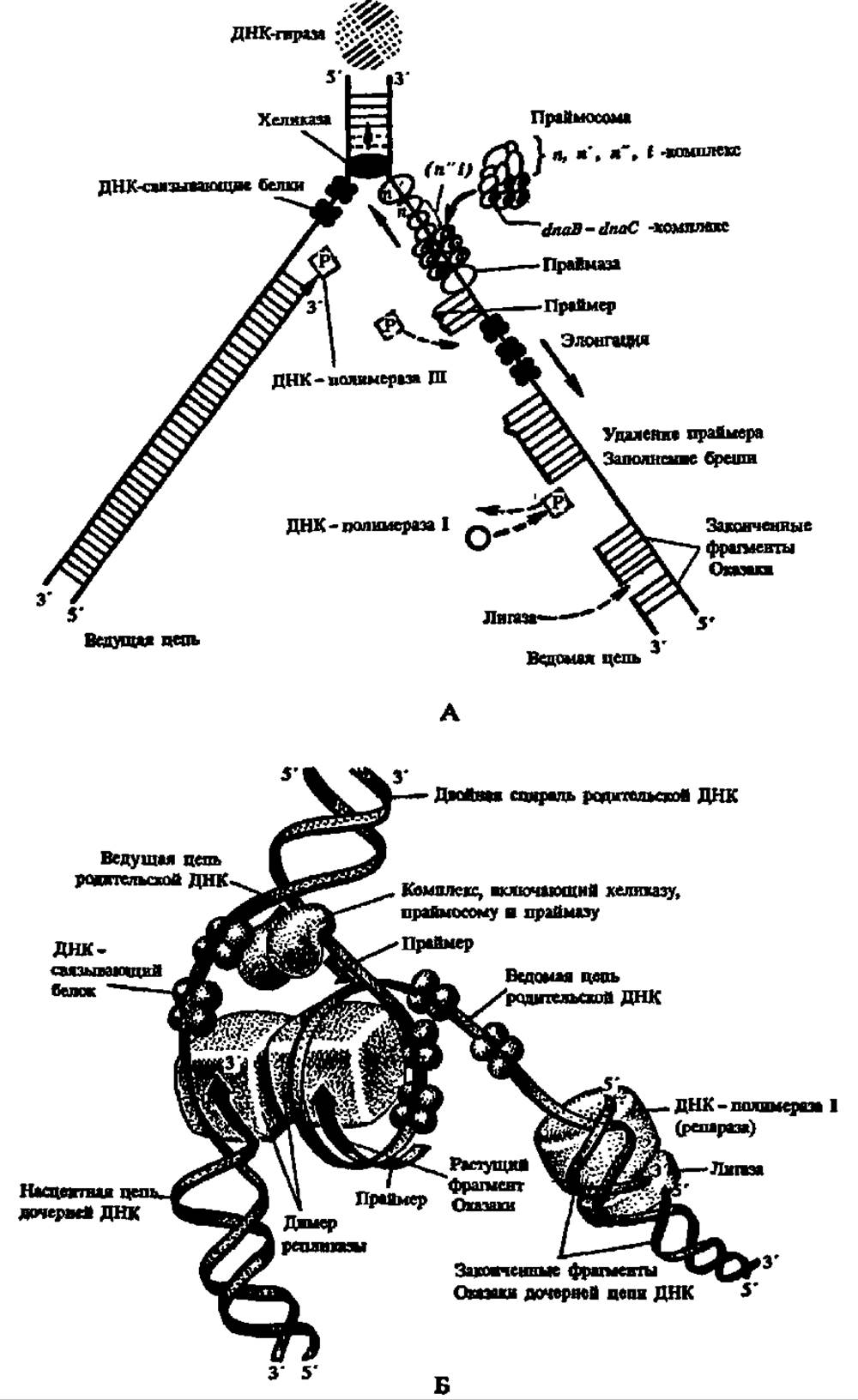
Рис. 85. Схема биосинтеза фаговой ДНК в клетке кишечной палочки:
А — плоскостная модель, согласно которой синтезу затравочного олигориболуклеотида (праймера) под действием ДНК-зависимой РНК-полимеразы (праймазы) способствует белковый комплекс, называемый праймосомой (n — 25 кДа, n' — 75 кДа, n'' — 11 кДа, і — 80 кДа, dna — 300 кДа, dnaC — 29 кДа), движущийся в направлении, противоположном элонгации, я создающий новые центры синтеза праймера. Раскручивание биспиральной ДНК на одноцепочечные полидезоксирибонуклеотиды осуществляется хеликазой (от англ. helix — спираль), а релаксация суперспиральной ДНК — гиразой (от англ. gyration — кругловращательное движение). Б — пространственная модель, демонстрирующая преодоление антипараллельности цепей ДНК за счет возникновения петли ДНК, где чередование фосфоридиэфирных связей на ее восходящем отрезке изменяется на обратное и не препятствует ДНК-полимеразе вести синтез фрагмента Оказаки на ведомой цепи родительской ДНК в том же направлении, что и на ведущей цепи. Остальные пояснення в тексте
Вопрос, синтезируются ли на одной из цепей родительской ДНК фрагменты Оказаки, т. е. идет ли на ней прерывистый биосинтез цепи дочерней ДНК, а на другой — непрерывный биосинтез цепи дочерней ДНК, остается дискуссионным. Видимо, как правило, происходит прерывистый синтез на обеих цепях родительской ДНК, а сочетание прерывистого и непрерывного является исключением, вполне доказанным для репликации некоторых фаговых ДНК. Решение проблемы одно- или двунаправленной репликации однозначно: от точки инициации репликационные вилки распространяются по биспиральной молекуле ДНК в двух противоположных направлениях.
По поводу терминации биосинтеза ДНК мнения разноречивы. Предполагают, что прекращение репликации ДНК программируется особой нуклеотидной последовательностью, в том числе в виде специальных палиндромов («кроличьих ушей») на конце хромосомы. Само собой разумеется, что репликация прекращается, когда встречаются две репликационные вилки при удвоении как кольцевых, так и линейных ДНК. Наконец, возможно достраивание ведомой цепи за счет праймирования 3'-конца материнской цепи с участием специфического белка, находящегося на ее конце.
Точность репликации ДНК весьма велика — одна ошибка на 1010 нуклеотидилтрансферазных реакций. Но даже если ошибка допущена, она может быть исправлена в ходе репарационных процессов.
Биосинтез ДНК на РНК в качестве матрицы. Кроме рассмотренного выше механизма биосинтеза ДНК на полидезоксирибонуклеотидной матрице в последние годы открыта система биосинтеза ДНК на РНК при посредстве фермента, названного обратной транскриптазой или ревертазой (его называют также РНК-зависимой ДНК-полимеразой). Этот фермент был обнаружен в 1970 г. независимо друг от друга Д. Балтимором в составе вируса Раушера лейкемии мышей и Г. Теминым и С. Мизутани в составе вируса саркомы Рауса. Ревертаза активируется Мn2+ сильнее, чем Mg2+, и содержит Zn. Синтезированная ДНК имеет небольшую молекулярную массу и характеризуется константами седиментации от 2S до 7S. Как и обычные ДНК-зависимые ДНК- полимеразы, ревертаза нуждается в праймере, роль которого может играть тРНК, в чем проявляется регулирующая роль последней в обмене веществ. Ее молекулярная масса колеблется от 70 до 180 кДа в зависимости от объекта, из которого она выделена; фермент, как правило, состоит из двух субъединиц.
Значение открытия ревертазы состоит прежде всего в том, что выявлен дополнительный механизм биосинтеза ДНК, который, как предполагают, может использоваться для амплификации генов. Исследование ревертазной реакции крайне существенно для изучения перерождения нормальной клетки в раковую. Ревертаза нашла применение в молекулярной биологии для синтеза генов и фрагментов генов и, как следствие этого, в генетической инженерии. Новой областью ее использования является массовая расшифровка через кДНК первичной структуры РНК и белков.
Учитывая исключительную важность работ по исследованию обратной транскрипции, в нашей стране начиная с 1972 г. осуществляют проект «Ревертаза», в разработке которого принимали участие академии наук СССР и стран СЭВ. В результате проведенных исследований удалось создать универсальную систему обратной транскрипции, позволяющую вести синтез ДНК с любой заданной точки в молекуле РНК при помощи синтетического праймера (октадезоксирибонуклеотид заданного строения), комплементарного межгенной зоне одной из фаговых РНК. Кроме того, путем ревертазной реакции получена ДНК на глобиновой мРНК голубя и гигантских ядерных РНК. Действием ревертазы in vivo в ДНК введена онкогенная информация, успешно изучается структура РНК-содержащих опухолеродных вирусов, синтезированы потенциальные ингибиторы ревертазы.
Продолжаются интенсивные работы по изучению свойств ревертаз, выделенных из различных опухолеродных вирусов (в том числе человека), синтезу ингибиторов ревертаз, не действующих на клеточные ДНК-полимеразы, получению ДНК-транскриптов для работ по генетической инженерии, исследованию интеграции ДНК, синтезированной на вирусной РНК, в геном клетки.
За этот цикл работ группе советских исследователей и ученых стран СЭВ в 1979 г. присуждена Государственная премия СССР. Начиная с 1980 г. проект «Ревертаза» преобразован в проект «Ревертаза-онкоген».
Биосинтез РНК. Биосинтез РНК осуществляется на ДНК в качестве матрицы. С точки зрения передачи информации в живых системах он характеризуется как процесс транскрипции, т.е. переписывания информации, содержащейся в последовательности нуклеотидных остатков в ДНК-матрице, в последовательность нуклеотидных звеньев в молекуле новообразуемой РНК. Та часть молекулы ДНК, которая копируется в процессе биосинтеза РНК на ней, носит название транскриптона. Последний содержит информативную и неинформативную зоны. Транскрибирование информативной зоны приводит к образованию той части новообразуемой РНК, которая впоследствии дает начало РНК с определенной функциональной активностью. При копировании неинформативной зоны продуцируется та часть насцентной РНК, которая впоследствии, в процессе созревания вновь синтезированной РНК, разрушается. Соотношение информативной и неинформативной частей в транскриптонах прокариот и эукариот резко различно и составляет ъ среднем 9:1 и 1:9 соответственно.
Неинформативная зона транскриптона содержит регуляторные последовательности, с которыми взаимодействуют многочисленные (их открыто несколько десятков) регуляторные белковые факторы, ускоряющие или замедляющие процесс транскрипции. Они контактируют с определенными последовательностями нуклеотидных остатков в ДНК присущими им ДНК-связывающими доменами. Так, например, транскрипционный фактор ІІІА из ооцитов шпорцевой лягушки содержит ßß'a — надвторичную структуру с атомом Zn в ее составе (см. рис. 41), так называемый цинковый палец, обеспечивающий прикрепление к ДНК.
У эукариот основная масса РНК синтезируется в ядре клетки, где локализация биосинтеза различных видов РНК также различается (рис. 86).
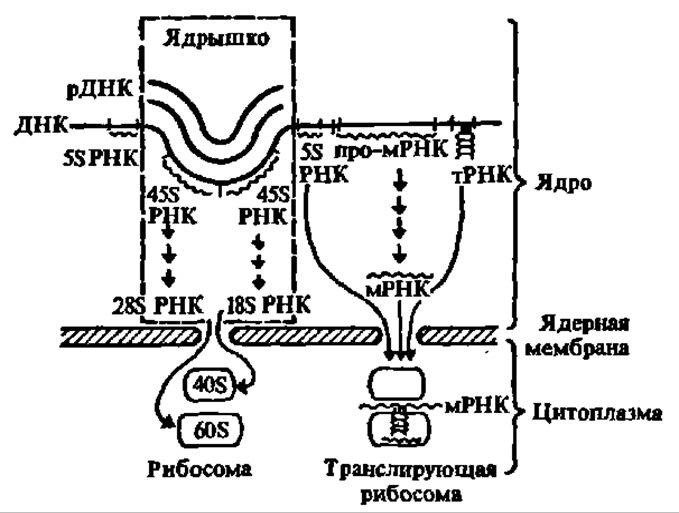
Рис. 86. Локализация биосинтеза различных видов РНК в ядре клетки
Все виды РНК синтезируются на ящерной ДНК в качестве матрицы. В ядрышке сосредоточена рДНК, являющаяся матрицей в биосинтезе предшественников рибосомальных нуклеиновых кислот (45S РНК), при созревании которых возникают 18S и 28S рРНК (короткими стрелками подчеркивается многоступенчатость процесса превращения предшественников в функциональные РНК). рДНК в определенные периоды клеточного цикла многократно реплицируется, что обеспечивает наработку большего количества рДНК (на рисунке это отмечено трехкратным повторением зоны рДНК в ядрышке). Все новообразованные РНК выходят в виде нуклеопротеинов через поры ядерной мембраны, в цитоплазму, где рРНК используется для образования 40S и 60S субчастиц рибосом, а мРНК, 5S рРНК в тРНК — при превращении неактивных рибосом в активные, транслирующие рибосомы
Биосинтез РНК осуществляется при посредстве РНК-полимераз, которые в основном являются ДНК-зависимыми и лишь в некоторых случаях РНК-зависимыми ферментами. Механизм их действия во многом совпадает с таковым у ДНК-полимераз: они ускоряют биосинтез РНК из АТФ, ГТФ, ЦТФ и УТФ тоже путем нуклеотидилтрансферазной реакции. Обеспечение уникальной первичной структуры новообразуемой РНК происходит за счет спаривания соответствующего рибонуклеозидтрифосфата с комплементарным ему нуклеотидным остатком матричного полинуклеотида в точке роста молекулы РНК. Но есть существенные различия: РНК-полимеразы не нуждаются в праймере, обладают способностью избирательно взаимодействовать с зоной промотора ДНК (точка, с которой начинается биосинтез РНК), являются сложными молекулами, построенными из нескольких субъединиц, и др.
Наиболее изучены РНК-полимеразы прокариот, в частности кишечной палочки. РНК-полимераза кишечной палочки, представленная белком с М = 487 000, состоит из пяти субъединиц: двух а, одной ß, одной ß' и одной σ. Форма субъединиц, их молекулярные массы и вероятный вариант компоновки показаны на рис. 46.
В целом же у прокариот (изучено несколько десятков видов) молекулярные массы РНК-полимераз колеблются в довольно широких пределах (а: 36—45 кДа, ß: 86—160 кДа, ß': 96—175 кДа и σ-фактор: 44—107 кДа). Прокариотические РНК-полимеразы синтезируют все виды РНК — рибосомальные, матричные, транспортные и низкомолекулярные. В отличие от них эукариотические РНК-полимеразы типа I (М = 473 кДа, 6 субъединиц) транскрибируют гены рРНК; типа II (М = 882 кДа, 10 ±2 субъединицы) — гены, кодирующие
белки; типа III—гены малых стабильных РНК (тРНК, 5S рРНК) (М~653 к Да, 9 субъединиц). Каждая из субъединиц РНК-полимераз выполняет свою функцию: одни из них узнают нуклеотидную последовательность в зоне промотора, обогащенную тимидиловыми и адениловыми дезоксирибонуклеотидами (ТАТААТ — блок Прибнова у прокариот, ТАТА — блок Гольдберга—Хогнесса у эукариот), другие обеспечивают нуклеотидилтрансферазную реакцию при наращивании цепи РНК, третьи — взаимодействуют с многочисленными транскрипционными белковыми факторами (их насчитывают уже несколько десятков), регулирующими биосинтез соответствующих РНК путем контакта с энхансерными (усиливающими) и сайленсерными (ослабляющими) полинуклеотидными зонами ДНК или путем аткивирования протеинкиназ, фосфорилирующих как белковый кор РНК-полимераз, так и регуляторные белки. Транскрипционный процесс завершается либо факторнезависимым способом (в составе синтезируемой РНК поблизости от ее конца появляются две короткие последовательности, дающие шпильку, что выводит РНК из транскрипционной вилки), либо при посредстве белкового фактора р (М = 46094 Да, первичная структура выяснена, существует в виде гексамера в количестве 1000 молекул на клетку), который присоединяется к транскрипционному центру, распаривает ДНК—РНКовый комплекс и высвобождает РНК. Для РНК-полимеразы I, осуществляющей транскрипцию рРНК, сигналом для ее завершения служит присоединение белкового фактора (М= 130 кДа) к 18-звенному терминатору в составе копируемого гена рДНК млекопитающих.
РНК-полимераза преимущественно связывается с тяжелой цепью ДНК и обладает способностью расплетать биспиральную структуру ДНК на ее ограниченном протяжении. Перемещение РНК-полимеразы вдоль цепи РНК происходит под воздействием присоединяемого в процессе синтеза РНК нуклеотида. Биосинтез РНК регулируется при посредстве механизма, показанного на рис. 87.
Синтезированные РНК представляют собой РНК-предшественники функционально-активных рибонуклеиновых кислот, так как наряду с информативными зонами содержат неинформативные участки. Впервые это явление было открыто в начале 60-х годов Г. П. Георгиевым и О. П. Самариной, а сами эти гигантские транскрипты названы ими дРНК (т.е. ДНК-подобными РНК). В дальнейшем происходит процесс их видоизменения, сопровождающийся разрушением неинформативных зон. Он носит название процессинга или созревания РНК. При процессинге РНК метилируется (с помощью РНК-метилаз), в результате чего она обогащается минорными основаниями (особенно в случае тРНК); в случае мРНК к ней присоединяются кэп и полиаденилатный фрагмент. Процессинг идет при участии разнообразных ферментов. Именно при изучении процессинга предшественников РНК было открыто удивительное явление: способность некоторых низкомолекулярных РНК осуществлять каталитическую функцию.
Наиболее отчетливо это выявилось при работе с РНКовой компонентой рибонуклеазы Р — фермента, катализирующего процессинг 5'-концов предшественников тРНК: будучи отделена от белковой части, РНК оказалась способной одна ускорять реакцию распада фосфодиэфирной связи по гуаниловому остатку при переходе предшественника в зрелую тРНК (рис. 88, А), вследствие чего получила название рибозима. Механизм каталитического акта пока не ясен, но зафиксировано образование рибозим-субстратного комплекса и полное подчинение процесса ферментативной кинетике. Возможен и аутосплайсинг предшественников (рис. 88, Б), где тоже решающую роль играют гуанозиновые остатки. В последние годы предприняты попытки по замене рибонуклеотидов в составе рибозимов на дезоксирибонуклеотиды, что привело к созданию химерных рибозимов (нуклеозимов) с повышенной стабильностью и активностью, а также по синтезу рибозимов и нухлеозимов с меньшим числом нуклеотидных звеньев в их составе (минизимов). Все это позволило создать концепцию, согласно которой именно рибонуклеиновые кислоты занимали центральное место в химических процессах, связанных с происхождением жизни на Земле, лишь потом к ним добавились ДНК и белки, и постепенно возникла более прогрессивная система хранения и передачи информации при новообразовании биополимеров, обеспечивающая передачу из поколения в поколение структурных особенностей и функций биологических макромолекул.
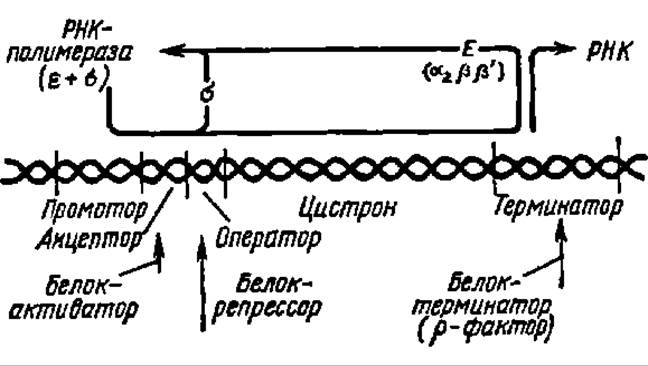
Рис. 87. Регуляция биосинтеза РНК
Биосинтез РНК начинается с зоны молекулы ДНК, называемой промотором и «узнаваемой» σ-фактором; между промотором и информативной последовательностью нуклеотидных остатков (цистрон) в ДНК располагается зона оператора. Если она свободна, т. е. не занята белком-репрессором (его структура детально изучена), РНК-полимераэная реакция осуществляется беспрепятственно. Сначала транскрибируется зона оператора, затем зона цистрона, содержащего информацию о последовательности аминокислотных остатков в одном или нескольких метаболически связанных белках. Если промотор блокирован белком-репрессором, синтез РНК не происходит; зона связывания (энхансер) белка-активатора (тоже полностью охарактеризован) может располагаться не только вблизи, но н в отдалении от зоны промотора
Выяснилось далее, что аналогичной способностью обладают многие малые ядерные РНК, существующие в виде комплексов с белками. Все они содержат много остатков уридиловой кислоты и получили поэтому шифр U1, U2 и т. д. РНК. Их изучено более десятка, и большинство из них принимают участие в каталитическом ускорении созревания мРНК и рРНК, обеспечивая выщепление неинформативных фрагментов из их предшественников и соединение (сплайсирование) биологически значимых последовательностей с образованием зрелых молекул. Они же, по-видимому, ведут альтернативный сплайсинг предшественников мРНК, при котором из одной пре-мРНК образуется несколько функционально значимых мРНК за счет разного расположения информативных зон в их составе. Внутриядерные комплексы низкомолекулярных ядерных РНК с белковыми факторами, необходимыми для их сборки и функционирования, получили название сплайсосом; именно они осуществляют специфический сплайсинг при созревании пре-мРНК и пре-рРНК. Сейчас на первый план при оценке функций малых ядерных РНК выступает их ведущая роль в регуляции обмена веществ в клетке: открыт новый класс их, представители которого комплементарны коротким диспергированным повторам в ДНК, вследствие чего они могут контролировать репликацию ДНК и ее транскрипцию в качестве транс-регуляторных элементов, взаимодействующих с энхансерами и сайленсерами промоторной зоны.
Осуществлены подсчеты скорости синтеза РНК. Так, в случае биосинтеза в клетках печени крысы мРНК для сывороточного альбумина она равна 90—100 н. о./с. Исходя из того, что в печеночной клетке содержится около 40000 молекул этой мРНК, а время ее жизни составляет 3 ч, при указанной скорости биосинтеза достаточно 3—4 активных генов для того, чтобы полностью обеспечить наработку ее необходимого количества.
Изучение закономерностей биосинтеза нуклеиновых кислот привело к открытию важнейшего механизма воспроизведения специфичности при их новообразовании. Механизм этот сводится к взаимодействию комплементарных оснований полинуклеотидной матрицы (на которой идет специфический синтез) и нуклеозидтрифосфатов, из которых указанный синтез осуществляется. Таким образом, принцип комплементарности оказался ведущим не только в строении нуклеиновых кислот, но и в их биосинтезе. Как будет показано ниже, этот принцип имеет огромное значение при специфическом воспроизведении первичной структуры белковых молекул. Взаимодействие комплементарных структур, обеспечивающее воспроизведение специфического строения макромолекул при их биосинтезе, — один из важнейших законов, сформулированных в биохимической науке за последние годы. Вместе с тем матричный, комплементарный механизм биосинтеза макромолекул, с полным правом, можно отнести к элементарным, фундаментальным свойствам живой материи. Матричный принцип биосинтеза — это специфика химизма живого. Так, молекулярная биология и биохимия пришли к крупнейшему обобщению, которое конкретно характеризует специфику живого, отличие живого от неживого на молекулярном уровне.
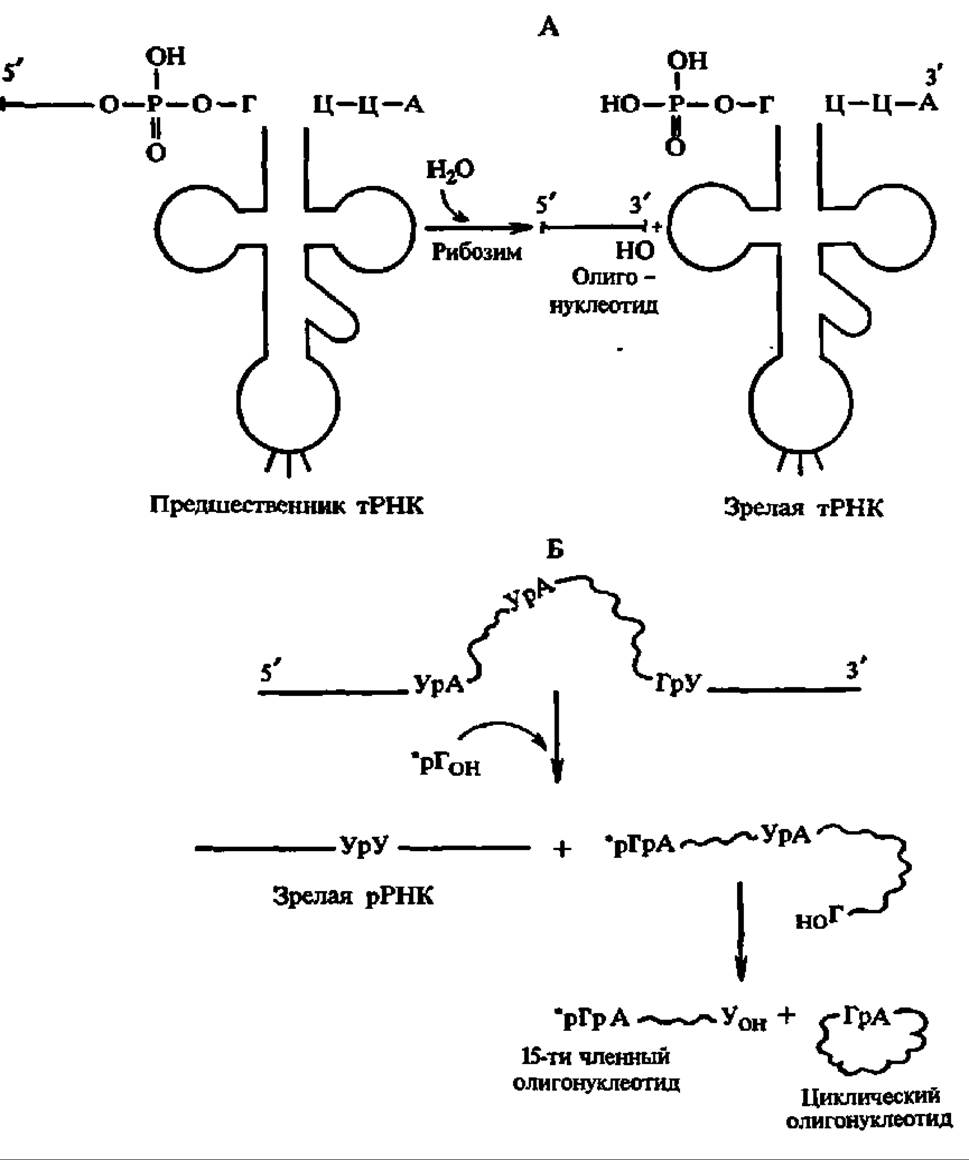
Рис. 88. Процессинг пре-РНК:
А — пре-тРНК при участии рибозима; Б — пре-рРНК: путем аутосилайсинта (сплошная линия — функциональная зона; волнистая — неинформативный фрагмент; рГ-гуансзии). Остальные пояснения в тексте