Основы биохимии - Филиппович Ю. Б. 1999
Обмен белков
Биосинтез белков
Проблема биосинтеза белка — одна из двух наиболее важных и острых проблем современного естествознания: если в неживой природе принципиально новые пути получения энергии будут найдены благодаря успехам физики элементарных частиц, то в живой природе решение кардинального вопроса управления самой жизнью может быть получено в результате познания химии и биологии белковых тел.
В изучении строения и биосинтеза белка, как в фокусе, скрещиваются пути решения важнейших вопросов биологической науки: выяснение законов наследственности и изменчивости, управление ростом и развитием организмов, выявление причин возникновения и разработка методов лечения многих болезней и т. п. Вполне закономерно поэтому, что XX в. физики называют веком атома, а биохимики — веком белка.
Биосинтез белков в организме осуществляется весьма интенсивно. Средняя скорость сборки полипептидных цепей в клетках бактерий составляет 16—17 аминокислотных остатков в 1 с, дрожжей — 7—10, млекопитающих — 5—7. Время синтеза (в с) молекулы глобина в ретикулоцитах кролика равно 20, овальбумина в яйцеводах курицы — 80; суммарных белков в печени крысы — 80. За 1 мин в ретикулоците кролика синтезируется 5 ∙ 104 молекул глобина, в клетке яйцеводов курицы — 6 ∙ 105 молекул овальбумина, в гигантской клетке заднего отдела шелкоотделительной железы тутового шелкопряда — 38 ∙1011 молекул фиброина шелка.
История развития представлений о механизме биосинтеза белков. Путь, пройденный при разработке одной из центральных проблем современной биохимии — механизма биосинтеза белков, крайне поучителен и противоречив.
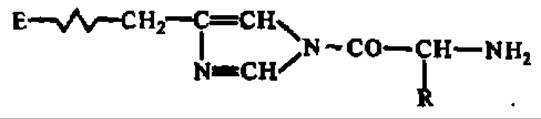
Первой по времени была гипотеза обращения протеолиза. Она восходит к концу прошлого столетия. В 1886 г. А. Я. Данилевский наблюдал образование белковоподобных веществ при действии ферментов желудочного сока на концентрированный раствор пептонов, возникших в результате расщепления белка пепсином. Позже был расширен круг ферментов, способных к обращению протеолиза (трипсин, пепсин, папаин, катепсины), и белков, с неполными гидролизатами которых такое обращение удавалось осуществить (альбумины, глобулины, фибрин, казеин и др.). Продукты, возникающие в результате обращения реакции гидролиза белков, назвали пластеинами.
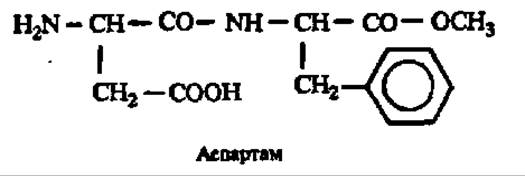
Хотя сейчас ясно, что реакции пластеинообразования не имеют отношения к природному биосинтезу белков, они вплоть до сегодняшнего дня привлекиют внимание исследователей, так как нашли практическое применение при переработке непищевых белков в пищевые и синтезе пептидов, в частности аспартама (метиловый эфир L-а-аспартил-L-фенилаланина), используемого как заменитель сахарозы (он в 100 раз слаще нее) в кондитерской промышленности (коммерческое название — сластилин):
Определенный вклад в развитие современных представлений о механизме биосинтеза белков внесли исследования биосинтеза квазипептидных связей (т. е. не истинных пептидных связей, но близких к ним), осуществленные в 50-е годы в ряде лабораторий, в том числе у нас в лаборатории А. Е. Браунштейна. Будучи проведены на таких соединениях, как глутамин, ацетанилид, глутатион и гиппуровая кислота, эти исследования доказали ферментативный характер реакций их образования, необходимость энергообеспечения за счет окислительных процессов и, что самое важное, участие в биосинтезе квазипептидных связей АТФ.
Столь же существенными оказались результаты разработки гипотезы транспептидирования в качестве возможного варианта механизма биосинтеза пептидных связей. В нашей стране исследования в этом направлении интенсивно проводились в 50-е годы В. Н. Ореховичем с сотр. При изучении реакций транспептидирования впервые было показано, что перенос аминоациальных или пептидильных группировок на аминогруппу аминокислот может происходить не только с амидной или пептидной связи, но и со сложноэфирной связи. В дальнейшем оказалось, что именно этот механизм лежит в основе реакции транспептидирования в рибосоме.
Гипотеза подстаиовки аминокислот, возникшая в тот же период в связи с внедрением в биохимию метода радиоактивных индикаторов, не оказала сколько-нибудь существенного влияния на развитие представлений о механизме биосинтеза белков.
Переломным моментом в развитии подходов к выяснению механизма биосинтеза белковых тел было установление сцепленности его с биосинтезом РНК (Ж. Браше, 1941; Т. Касперсон, 1941). Оно привело к созданию матричной схемы биосинтеза белков, являющейся фундаментом современных представлений в этой области. Матричный механизм биосинтеза полимеров, обеспечивающий безошибочное воспроизведение их первичной структуры, представляет одну из наиболее специфических черт живого. Он является превосходным примером тех принципиально новых закономерностей, которые сопровождают возникновение и развитие биологической формы движения материи: малоэффективный механизм обычного химического синтеза, основанного на беспорядочном столкновении молекул, заменен здесь направленным, специфическим синтезом на шаблоне; скорость его в миллиарды раз превышает таковую в неупорядоченных системах.
Принципиальное значение в разработке вопроса о механизме биосинтеза белков имело выявление локализации его в рибосомальном аппарате клетки и создание бесклеточных систем, где единственной структурой, на которой протекал биосинтез белка, были рибосомы (см. с. 280). Выяснение их строения и функции принесло неоценимую информацию об этапах матричного биосинтеза белка и тончайших молекулярных механизмах, которые ему сопутствуют.
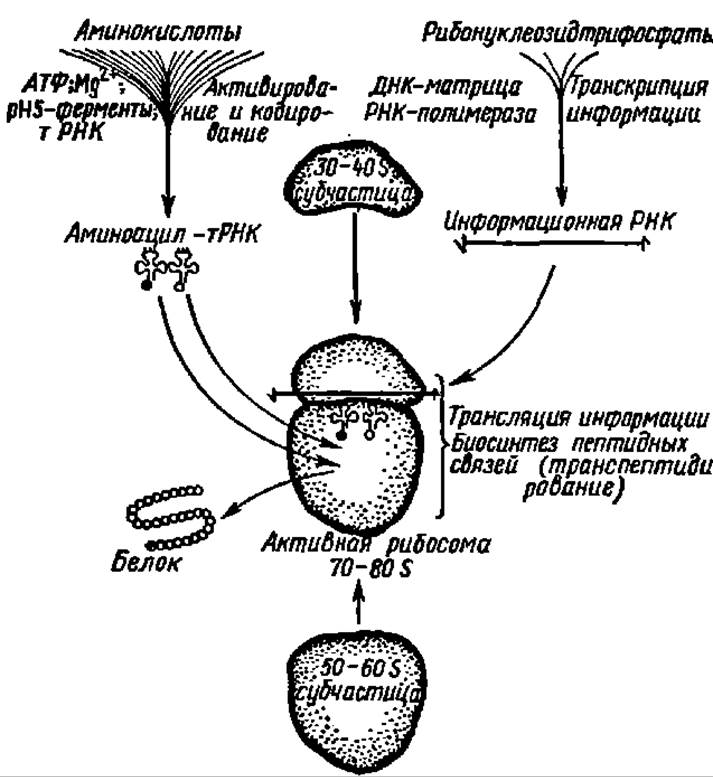
Рис. 93. Общая схема матричного биосинтеза белковых тел (пояснение в тексте)
Как будет показано ниже, наряду с матричным механизмом в природе существует мультиэнзимный путь биосинтеза белков и пептидов, где специфическое чередование аминокислот обеспечивается расположением каталитически активных белков в мультиэнзимном комплексе.
Матричный механизм биосинтеза белков. Общая схема матричного биосинтеза белковых тел представлена на рис. 93. Она складывается из трех подготовительных процессов — переноса вещества, энергии и информации в рибосому, и главного центрального процесса — сборки полипептидных цепей в рибосоме. Один из элементов указанной схемы (правая верхняя часть рисунка) — транскрипция (переписывание) информации о порядке расположения аминокислотных остатков в молекуле синтезируемого белка — рассмотрен ранее. Известно, что информация об этом закодирована в генетическом аппарате клетки последовательностью дезоксирибонуклеотидных остатков в молекуле ДНК. Будучи преобразована (транскрибирована) в последовательность рибонуклеотидных остатков в информативной части молекулы мРНК, синтезированной на ДНК в качестве матрицы, эта информация о первичной структуре белка поступает в рибосому. Здесь она переводится (транслируется) с полинуклеотидной последовательности в аминокислотную последовательность новообразуемого в рибосомальном аппарате белка. Два других процесса — перенос вещества (18 протеиногенных аминокислот и двух амидов) и перенос энергии, необходимой для синтеза пептидных связей (левая верхняя часть рисунка), равно как и наиболее сложный процесс — сборка полипептидной цепи в активной, транслирующей рибосоме (центральная часть рисунка), нуждаются в детальной характеристике. Она дана ниже.
Активирование аминокислот и перенос их в рибосому. Синтез пептидной связи из свободных аминокислот протекает с поглощением энергии в количестве около 12 кДж/моль. В связи с этим давно уже была высказана идея о сопряженности биосинтеза белка с окислительными процессами (А. В. Благовещенский, М. П. Юргенсон, 1937) или с распадом соединений, содержащих макроэргические связи (Ф. Липман, 1941). Развитие последнего направления привело к обнаружению ферментативного процесса активирования аминокислот. В 1955 г. М. Хогленд впервые предложил общепринятую сейчас двухэтапную схему этой реакции.
Первый ее этап состоит во взаимодействии аминокислоты с АТФ, в результате чего возникает аминоациладенилат и выделяется пирофосфат. Гидролитический распад последнего при участии пирофосфатазы обеспечивает необратимость реакции образования аминоациладенилата. Химизм реакции этого этапа активирования аминокислот рассмотрен ранее (гл. III) при характеристике лигаз, катализирующих синтез С—О-связей (см. с. 137). Второй этап сводится к переносу аминокислоты с образовавшегося аминоациладенилата на концевой аденозин акцептирующего стебля тРНК:
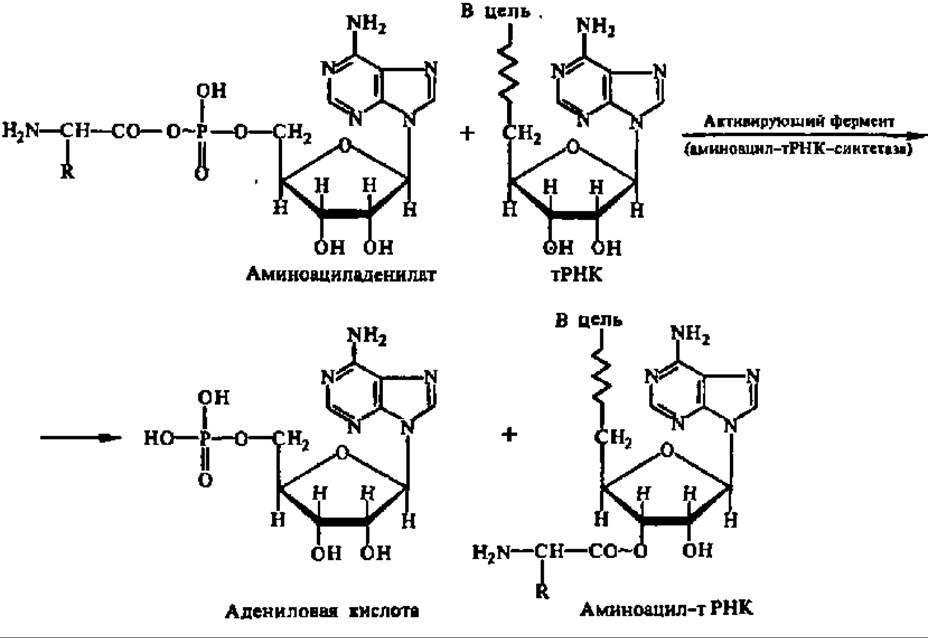
Как видно из структурной формулы аминоациладенилата, он представляет ангидрид аминокислоты и остатка фосфорной кислоты аденозин-5'-фосфата, причем донором кислорода для ангидридной связи является ОН-группа карбоксила аминокислоты. Будучи ангидридами, свободные аминоациладенилаты с исключительной легкостью вступают в реакцию с аминокислотами даже при очень небольшой концентрации (10-3 моль), при почти нейтральной реакции среды (pH 7,4). Реакция осуществляется без участия ферментов и сопровождается образованием пептидных связей. Столь же энергично они ацилируют свободные, доступные аминогруппы белковой молекулы. В то же время в связанном с ферментом состоянии аминоациладенилаты крайне инертны, и об их использовании для синтеза белка прямо из состава комплекса не может быть речи.
Специфичность реакции активирования аминокислот по вышеуказанной схеме близка к абсолютной. Ее оценивают как сверхспецифичность. Активируются изомеры аминокислот только природного L-ряда; D-изомеры аминокислот в реакцию не вступают. Однако некоторые гомологи L-аминокислот активируются наряду с белковыми L-аминокислотами.
Каталитическое ускорение активирования каждой протеиногенной аминокислоты осуществляется собственным, специфичным только для данной аминокислоты ферментом. Эти ферменты обнаружены у представителей различных классов животных, растений (в том числе водорослей) и микроорганизмов, т. е. они распространены повсеместно. Это указывает на их важнейшую роль в биосинтезе белков.
Активирующие ферменты изолируют при низкой температуре из так называемой рН5-фракции надосадочной жидкости. Последнюю получают после ультрацентрифугирования разведенного гомогената клеток при 105 000 g в течение 1 ч, в результате чего все структурные элементы клеточного содержимого осаждаются. При подкислении надосадочной жидкости СН3СООН (НСl денатурирует ферменты) до pH 5,3 из нее выпадает осадок, содержащий смесь активирующих аминокислоты ферментов. Поэтому первоначально их называли рН5-ферментами. В соответствии с современной номенклатурой их называют аминоацил-тРНК-синтетазами (АРСазами).
Из работ последних лет следует, что аминоацил-тРНК-синтетазы в клетках существуют в виде высокомолекулярных комплексов — кодосом. При константе седиментации 26—29S и М~1,4 мегаДа эти комплексы включают несколько АРСаз (специфичных, например, к ала, гли, глу, лей и сер или к лиз, мет, арг, лей и три) и ферменты, модифицирующие АРСазы и регулирующие их активность — протеинкиназы, метилтрансферазы, АДФ-рибозилтрансферазы, фосфопротеинфосфатазы и др.
Ферменты, активирующие аминокислоты, исключительно лабильны, они легко денатурируются с потерей активности. Даже разрушение клеток ультразвуком при выделении энзиматического препарата и непродолжительное хранение ведут к их инактивации. Для нормальной деятельности активирующих аминокислоты ферментов необходимо присутствие в реакционной среде Mg2+, так как связывание АТФ идет по имидазольному радикалу гистидина активного центра фермента через ион магния.
Молекулярные массы большинства АРСаз (их выделено в высокоочищенном состоянии более 50) близки к 100000, хотя в отдельных случаях достигают 200 000 и более (глицил- и фенилаланил-тРНК-синтетазы). Молекулы у большей части АРСаз являются димерами или тетрамерами (иногда — тримерами) и лишь у единичных АРСаз (например, у аланил-, аргинил-, аспартил-, валили изолейцил-тРНК-синтетаз) представлены одной полипептидной цепью, включающей примерно 1000 аминокислотных остатков. Характерно, что у АРСаз с димерной структурой субъединицы работают сопряженно: высвобождение синтезированной аминоацил-тРНК с одной из них происходит в тот момент, когда к другой вслед за АТФ и аминокислотой присоединяется тРНК. Следовательно, каждая субъединица в молекуле АРСазы обладает тремя структурно обособленными центрами связывания перечисленных субстратов, причем посадка каждого предшествующего субстрата облегчает акцептирование последующего. Поэтому в процессе аминоацилирования тРНК легко возникают тройные фермент-субстратные комплексы. Наименее прочно с АРСазами связывается АТФ (Ks = 10-4 моль), на порядок лучше — аминокислоты (Ks = 10-5моль) и наиболее мощно — тРНК (Кs = 10-8моль). АРСазы — самые «медленные» ферменты; их молекулярная активность составляет от нескольких десятков до нескольких сотен каталитических актов в 1 мин.
Исходя из изучения различными методами активных центров АРСаз и исследования кинетики ускоряемых ими реакций активирования аминокислот, начал проясняться механизм их действия. Первой к АРСазе присоединяется АТФ, аденилирующая остаток гистидина в активном центре фермента с выделением пирофосфата:
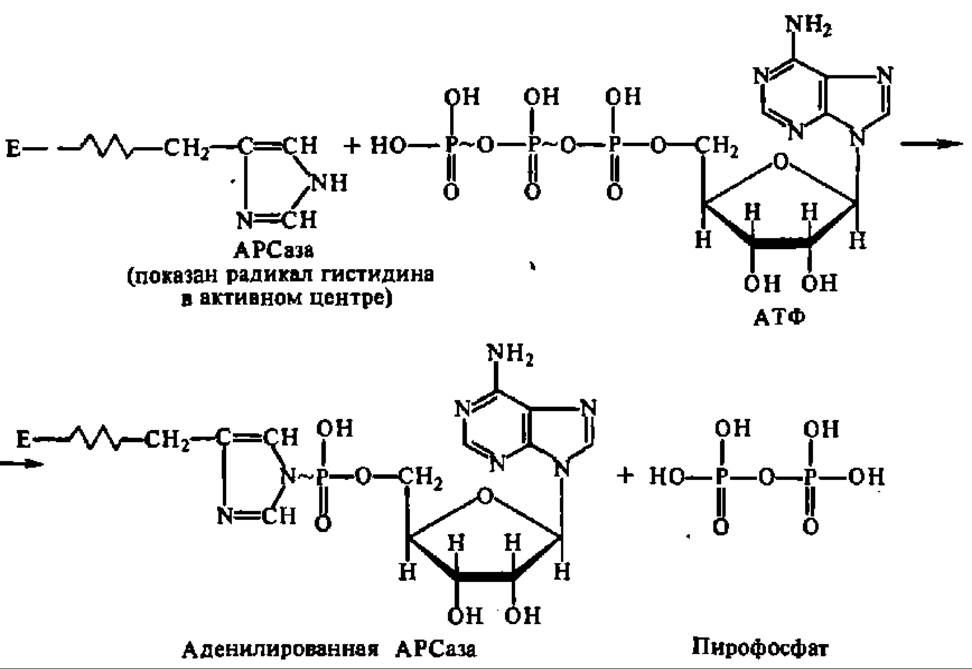
С аденилированной АРСазой взаимодействует активируемая при ее посредстве аминокислота, в результате чего возникает аминоациладенилат. Последний, обладая выдающейся способностью аминоацилировать любые радикалы, содержащие подвижный атом водорода, передает аминоацильную группу на радикал гистидина активного центра АРСазы, в результате чего образуется аминоацилированный фермент:
После связывания ферментом соответствующей тРНК аминоацильная группа передается на ОН-группу остатка аденозина ее акцептирующего конца (уравнение реакции см. с. 281). У некоторых АРСаз роль остатка гистидина в осуществлении приведенных выше этапов активирования аминокислоты может играть радикал глутаминовой кислоты.
При образовании фермент-субстратного комплекса из АРСазы и тРНК и та и другая претерпевают конформационные перестройки, облегчающие реакцию аминоацилирования. Однако самым существенным и интригующим моментом взаимодействия АРСазы и тРНК является их способность безошибочно узнавать друг друга в соответствии с абсолютной специфичностью к той или иной аминокислоте. По-видимому, она базируется на многоточечном взаимодействии фермента и тРНК, причем существенная роль в узнавании принадлежит антикодону тРНК.
Долгое время считали, что аминоацильная группа всегда присоединяется по ОН-группе 3'-углеродного атома рибозы концевого аденозина молекулы тРНК. Оказалось, что иногда эту же функцию может выполнять гидроксил 2'-углеродного атома остатка рибозы. Это наблюдается при активировании фенилаланина, лейцина и изолейцина при участии соответствующих АРСаз. В противоположность этому серил- и треонил-тРНК-синтетазы обеспечивают присоединение аминоацильных групп только по 3'-углеродному атому рибозы, а тирозин- и цистеин-тРНК-лигазы — по 2'- и по 3'-углеродным атомам. Установлено также, что аминоацильная группа в аминоацил-тРНК способна перемещаться от 2'- к 3'-углеродному атому рибозы и наоборот, вплоть до установления равновесия:
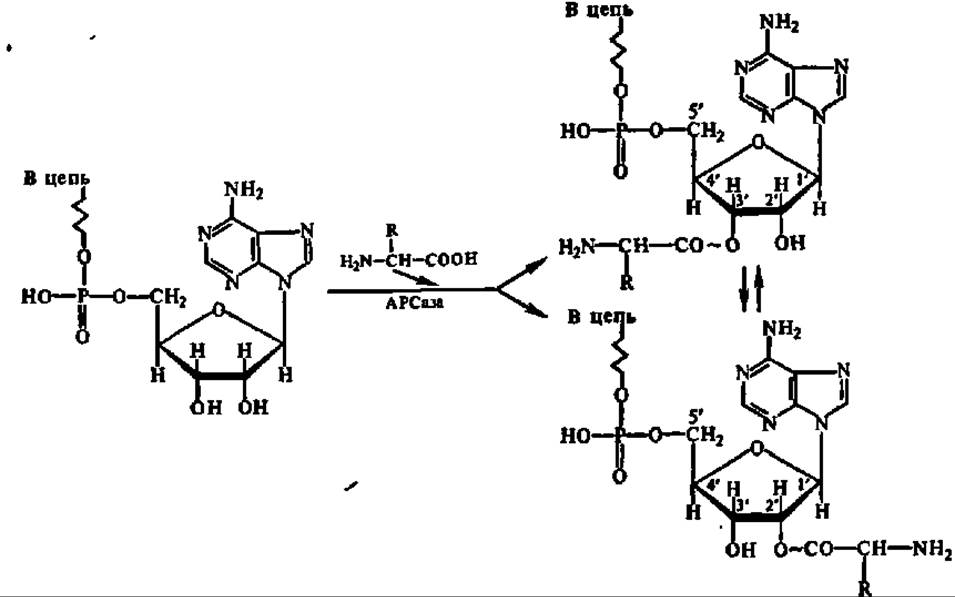
Полагают, что аминоацилирование тРНК либо в 2'-, либо в 3'-положении остатка рибозы концевого аденозина' предупреждает от ошибок при активировании стереохимически близких аминокислот (например, валина и треонина). Впрочем, если даже ошибка произошла, т. е. вместо специфической для данной тРНК аминокислоты к ней присоединилась какая-то иная, АРСаза может исправить ошибку сама, так как обладает способностью гидролизовать чуждые ей неспецифические аминоациладенилаты.
Таким образом в процессе активирования неуклонно обеспечивается строго избирательное присоединение каждой аминокислоты к специфичной для нее тРНК и создание набора аминоацил-тРНК, непосредственно поставляющих энергетически обогащенные аминокислотные остатки в рибосому.
То, что это действительно так, т. е. что аминоацил-тРНК являются единственным источником аминокислотных остатков при биосинтезе белка, доказано в опытах с аминоацил-тРНК, содержащими 14С-аминокислоты: по мере инкубации в белоксинтезирующей системе содержание меченой аминокислоты в препарате аминоацил-тРНК падает, но в такой же пропорции зеркально возрастает в синтезируемом белке (рис. 94).
Активирование аминокислот сопровождается их кодированием (шифрование): после присоединения к соответствующей тРНК аминокислота получает код, или шифр, в виде строго специфичного только для данной аминокислоты чередования трех нуклеотидных остатков в антикодоновой петле тРНК (см. с. 216). Этот триплет оснований называется антикодоном. Ему соответствует комплементарный кодон в составе мРНК. Взаимодействие кодонов мРНК с антикодонами аминоацил-тРНК предопределяет порядок чередования аминокислотах остатков в синтезируемом по матричной схеме белке. Это принципиально важное положение доказано экспериментально и известно как «опыт Шапвиля» (по имени одного из ученых, участвовавших в его проведении). В этом опыте цистеинил-тРНК путем восстановления по аминоацильному остатку была превращена в аланил-тРНК:
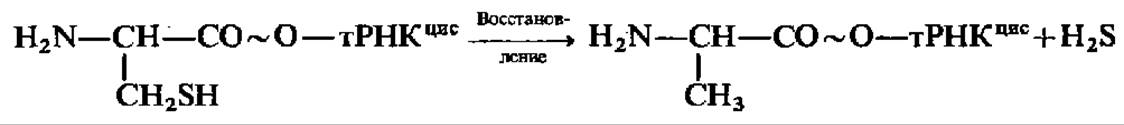
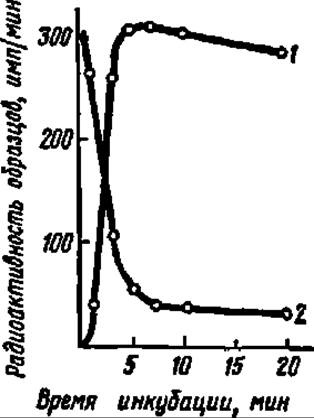
Рис. 94. Доказательство включения 14С-лейцина в белок (1) из состава 14С- лейцил-тРНК (2) пояснение в тексте)
Синтезированная так аланил-тРНКцис содержит остаток аланина, присоединенный к тРНК, несущей антикодон цистеина. Когда ее ввели в белоксин-тезирующую систему, в полипептидной цепи образующегося белка позиции цистеина оказались занятыми остатками аланина. Это однозначно указывает на то, что именно тРНК кодирует вступление соединенного с ней аминоацильного остатка в заданное положение в новообразуемой белковой молекуле. Поэтому аминоацил-тРНК-синтетазы одно время называли кодазами или шифразами; однако комиссия по номенклатуре ферментов не рекомендовала использовать эти термины, и их сейчас не употребляют.
Матричный механизм сборки полипептидной цепи. Биосинтез белков во всех структурных элементах клетки (ядро, митохондрии, хлоропласта, эндоплазматический ретикулум и др.) идет на рибосомах. Поэтому именно на пути исследования структуры и свойств рибосом, а также механизма их взаимодействия с исходными для биосинтеза белков соединениями достигнуты наиболее впечатляющие результаты в выявлении закономерностей новообразования белковых тел.
Строение и свойства рибосом. Рибосомы — мельчайшие тельца рибонуклеопротеиновой природы. Они содержатся в основном в цитоплазме растительных, животных и бактериальных клеток в количестве нескольких десятков тысяч в каждой.
Рибосомы выделяют путем дифференциального центрифугирования клеточного содержимого, получаемого после гомогенизации клеток. Известно, что этим путем удается разделить клеточное содержимое на ряд фракций (см. гл. I). Рибосомы связаны главным образом с мембранами эндоплазматической сети. Поэтому при фракционировании содержимого клетки они осаждаются вместе с обломками липопротеиновой мембраны — микросомами.
Для выделения рибосом микросомы обрабатывают дезоксихолатом — реагентом, растворяющим липиды и, следовательно, разрушающим микросомы; затем рибосомы осаждают в изотонических буферных растворах центрифугированием при 100000 g в течение 1 ч. При разрушении других субклеточных частиц (ядра, пластиды, митохондрии) из них также могут быть выделены рибосомы. В настоящее время выделение рибосом осуществлено из многочисленных объектов — представителей животного и растительного мира, а также микроорганизмов. Форма и структура рибосом, выделенных из разных источников, сходна, но по значению константы седиментации их делят на два класса: 70S и 80S. Первые найдены у всех прокариот, а также содержатся в ядрах, митохондриях и хлоропластах эукариот; вторые локализованы в цитоплазме только эукариот.
70S и 80S рибосомы стабильны при концентрации Mg2+, близкой к 0,001 М. При повышении содержания Mg2+ до 0,01 М рибосомы дают димеры или слипаются в более крупные агрегаты, а при понижении до 0,0001 М диссоциируют на субчастицы: 70 (80)S⇄30 (40)S+50 (60)S. Этот процесс диссоциации — ассоциации рибосом и их субчастиц — контролируется также полиаминами (см. с. 211) и изменением концентрации других двухвалентных катионов.
Будучи исключительно рибонуклеопротеинами (их называют также РНП-. частицами), рибосомы составлены из почти равных количеств РНК и белка, варьирующих в зависимости от класса рибосом (табл. 22) с определенно выраженной тенденцией к некоторому преобладанию в них белка.
Таблица 22 Состав рибосом
Класс рибосом |
70S |
80S |
||
Субчастицы рибосом |
30S |
50S |
40S |
60S |
РНК |
16S |
23S и 5S |
18S |
28S, 5S |
и 5,8S |
||||
Число белков |
21 |
34 |
31 |
41 |
Молекулярные массы белков, тыс. дальтон |
12—65 |
9—31 |
10—44 |
10—54 |
Соотношение РНК/белок, % |
37/63 |
36/64 |
54/46 |
41/59 |
Кроме белков и нуклеиновых кислот, в составе рибосом в ничтожных количествах обнаружены другие вещества: Mg2+ и Со2+, ди- и полиамины, ряд других катионов (Fe3+, Zn2+, Al3+, Ва2+, Sr2+, Ni2+, Сr2+, NH4), а также латентная рибонуклеаза.
Рибосомы в нативном состоянии, т. е. в живых клетках, сильно гидратированы: так, на 1 г сухого вещества рибосом из ретикулоцитов приходится 2,7 г гидротационной воды. Это свидетельствует об исключительно высокой «пористости» нативных рибосом.
Белок и РНК в рибосомных частицах соединены очень непрочными связями: уже при инкубации с 0,5—1 М растворами солей при низкой температуре происходит отделение белка от нуклеиновой кислоты. Аналогичная диссоциация происходит, например, при pH 12 в условиях электрофореза. Связи белков с нуклеиновыми кислотами в рибосомах оценивают в основном как электростатические. Высокое содержание в суммарных рибосомальных белках основных аминокислот (12% лизина, 11 % аргинина и 3% гистидина), заряженных положительно, и большое число межнуклеотидных фосфатов в рибосомальных РНК, заряженных отрицательно, обеспечивают условия для возникновения достаточного количества ионных связей между первыми и вторыми.
Структура и функция рибосомальных высокомолекулярных (16—18 и 23—28S) и низкомолекулярных (5S и 5,8S) РНК рассмотрена ранее (см. гл. VI). Что касается структуры и функции рибосомальных белков, то об этом в последние годы получена существенная информация. Как видно из табл. 22, и малые (30—40S), и большие (50—60S) субчастицы рибосом содержат в своем составе строго определенное число белков, крайне гетерогенных по молекулярным массам. Белки, локализованные в малых (30—40S) субчастицах рибосом, обозначают буквой S (от англ. smoli — малый), в больших (50—60S) — L (от франц. large — большой).
Благодаря применению современных методов белковой химии все белки из рибосом кишечной палочки получены в высокоочищенном гомогенном состоянии, у всех у них определены первичные структуры, у многих из них — вторичные и третичные структуры. Как правило, молекулы рибосомальных белков асимметричны, характеризуются наличием значительного количества а-спиралей, глобулярны и компактны (рис. 95). Некоторые из них, будучи обогащены гидрофобными аминокислотами на тех или иных участках полипептидной цепи, легко образуют димеры и даже олигомеры, а также, взаимодействуя друг с другом, — ассоциаты в субчастицах рибосомы.
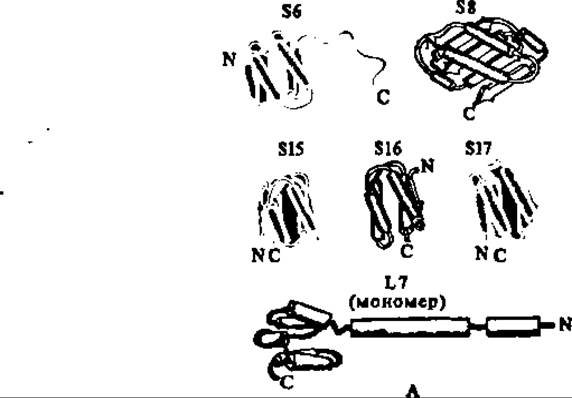
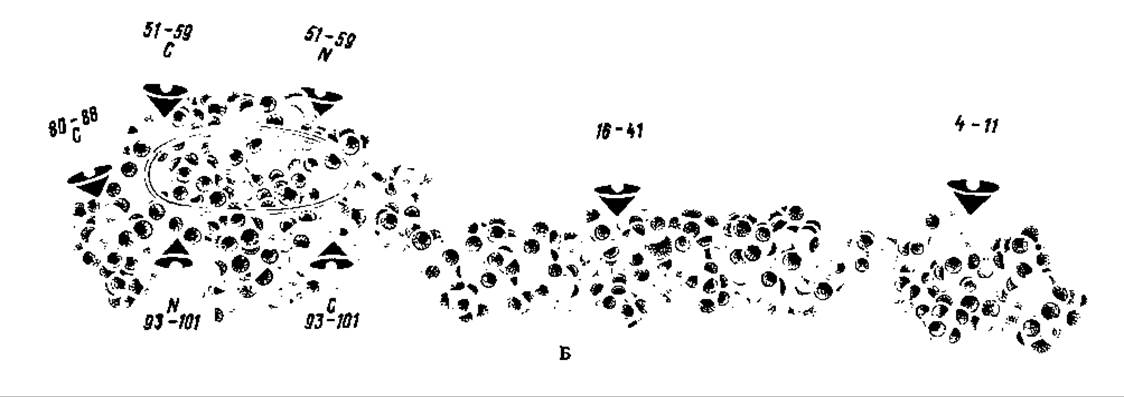
Рис. 95. Третичные структуры белков S6, S8, S15, S16, S17 и L7 (А) и атомная модель белка L7 (Б):
спиральные участки представлены цилиндрами; ß-структурные — стрелками. В белке S6 N-концевой фрагмент 105—135 не обладает третичной структурой. В атомной модели рибосомального белка L7 цифрами обозначены номера N- и С-аминокислотных остатков в-спиральных фрагментов полипептидной цепи, а овалом между а-спиралями 51—59 и 93—101—полость, в которую входят а-спираль 4—11 при образовании димера
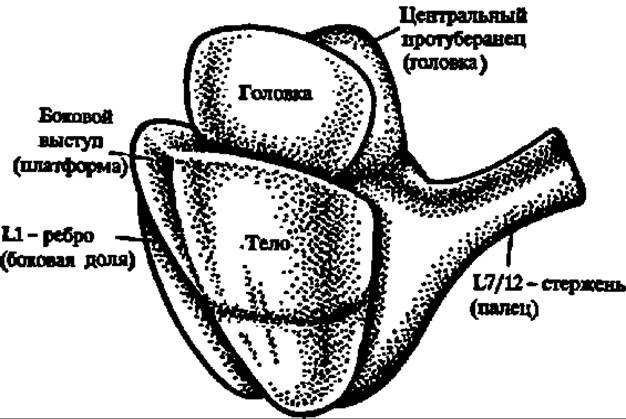
Рис. 96. Пространственная структура 70S рибосомы кишечной палочки (модель):
30S-субчастица — спереди; се размеры: длила — ~23 им, ширина — 12 нм; 50S-субчастица — сзади; ее размеры во всех направлениях около 20— 23 нм; боковые выступы (палец — справа и боковая доля — слева) содержат белки L7/L12 и L1 соответственно. Субчастицы ассоциированы «головка к головке» и боковой выступ к боковой доле («платформа к L- ребру»), 30S-субчастица закрывает только часть SOS-субчастнцы, оставляя свободным район, примыкающий к L7/L12-стержню, где, вероятно, размещаются функционально важные центры рибосомы. По-видимому, при ассоциации 30S и 60S субчастиц в области впадины между головкой и телом 2 = 30S-субчастицы и основанием центрального протуберанца 50S-субчастицы возникает отверстие (зазор), предназначенное, как полагают, для размещения молекулы мРНК
В течение последнего десятилетия достигнуты большие успехи в выяснении пространственного строения рибосом в целом и локализации в их субчастицах отдельных структурных элементов (см. табл. 22). В этом отношении следует особо подчеркнуть заслуги советской школы биохимиков и, в частности, сотрудников Института белка в Биологическом центре РАН (г. Пущино-на-Оке Московской области) — здесь под руководством акад. А. С. Спирина выполнены фундаментальные исследования рибосомального аппарата клетки. Топология рибосом представлена на рис. 96. Сейчас ясно, что основу пространственного строения рибосом задает третичная структура 16—18S и 23—28S рНК, предопределяющая форму и конструкцию 30—40S и 50—60S субчастиц рибосомы соответственно. Это особенно ярко выступает при анализе данных, полученных при выяснении строения 30S субчастицы рибосомы кишечной палочки А. С. Спириным и сотр. Оказалось, что морфологическая модель 30S субчастицы предопределяется 16S рРНК, находящейся в компактной форме, с которой взаимодействуют и располагаются на ней в определенных позициях белки S1—S21, найденные в этой субчастице (рис. 97). Аналогично построена 50S субчастица рибосомы кишечной палочки.
Принципиальное значение для понимания того, как в рибосоме идет синтез белка, имеют данные о локализации в ней центров, где осуществляются важнейшие этапы биосинтеза полипептидной цепи: связывание аминоацил-тРНК, связывание белковых факторов, необходимых для функционирования рибосомы, считывание информации о порядке расположения аминокислотных остатков в новообразуемом белке, синтез пептидной связи, удаление тРНК, высвобождающейся после образования пептидной связи, перенос пептидил-тРНК из аминоацильного центра в пептидильный центр с одновременным продвижением мРНК на один триплет нуклеотидных остатков, гидролиз сложноэфирной связи между полипептидом и тРНК в момент завершения синтеза белка в рибосоме и др. Поэтому рассмотрение современных представлений о структуре рибосомы логично завершить данными о функциональной модели рибосомы (Г. Виттман и др., 1974), где показаны ее функциональные центры (рис. 98).
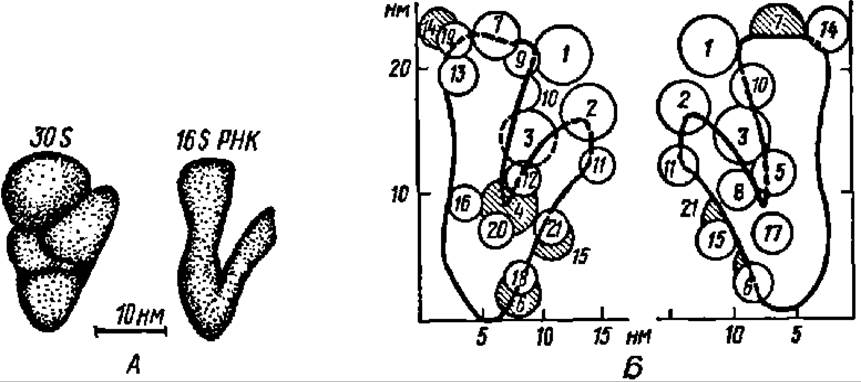
Рис. 97. Пространственная структура 30S-субчастицы рибосомы кишечной палочки:
А — морфологическая модель; Б — расположение белков и РНК в соответствии с моделью (белки, находящиеся на заднем плане, заштрихованы)
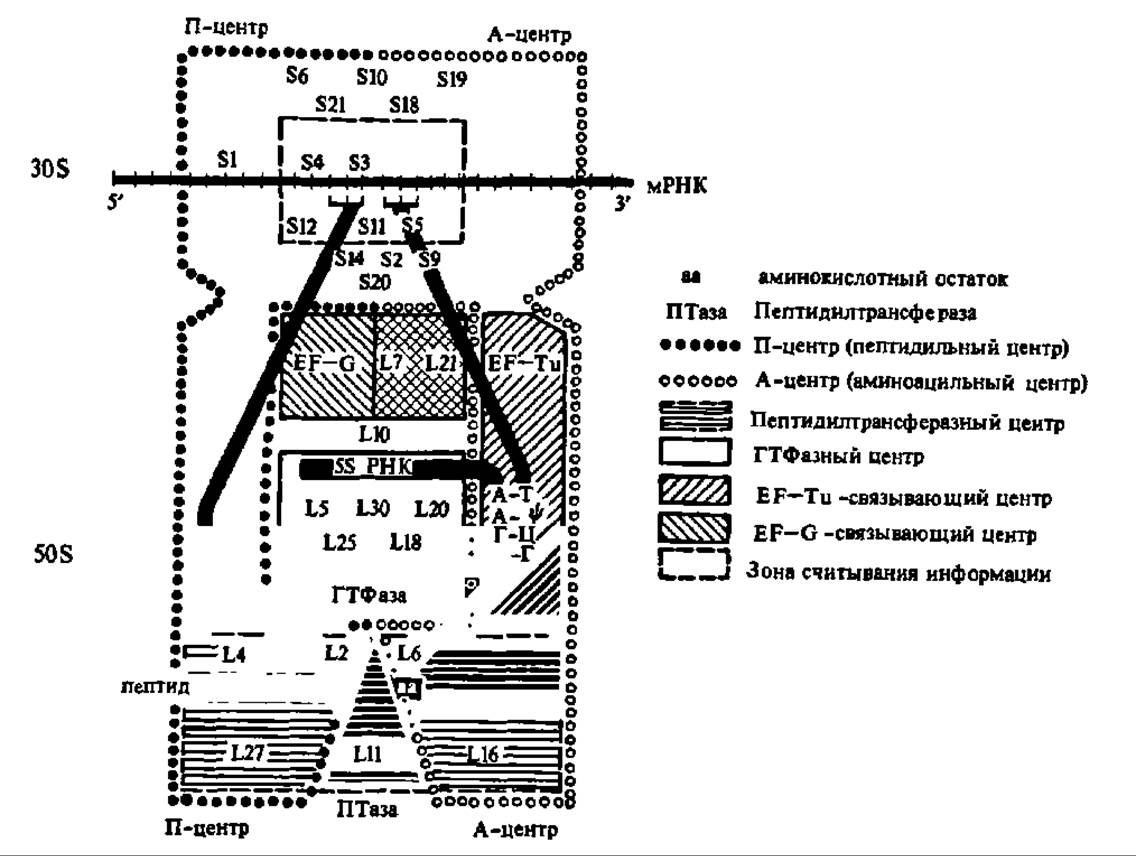
Рис. 98. Функциональная модель рибосомы 70S кишечной палочки
Инициация биосинтеза белка у бактерий происходит при участии трех белковых факторов инициации—IF-1, IF-2 и IF-3 (Initiation Factors 1, 2 и 3). IF-3 представлен белком с М = 21 000—23500. Он вызывает конформационные изменения в 30S субчастице рибосомы, способствующие связыванию ею IF-1, IF-2, ГТФ, мРНК и формилметионил-тРНК. Присоединение последней обеспечивает поступление в рибосомальный аппарат клетки первой, N-концевой аминокислоты, а именно — формилметионина, которым открывается полипептидная цепь любого белка, синтезируемого у бактерий. Впоследствии N-концевой остаток формилметионина в результате посттрансляционных изменений белка может отщепляться. тРНК, переносящая формилметионин в процессе белкового синтеза у бактерий, отличается от тРНК, осуществляющей перенос метионина в процессе сборки полипептидной цепи, т. е. существуют тРНКфмет и тРНКмет:
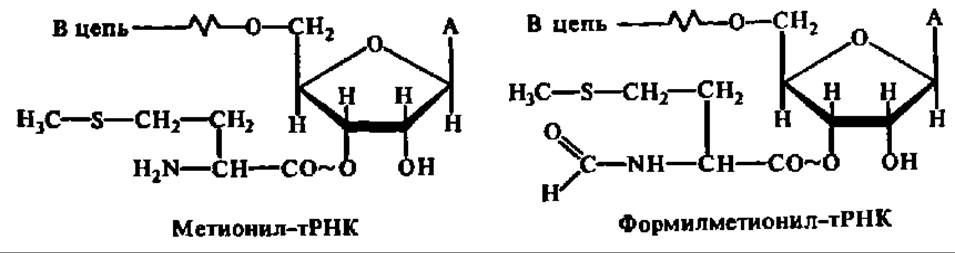
Именно IF-3 присоединяется первым к 30S субчастице рибосомы, открывая этап инициации белкового синтеза и изымая 30S субчастицу рибосомы из пула свободных 30S и 50S субчастиц рибосом, возникающих в процессе диссоциации рибосом 70S. Он же способствует созданию на субчастице 30S мРНК-связывающего центра.
IF-1 и IF-2 представляют белки с молекулярными массами 8900—9400 и 90000—118000 соответственно. IF-1 стимулирует процесс связывания фактора IF-2 с 30S субчастицей рибосомы и способствует присоединению к ней мРНК. IF-2 играет центральную роль в связывании формилметиониновой тРНК с субчастицей 30S и в гидролизе гуанозинтрифосфата. Последний необходим для осуществления инициации биосинтеза белка, хотя полностью его функция в этом процессе еще не выяснена.
Присоединение IF-1, IF-2, формилметионил-тРНК и ГТФ к 30S субчастице осуществляется в виде комплекса (см. рис. 99). Как только оно произойдет, к ней же присоединяется мРНК, причем в результате взаимодействия антикодона формилметиониновой тРНК с кодоном мРНК (им является триплет АУГ) предопределяется такое расположение мРНК на рибосоме, которое обеспечивает далее считывание содержащейся в последовательности ее нуклеотидных остатков информации о первичной структуре синтезируемого белка. Таким образом, именно формилметиониновая тРНК помогает мРНК найти на 30S субчастице ту позицию, которая необходима для трансляции информации о последовательности аминокислотных остатков в белке, и именно в этом заключается ее значение в инициации белкового синтеза у бактерий. У эукариот эту функцию часто выполняет тРНКмeт, но опять специфичной структуры, которая отличается от структуры тРНКмeт, переносящей остатки метионина в процессе элонгации белкового синтеза.
Вместе с тем сейчас показано, что гораздо большее значение для стабилизации необходимого расположения мРНК в 30S субчастице имеет присутствующая в ней три главных этапа матричного биосинтеза белка — инициация, элонгация и терминация — выделены рамками; белковые факторы инициации и элонгации указаны условными значками, приведенными непосредственно на схеме; часть условных обозначений дана отдельно в верхнем правом углу рисунка
последовательность Шайна—Дальгарно (короткая — ААГГА или длинная — УААГГАГГ), взаимодействующая с комплементарным фрагментом на 3'-конце 16S рРНК и находящаяся на расстоянии от 5 до 13 н. о. от стартового АУГ кодона.
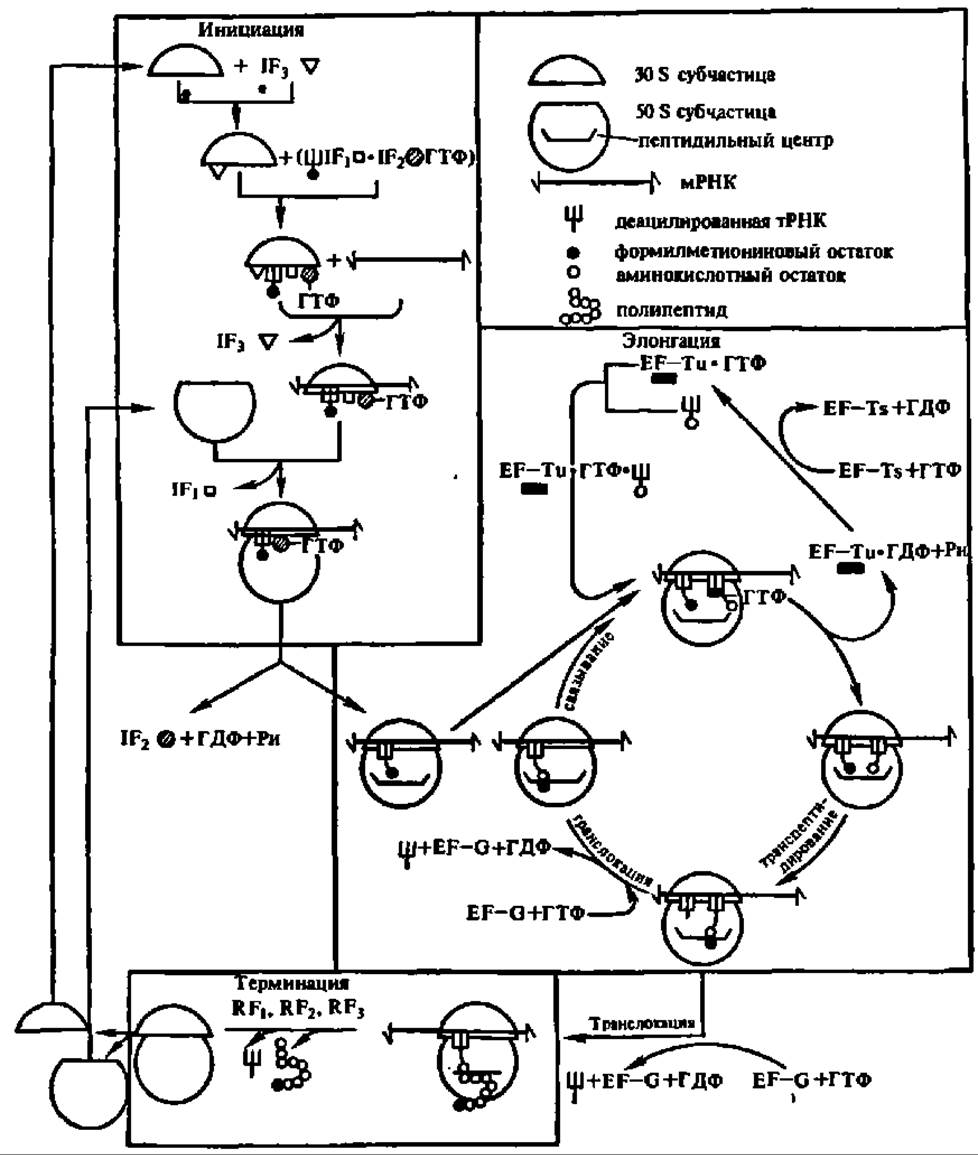
Рис. 99. Схема биосинтеза белка у кишечной палочки (пояснение в тексте):
Присоединение мРНК к комплексу, состоящему из 30S субчастицы, факторов инициации и ГТФ сопровождается высвобождением фактора инициации IF-3, выполнившего присущую ему функцию (см. рис. 99). Комплекс, включающий теперь в свой состав еще мРНК, жадно притягивает 50S субчастицу и соединяется с ней, образуя 70S рибосому, причем 1F-1 в этот момент покидает рибосому, так как он тоже выполнил свою ролы стабилизацию в рибосоме мРНК. Сохранившийся еще в возникшей 70S рибосоме IF-2, связанный с ГТФ, обеспечивает ускорение реакции распада ГТФ на ГДФ и неорганический фосфат и высвобождается из рибосомы вместе с продуктами гидролиза ГТФ. Выделяющаяся при гидролизе ГТФ энергия, видимо, необходима для осуществления конформационных перестроек в рибосоме 70S, в результате чего формилметионил-тРНК стабилизируется в пептидильном центре рибосомы (см. 1-ю фазу элонгации на рис. 99). Такая рибосома способна теперь вести сборку полипептидной цепи белка заданной структуры, вследствие чего ее называют транслирующей (активной) рибосомой. В транслирующей рибосоме идет, следовательно, процесс элонгации белкового синтеза.
В клетках эукариот инициация рибосомального белкового синтеза идет тоже при участии эукариотических факторов инициации (eIF — eukaryotic Initiation Factors). Их насчитывается девять: eIF-1, eIF-2, eIF-3, eIF-4A, eIF-4B, eIF-4C, eIF-4D, cIF-5 и eIF-6. Все они, за исключением eIF-2 и eIF-3, представлены одиночными полипептидами с М от 15000 (eIF-І) до 160000 (eIF-5). Фактор eIF-2, по-видимому, является димером (М = 86000; а-субъединица — 38000; ß-субъединица — 48000); eIF-3 состоит из нескольких субъединиц при суммарной молекулярной массе более 500000.
Из девяти перечисленных белковых факторов абсолютно необходимы для инициации биосинтеза белка у эукариот eIF-2, eIF-3 и eIF-5, а остальные факторы усиливают функции этих трех. Фактор eIF-2 взаимодействует своей ß-субъединицей с метионил-тРНК, а а-субъединицей — с ГТФ, образуя комплекс с субчастицей 40S. Его деятельность контролируется фосфилированием а-субъединицы при участии специфической протеинкиназы. Фактор eIF-3 тоже присоединяется к субчастице 40S, что сопровождается возникновением на ней мРНК-связывающего центра и стабилизацией связи с нею комплекса eIF-2 ∙ метионил-тРНК ∙ ГТФ. После присоединения мРНК к субчастице 40S по мРНК-связывающему центру она, при участии фактора eIF-5, энергично притягивает 60S субчастицу, происходит выброс всех присоединенных ранее, в том числе и eIF-5, белковых факторов, гидролиз ГТФ и закрепление метионил-тРНК в пептидильном центре возникшей активной, способной осуществлять трансляцию рибосомы 80S. Фактор eIF-6 обеспечивает диссоциацию 80S рибосомы на субчастицы 40S и 60S, высвобождая 40S субчастицу для нового цикла инициации.
Элонгация биосинтеза белка в бактериальной клетке обслуживается тремя белковыми факторами элонгации: EF-Tu, EF-TS и EF-G (элонгационные факторы трансляции трех типов — w, s и G). У млекопитающих два фактора элонгации: TF-1 и TF2 (трансляционные факторы первый и второй). EF-Tu (М = 47 000) и EF-Ts(М = 35000) бактерий соответствует TF-1 (М = 186000) млекопитающих, a EF-G бактерий—TF-2 (М = 70 000) млекопитающих. EF-G кишечной палочки имеет молекулярную массу 77321,45 и представлен полипептидом (701 аминокислотный остаток), первичная структура которого выяснена.
Процесс элонгации начинается со связывания аминоацил-тРНК, содержащей аминокислотный остаток, который должен быть вторым с N-конца молекулы синтезируемого в рибосоме белка. У бактерий эта аминоацил-тРНК образует комплекс с EF-Tu и ГТФ, в виде которого она присоединяется к аминоацильному центру транслирующей рибосомы в соответствии с кодом белкового синтеза (см. ниже), т. е. благодаря взаимодействию комплементарных триплетов антикодона тРНК и кодона мРНК, локализованного против аминоацильного центра рибосомы (см. рис. 98 и 99). У млекопитающих это происходит при участии TF-1.
По современным данным, не только кодон — антикодоновое взаимодействие предопределяет отбор соответствующих аминоацил-тРНК для сборки полипептидной цепи. В этом участвует вся молекула тРНК, так как посттрансляционная модификация сильно изменяет ее способность акцептироваться рибосомой. В процесс декодирования вовлекаются и белки рибосомы: S4, S9, S13, L2 и L7. Два последних, будучи локализованы в пептидильном центре рибосомы, образуют с двумя молекулами тРНК тетрамерный комплекс.
И аминоацил-тРНК, и ГТФ связываются с EF-Tu за счет свободных HS-групп остатков цистеина его молекулы, причем первичная структура центра связывания ГТФ (и ГДФ соответственно) на протяжении 42 аминокислотных остатков расшифрована. Активность EF-Тu регулируется фосфорилированием и взаимодействием с pplpp1.
Благодаря расщеплению ГТФ на ГДФ и неорганический фосфат аминоацил-тРНК сближается с формилметионил-тРНК, локализованной в пептидильном центре рибосомы, a EF-TU в комплексе с ГДФ и неорганический фосфат выносятся из рибосомы. EF-Tu ∙ ГДФ-комплекс при взаимодействии с EF-TS и ГТФ преобразуется в EF-Tu ∙ ГТФ-комплекс, способный соединяться со следующей молекулой аминоацил-тРНК (см. рис. 99).
В пептидильном центре между формилметионил-тРНК и аминоацил-тРНК происходит реакция, благодаря которой остаток формилметионина переносится на свободную NH2-гpyппy аминокислотного остатка, являющегося составной частью аминоацил-тРНК. В результате возникает дипептидил-тРНК, т. е. замыкается первая пептидная связь в будущей молекуле белка, а также образуется деацилированная тРНКфмет (см: рис. 99). Этот процесс получил название реакции транспептидирования. Он ускоряется соответствующим ферментом, причем транспептидазная активность присуща рибосомным белкам L16, L11 и L6 и, вероятно, фрагменту 23S рРНК (см. рис. 98).
Пептидил-тРНК на следующей фазе элонгации переносится на место тРНКфмет в пептидильном центре рибосомы, а последняя удаляется из него, перемещаясь в Е-центр рибосомы, из которого она затем вытесняется очередной аминоацил-тРНК и выносится из рибосомы.
Эта ступень элонгации называется транслокацией и происходит при участии EF-G у бактерий и TF-2 у эукариот, а также сопровождается непременным гидролизом еще одной молекулы ГТФ (см. рис. 99). В результате транслокации дипептидил-тРНК занимает место в пептидильном центре рибосомы, тогда как ее аминоацильный центр полностью освобождается и готов теперь принять новую аминоацил-тРНК вкупе с EF-Tu или TF-1 и ГТФ. Особенно важно, что при транслокации пептидил-тРНК перемещается в пептидильный центр рибосомы вместе с молекулой мРНК, с которой она связана благодаря антикодонкодоновому взаимодействию (см. рис. 98). Это перемещение идет точно на один триплет нуклеотидных остатков, т. е. напротив аминоацильного центра оказывается следующий по порядку кодон молекулы мРНК, предопределяющий, какая аминоацил-тРНК вступит в аминоацильный центр рибосомы и явится источником очередного аминокислотного остатка в новообразуемом белке.
Терминация белкового синтеза в рибосоме осуществляется тоже при участии трех белковых факторов: RF-1, RF-2 и RF-З у бактерий и единственного белкового фактора—R—у высших организмов (от англ. recognize — узнавать). В клетке кишечной палочки насчитывается примерно по 500 молекул этих белков. Белковые факторы RF-1 и RF-2 имеют молекулярную массу по 45000 и способны распознавать в молекуле мРНК терминирующие сборку полипептидной цепи кодоны: фактор RF-1—УАГ и УАА, а фактор RF-2—ОДА и УІА. Фактор RF-З (его называют также S-протеин) стимулирует действие факторов RF-1 и RF-2.
Как только в аминоацильном центре рибосомы после очередной транслокации терминирующий кодон молекулы мРНК займет соответствующее место, к нему присоединяется один из факторов терминации RF-1 или RF-2.
1 pplpp — 3'-пирофосфо-гуанозин-5'-пирофосфат.
Этим блокируется возможность присоединения молекулы аминоацил-тРНК, тем более, что терминирующим кодонам не соответствует ни один из антикодонов в тРНК. Присоединение к мРНК фактора RF-1 или RF-2 возбуждает пептидилэстеразную активность рибосомальных белков, в частности белков L11 и L16, локализованных в 50S субчастице (см. рис. 98), вследствие чего гидролизуется сложноэфирная связь между новообразованным полипептидом и тРНК. В результате синтезированный в рибосоме белок отделяется от нее. Одновременно освобождаются тРНК и мРНК, а рибосома 70S распадается на субчастицы 30S и 50S, поступающие в общий фонд рибосом и их субчастиц, откуда они черпаются для нового цикла биосинтеза белковой молекулы (см. рис. 99). В терминации биосинтеза белка по матричной схеме принимает участие молекула ГТФ. У бактерий она служит аллостерическим регулятором активности белковых факторов терминации, а у животных распадается на ГДФ и неорганический фосфат.
Долгое время считали, что у эукариот — единственный распознающий терминирующие кодоны фактор (eRF). Он был охарактеризован (50 кДа) и секвенирован. Однако недавно описана группа родственных ему белков, названных eRF1. Эти белки выделены из человека, лягушки и дрожжей, секвенированы (428, 437 и 437 аминокислотных остатков соответственно), взаимодействуют с тремя терминирующими кодонами и ГТФ-независимы, что делает контроль терминации биосинтеза белков более надежным:
Мулыиэнзимный механизм биосинтеза пептидов. Разработка мультиэнзимного пути биосинтеза пептидов осуществлена Ф. Липманом и сотр. (1968). В настоящее время доказано, что по меньшей мере 5 антибиотиков пептидной природы: грамицидин, тироцидин, бацитрацин, циклоспорин и микобациллин — синтезируются без всякого участия нуклеиновых кислот, в том числе и тРНК, но при этом обеспечивается безошибочная сборка полипептидных цепей, характеризующихся определенной первичной структурой.
Биосинтез грамицидина S осуществляется при посредстве мультиэнзимной системы, состоящей из двух белковых фракций с молекулярными массами 280 000 и 100 000. Они выделены из белкового экстракта Bacillus brevis, из которого при посредстве гельфильтрации через сефадекс G-200 удалось получить две взаимодополняющие друг друга упомянутые выше белковые фракции. Будучи соединены вместе, в присутствии аминокислот, АТФ и Mg2+ они обеспечивают синтез in vitro циклического декапептида — грамицидина S (рис. 100).
Легкая белковая фракция (М = 100 000) рацемизирует и активирует D-фенилаланин, а тяжелая (М = 280 000) — активирует 4 остальные L-аминокислоты. Активирование аминокислот указанными ферментами осуществляется путем образования на 1-м этапе аминоациладенилатов перечисленных аминокислот (по реакции между свободными аминокислотами и АТФ с выделением пирофосфата), а на 2-м — путем переноса аминоацильных групп с аминоациладенилатов на HS-группы остатков цистеина, содержащихся в полипептидной цепи самого фермента, с образованием тиоэфиров аминокислот. В таком состоянии легкая фракция, содержащая активированный по СООН-группе D-фенилаланин, будучи соединена с тяжелой фракцией, содержащей активированные по СООН-группам L-пролин, L-валин, L-орнитин и L-лейцин, инициирует последовательный биосинтез пептидных связей между перечисленными аминокислотами в том порядке, в каком они располагаются в молекуле грамицидина S. Непосредственно перенос остатка D-фенилаланина с его тиоэфирной связи (на легкой белковой фракции) на NH2-гpyппy остатка L-пролина, соединенного тиоэфирной связью с субъединицей тяжелой белковой фракции, осуществляется аминоацилпроводящим белком (АПБ), присутствующим в мультиэнзимном комплексе. Это белок сравнительно небольшой молекулярной массы (около 20 000) с сантотеином в качестве простетической группы:
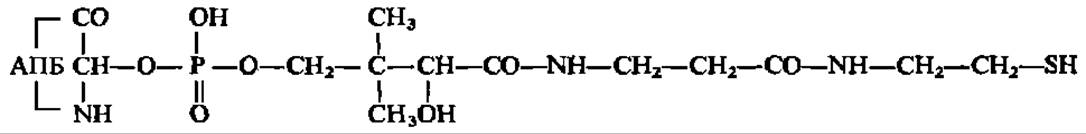
Остаток D-фенилаланина сначала переносится на HS-группу пантотеина, а затем с нее — на NН-гpyппy L-пролина. Так возникает первая пептидная связь в будущей молекуле грамицидина. Далее остаток дипептида D-фен-b- про поступает с тиоэфирной связи (с субъединицей тяжелой белковой фракции) на HS-группу пантотеина АПБ, а с нее — на NР-гpyппy остатка валина. Пептидилтрансферазная реакция повторяется до тех пор, пока не будет синтезирован пентапептид D-фен→про→вал→орн→лей (см. рис. 100). Так как одновременно на расположенном рядом идентичном мультиэнзимном комплексе синтезируется еще один такой же пентапептид, то они соединяются по типу «голова к хвосту» и образуют молекулу циклического декапептида — грамицидина S (см. рис. 100).
В соответствии с рассмотренным выше механизмом идет биосинтез другого антибиотика пептидной природы — тироцидина:
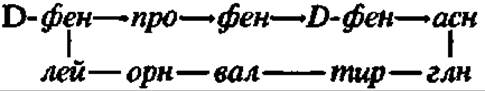
Здесь мультиэнзимная система осуществляет полную сборку циклического декапептида, т. е. последовательно синтезируется 10 пептидных связей в соответствии с первичной структурой пептида. Этот мультиэнзимный комплекс устроен сложнее, так как состоит из трех белковых фракций: 1) М = 100 000 — рацемизует (и активирует) D-фенилаланин; 2) М = 230 000 — активирует L- пролин; 3) М = 460 000 — активирует D-фенилаланин, аспарагин, глутамин, тирозин, валин, орнитин и лейцин, а также рацемизует фенилаланин.
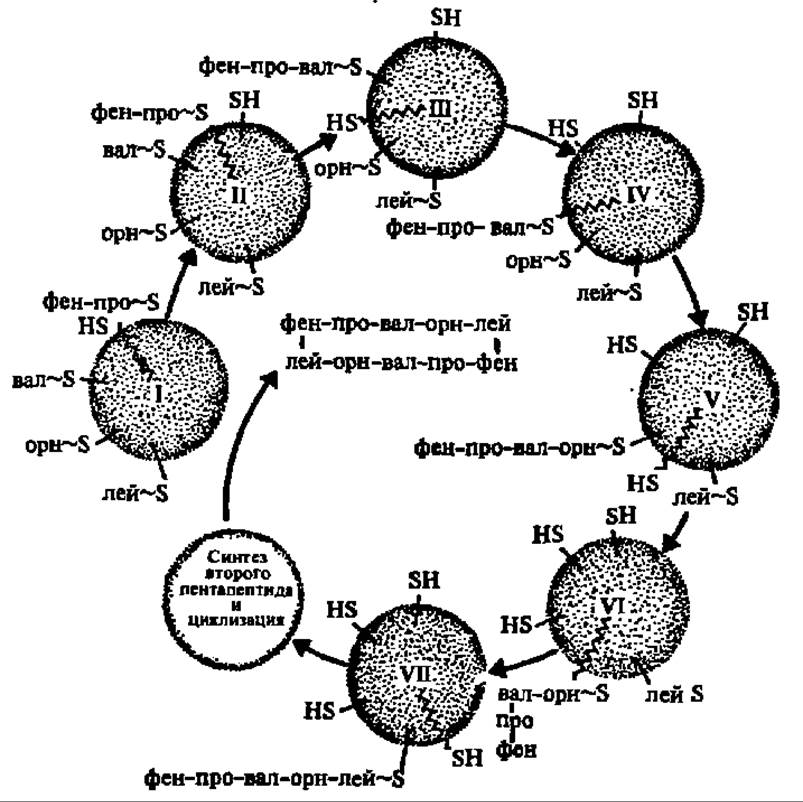
Рис. 100. Мультиэнзимный механизм биосинтеза половины молекулы грамицидина (пояснение в тексте)
Недавно доказано, что при посредстве мультиэнзимного комплекса идет биосинтез микобациллина — циклического 13-членного пептида, бацитрацина А и циклоспорина А (оба — 11-членные циклические пептиды).
Ф. Липманом предпринята попытка связать матричную и нематричную схемы биосинтеза белков в единую концепцию. Хотя в последней выяснены не все детали, несомненно, что в эволюционном аспекте мультиэнзимный путь сборки полипептидов заданного строения предшествовал рибосомальному пути их биосинтеза, и сейчас у микробов сосуществуют оба пути. Весьма показательна аналогия в деятельности мультиэнзимных систем пептидного биосинтеза и функционирования синтетазы высших жирных кислот, что указывает на широкое использование в природе принципа мультиэнзимного биосинтеза достаточно сложных соединений.
Кодирование биосинтеза белка. Выяснение вопроса о том, какой именно триплет нуклеотидов в составе мРНК кодирует вступление в белок определенной аминокислоты, представляет одну из самых увлекательных страниц современной биохимии и молекулярной биологии.
Как перевести четырехбуквенный (по числу оснований, входящих в мРНК, т. е. А-аденин, Г-гуанин, Ц-цитозин и У-урацил) код в двадцатибуквенный (по числу аминокислот, составляющих белковую молекулу)?
Если каждой комбинации нуклеотидов в мРНК приписать способность кодировать положение одной аминокислоты в белке, то дуплетный код вряд ли возможен (число пар нуклеотидов менее числа постоянно встречающихся в белке аминокислот), квадруплетный нереален (число сочетаний слишком сильно превышает число аминокислот), в то время как триплетный код наиболее удовлетворяет численному соотношению возможных кодонов и белковых аминокислот. Указанные расчеты основаны на том, что при соединении 4 нуклеотидов попарно можно получить 16 комбинаций, по три — 64, по четыре — 256 комбинаций и т. д.:
Дуплетный код |
Триплетный код |
Квадруплетный код |
|||
(42 = 16) |
(43 = 64) |
(44 = 256) |
|||
АА УУ ГГ ЦЦ |
ААА |
УУУ |
ГГГ |
ЦЦЦ |
АААА УУУУ ПТГ ЦЦЦЦ |
АУ УА ГА ЦА |
ААУ |
УУА |
ГГА |
ЦЦА |
АААУ УУУ А ГГГА ЦЦЦА |
АГ УГ ГУ ЦУ |
УАА |
АУУ |
АГГ |
АЦЦ |
и т.д. |
АЦ УЦГЦ ЦГ |
АУА |
УАУ |
ГАГ |
ЦАЦ |
|
ААГ |
УУГ |
ГГУ |
ЦЦУ |
||
ГАА |
ГУУ |
УГГ |
УЦЦ |
||
АГА |
УГУ |
ГУГ |
ЦУЦ |
||
ААЦ |
УУЦ |
ГГЦ |
ЦЦГ |
||
ЦАА |
ЦУУ |
ЦГТ |
ГЦЦ |
||
АДА |
УЦУ |
ГЦГ |
ЦГЦ |
||
АУГ |
УАГ |
ГАУ |
ЦАУ |
||
АГУ |
УГА |
ГУА |
ЦУА |
||
АГЦ |
УАЦ |
ГАЦ |
ЦАГ |
||
АЦГ |
УЦА |
ГЦА |
ЦГА |
||
АУЦ |
УГЦ |
ГУЦ |
ЦУГ |
||
АЦУ |
УЦГ |
ГЦУ |
ЦГУ |
||
Посредством ряда остроумных опытов триплетная природа кода белкового синтеза доказана экспериментально. Сначала был установлен качественный состав нуклеотидных остатков, которые входят в состав одного или нескольких кодонов, обеспечивающих вступление в состав белка той или иной аминокислоты. Решающую роль здесь сыграло наблюдение М. Ниренберга (1961), который, используя в качестве мРНК полиуридиловую кислоту, впервые показал, что вступление в полипептидную цепь фенилаланина кодируется УУУ-триплетом. Полиуридиловая кислота, поли (У), вводилась им в белок-синтезирующую бесклеточную систему, составленную из промытых (лишенных мРНК) рибосом, полного набора тРНК, аминоацил-тРНК-синтетаз и аминокислот (некоторые из последних мечены 14С или 15N), АТФ и генерирующих ее соединений (фосфоенолпируват, ацетилфосфат и подобные им вещества), ГТФ, Mg2+ и Мn2+. В этой системе на поли (У) в качестве матрицы шел синтез пептидов, составленных только из остатков фенилаланина. Благодаря применению в этой же системе почти полного набора синтетических гомо- и гетерополирибонуклеотидных матриц, полученных с помощью полинукле- отидфосфорилазы, в лаборатории С. Очоа в течение года была завершена работа по выявлению качественного состава кодонов для всех аминокислот.
Самую большую трудность представляло выяснение последовательности нуклеотидов в кодонах, определяющих положение аминокислоты в белковой молекуле: ведь при известном качественном составе кодона оставалось неясным, какое же чередование нуклеотидных остатков в нем (например, АЦУ, ЦАУ, УАЦ, АУЦ, ЦУA или УЦА) действительно кодирует данную аминокислоту при биосинтезе белка в рибосоме. Но и эта трудность была преодолена после того, как было обнаружено, что синтетические тринуклеотиды, подобно мРНК, могут специфически связывать аминоацил-тРНК с рибосомами, а в лаборатории Г. Корана были синтезированы полирибонуклеотиды заданного строения (с известной последовательностью нуклеотидных остатков) и применены для экспериментального выявления в бесклеточных белоксинтезирующих системах первичной структуры кодонов для каждой аминокислоты.
В результате уже к концу 1965 г. были получены полные данные о коде белкового синтеза в рибосомальном аппарате клетки (табл. 23). Как видно из таблицы, из 64 триплетов 61 кодирует последовательность вхождения аминокислот в полипептидную цепь в процессе ее биосинтеза в рибосоме. Три триплета (УAА, УAГ и УГА) не участвуют в кодировании. Однако и они играют важную роль в биосинтезе белка. Именно эти триплеты распознаются белковыми факторами терминации в тот момент, когда они окажутся (по мере продвижения мРНК через рибосому) в ее аминоацильном центре. А это, как известно, приводит к завершению синтеза белковой молекулы.
Таблица 23 Код белкового синтеза
Первая буква |
Вторая буква кодона |
Третья буква |
Первая буква |
Вторая буква кодона |
Третья буква |
||||||
кодова |
У |
Ц |
А |
Г |
кодона |
кодона |
У |
Ц |
А |
Г |
кодона |
фен |
сер. |
тир |
цис |
У |
иле |
тре |
асн |
сер |
У |
||
фен |
сер |
тир |
цис |
Ц |
иле |
тре |
асн |
сер |
Ц |
||
У |
лей |
сер |
А |
А |
иле |
тре |
лиз |
арг |
А |
||
лей |
сер |
три |
Г |
мет |
тре |
лиз |
арг |
Г |
|||
лей |
про |
гис |
арг |
У |
вал |
ала |
асп |
гли |
У |
||
лей |
про |
гис |
арг |
Ц |
вал |
ала |
асп |
гли |
Ц |
||
ц |
лей |
про |
глн |
арг |
А |
Г |
вал |
ала |
глу |
гли |
А |
лей |
про |
глн |
арг |
Г |
вал |
ала |
глу |
гли |
Г |
||
Детальное изучение свойств кода белкового синтеза показало, что он является триплетным, непрерывным, неперекрывающимся, вырожденным и универсальным.
Триплетность кода доказана в результате проведения ряда целенаправленных экспериментов. Среди них — сопоставление числа мутаций в геноме фага Т4 с появлением мутантов и их возвратом к исходному типу при обработке бактериофага химическим мутагеном — акридиновым оранжевым (Ф. Крик); выяснение минимальной длины фрагмента олигоуридиловой кислоты, способного связать фенилаланил-тРНК (М. Ниренберг); синтез олигорибонуклеотидов заданного строения и изучение их кодирующих свойств при использовании в качестве мРНК в белоксинтезирующей бесклеточной системе (Г. Корана); анализ распределения аминокислотных замен в гомологичных белках (Г. Виттман).
Казалось бы, не осталось уже сомнений в том, что взаимодействие триплетов нуклеотидов (кодонов) в мРНК с триплетами нуклеотидов (антикодонами) в тРНК однозначно определяет связывание соответствующей аминоацил-тРНК с рибосомой. Однако в последнее время накопились факты, доказывающие, что существенное значение для кодирования имеют лишь два из трех нуклеотидных остатков в кодоне (У. Лагерквист, 1978). Так, в табл. 23, где сведены данные о коде белкового синтеза, легко заметить, что существуют семейства кодонов, отличающиеся только третьей буквой — именно она распознается в ряде случаев неоднозначно. Сначала для объяснения этого явления использовали представление о неполном соответствии правилу комплементарности сочетания азотистых оснований в кодоне и антикодоне (wobble- гипотеза, т. е. гипотеза, допускающая «болтанку», неточную подгонку оснований). Сейчас все более придерживаются гипотезы два из трех. Таким образом, код белкового синтеза, по существу, является квазидуплетным (условно, мнимодупдетным).
Непрерывность кода белкового синтеза состоит в том, что все входящие в его состав кодоны располагаются в мРНК, кодирующей биосинтез определенного белка, в строгом порядке один возле другого, не будучи разделенными иными моно- или олигонуклеотидными вставками.
Неперекрывающийся характер кода белкового синтеза заключается в том, что ни один из нуклеотидов одного кодона не является составной частью другого (соседнего) кодона.
Вырожденность кода сводится к его множественности для тех или иных аминокислот. Из табл. 23 видно, что вступление в полипептидную цепь как лейцина, так и аргинина обеспечивается шестью различными кодонами; подавляющего большинства других аминокислот — четырьмя или двумя кодонами и лишь в одиночных случаях (метионин и триптофан) — одним кодоном. Естественно, что вследствие вырожденности кода существуют соответствующие наборы тРНК, взаимодействующих с комплектом кодонов для данной аминокислоты.
Наконец, универсальность кода белкового синтеза определяется тем, что он един для всего живого на земле: от простейшего фага или бактерии що венца творения — человека и неизменен уже более 3 млрд. лет. Однако код белкового синтеза в митохондриях существенно отличается от такового прокариот и эукариот и его происхождение остается загадкой. К тому же у реснитчатых и микоплазм он тоже отличается от канонического: терминирующие кодоны у них выполняют кодирующую функцию.
К перечисленным пяти свойствам кода следует добавить еще помехоустойчивость, наличие в нем знаков пунктуации (инициирующие и терминирующие триплеты), серийносвязанность (см. серии кодонов в табл. 23), симметричность (поворот на 180° не нарушает расположения сильных и слабых оснований), сцепленность состава и расположения оснований в кодоне с полярностью и размерами аминокислот и, наконец, однозначность (каждый кодон соответствует единственной аминокислоте).
Всегда ли кодирование осуществляется с абсолютной точностью или возможно ложное кодирование и включение аминокислоты в полипептидную цепь не в соответствии со структурой кодона? Считают, что определенный уровень ложного кодирования запрограммирован эволюционно; и в тех случаях, когда вследствие мутации изменен один из кодонов в мРНК, он может транслироваться как неизменённый («ложь во спасение»). Это помогает клеткам, в том числе и бактериальным, выжить при неблагоприятных мутациях. Наличие ложного кодирования показано и в нефизиологических условиях, в опытах по синтезу пептидов в бесклеточных белоксинтезирующих системах. Так, на поли (У) наряду с массированным включением в полипептидную цепь фенилаланина отмечено наличие в возникающих на этой матрице пептидах лейцина и изолейцина, а также в уменьшающихся количествах серина, тирозина и валина. Ясно, что эти аминокислоты вступают в пептидную фракцию вследствие ложного кодирования, причиной которого является квазидуплетность (два из трех) кода белкового синтеза и возможность неполного соответствия кодона и антикодона в процессе трансляции (wobble-гипотеза!). Ложное кодирование усиливается при увеличении концентрации в среде Mg2+, путресцина, спермидина, этанола, а также при понижении pH и температуры инкубации. В физиологических условиях его уровень составляет 10-4—10-3 ошибок на кодон и в определенной мере увеличивает жизненную гибкость и потенции клетки (синтез вариантов белков и т. п.). Вопросы ложного кодирования в процессе белкового синтеза успешно изучаются в Институте белка в Пущино под руководством акад. А. С. Спирина.
Проблема кодирования биосинтеза белков в последние годы обсуждается еще в одном принципиальном аспекте. Исходя из работ, в которых удалось доказать способность некоторых белков без участия нуклеиновых кислот обеспечивать собственное мультиплицирование, накопление и реализацию присущего им патологического (инфекционного) процесса, В. А. Кордюмом выдвинута концепция о существовании новой формы биологической информации — пространственной структуры белка, способной к самовоспроизведению.