Основы биохимии - Филиппович Ю. Б. 1999
Биологическое окисление
Свободное окисление
Реакции свободного окисления органических соединений в живой природе, равно как и ферментные системы, ускоряющие их, многообразны, и многие из них рассмотрены в предыдущих главах и в начальном разделе этой главы. Этим путем непосредственно окисляются не только многочисленные природные и неприродные субстраты, но и восстановленные коферменты (НАДН, НАДФН, ФАД ∙ Н2 и др.), образовавшиеся при действии первичных и вторичных дегидрогеназ.
Хотя реакции свободного окисления идут и в цитозоле, и на мембранах различных субклеточных структур, средоточием их являются мембраны эндоплазматической сети клетки. Так как последние при гомогенизации клеток и фракционировании субклеточных частиц гомогената дают фракцию микросом, которая может быть получена в виде препарата, то сейчас активно изучаются организация и функции микросомальной дыхательной цепи. Ее первая особенность сводится к тому, что, несмотря на наличие ферментов цепи переноса электронов, ни в одном пункте этой цепи не происходит сопряжения с фосфорилированием АДФ. Вторая особенность заключается в своеобразии структуры и функциональной активности цитохромов b5 и Р-450), входящих в ее состав. В частности, цитохром Р-450 (М ≈ 50 000, гемопротеин, первичная структура более десятка его форм расшифрована) обладает множеством (сотни, а может быть, и тысячи) форм, возникающих в ответ на введение (или попадание) в организм того или иного класса ксенобиотиков, подобно тому, как антитела синтезируются в ответ на присутствие антигенов; поэтому цитохром Р-450 считают своего рода «мембранным иммуноглобулином».
Наконец, третья особенность состоит в высоком сродстве терминальной оксидазы микросомальных цепей к кислороду, позволяющая ей конкурировать за кислород с митохондриальной цитохромоксидазой. Поэтому, например, в клетках печени доля микросомального окисления эндогенных субстратов составляет 40%, а митохондриального — 60%.
Наиболее своеобразными и почти не затронутыми в предыдущих главах являются реакции свободного окисления, идущие при участии оксигеназ. Этот подкласс оксидоредуктаз содержит ферменты, ускоряющие включение в окисляемый субстрат либо двух (диоксигеназы), либо одного (монооксигеназы) атома молекулярного кислорода.
Свободное окисление при участии диоксигеназ. Одной из наиболее изученных диоксигеназ является пирокатехаза (катехол: кислород-1,2-оксидоредуктаза дециклизующая); ее М = 85000. Концентрированные растворы пирокатехазы красного цвета, так как она содержит в активном центре два прочно связанных атома Fe, которые, согласно О. Хайанши, соединяются с молекулярным кислородом в комплекс, где кислород далее активируется: Fe2+ + O2 → Fe2+O2 → Fe3 + O2.
Затем в активном центре пирокатехазы после присоединения субстрата возникает тройной комплекс, преобразование которого приводит к включению молекулярного кислорода в пирокатехин:
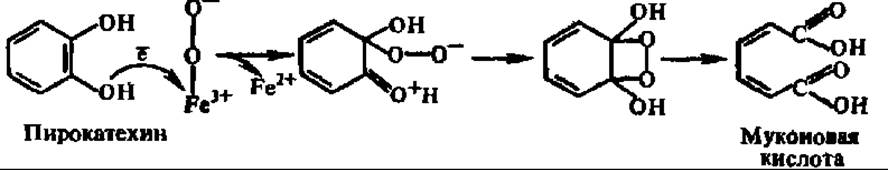
Аналогично действует катехол-2,3-оксигеназа (М = 140 000, 1 атом Fe), 3,4-диоксигеназа протокатеховой кислоты (М = 700 000, 8 x 90000), образующая ß-карбоксимуконовую кислоту, триптофаноксигеназа (М = 123 000), присоединяющая молекулярный кислород по пиррольному кольцу индопильного радикала, и другие диоксигеназы. Во всех случаях молекулярный кислород активируется за счет присоединения электрона, теряемого двухвалентным железом активного центра, а возникший анионный свободный радикал кислорода (О2-2) атакует и оксигенирует субстрат. В результате расшифровки механизма действия диоксигеназ стал ясен один из способов активирования молекулярного кислорода терминальными оксидазами.
Одной из биологически важных диоксигеназных реакций является превращение ß-каротина в витамин А:
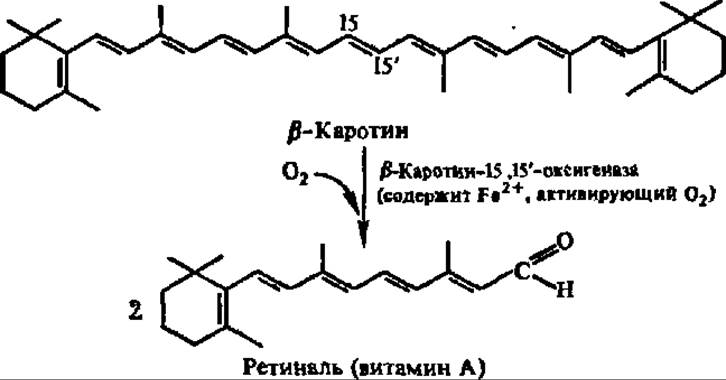
Прямое присоединение 18О2 по 15,15'-связи в ß-каротине впервые доказано Б. Б. Вартапетяном и сотр. (1966).
Свободное окисление при участии монооксигеназ. Ввиду высокой лабильности монооксигеназ, как, впрочем, и диоксигеназ, выделение их сопряжено с большими трудностями. Тем не менее некоторые из них получены в кристаллическом состоянии. Монооксигеназы характеризуются молекулярными массами от 65000 до 200000, отсутствием, как правило, в их составе ионов тяжелых металлов и наличием коферментов флавиновой природы. Кроме того, многие из них требуют участия в реакции монооксигенирования так называемого парного донора, от которого поступают атомы водорода на один из атомов молекулярного кислорода (второй внедряется в окисляемый субстрат).
Простейший представитель монооксигеназ — фенолгидроксилаза (фенол-2-монооксигеназа):
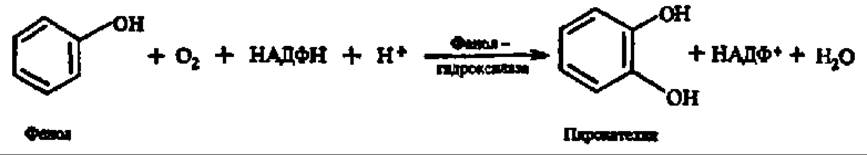
Монооксигеназы принимают большое участие в окислении аминокислот (лизин-, аргинин- и триптофанмонооксигеназы, фенилаланин- и тирозингидроксилаза), оксикислот (салицилатгидроксилаза), полиизопреноидных соединений (сквален-эпоксидаза, см. с. 404).
Механизм действия монооксигеназ выяснен недостаточно. Предполагают, что активной формой кислорода может быть связанный с ферментом пероксид водорода или его эквивалент. Между тем показано, что некоторые из монооксигеназ (фенолаза из грибов, фeниланин-4-гидроксилаза) содержат Сu+ в своем составе. В этих случаях возможен такой механизм активирования кислорода:
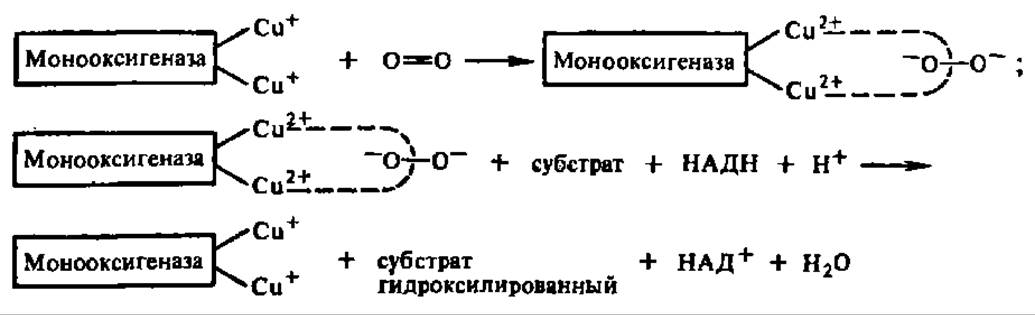
Здесь, как и в случае диоксигеназ, решающую роль в активировании молекулярного кислорода играет передача на него электронов с металла, входящего в состав фермента. Не исключено, что этот способ вовлечения молекулярного кислорода в процессы оксидоредукции в клетке является общим для оксидаз, участвующих как в свободном, так и в сопряженном с фосфорилированием биологическом окислении.