Основы биохимии - Филиппович Ю. Б. 1999
Биологическое окисление
Окисление, сопряженное с фосфорилированием АДФ
Субстратное фосфорилирование. Примерами сопряжения окисления с фосфорилированием на уровне субстрата могут служить реакции окисления 3-фосфоглицеринового альдегида в 1,3-дифосфоглицериновую кислоту, 2-фосфоглицериновой кислоты — в 2-фосфоенолпировиноградную, а-кетоглутаровой кислоты — в янтарную кислоту (здесь фосфорилируется ГДФ — см. рис. 117). С возникающих при этом соединений фосфат, связанный макроэргической связью, легко передается на АДФ (или ГДФ). Один из примеров такого сопряжения и механизм переноса активированного фосфата на АДФ детально рассмотрены выше (см. рис. 114). Однако посредством реакций субстратного фосфорилирования образуется сравнительно небольшое количество АТФ (рис. 128).
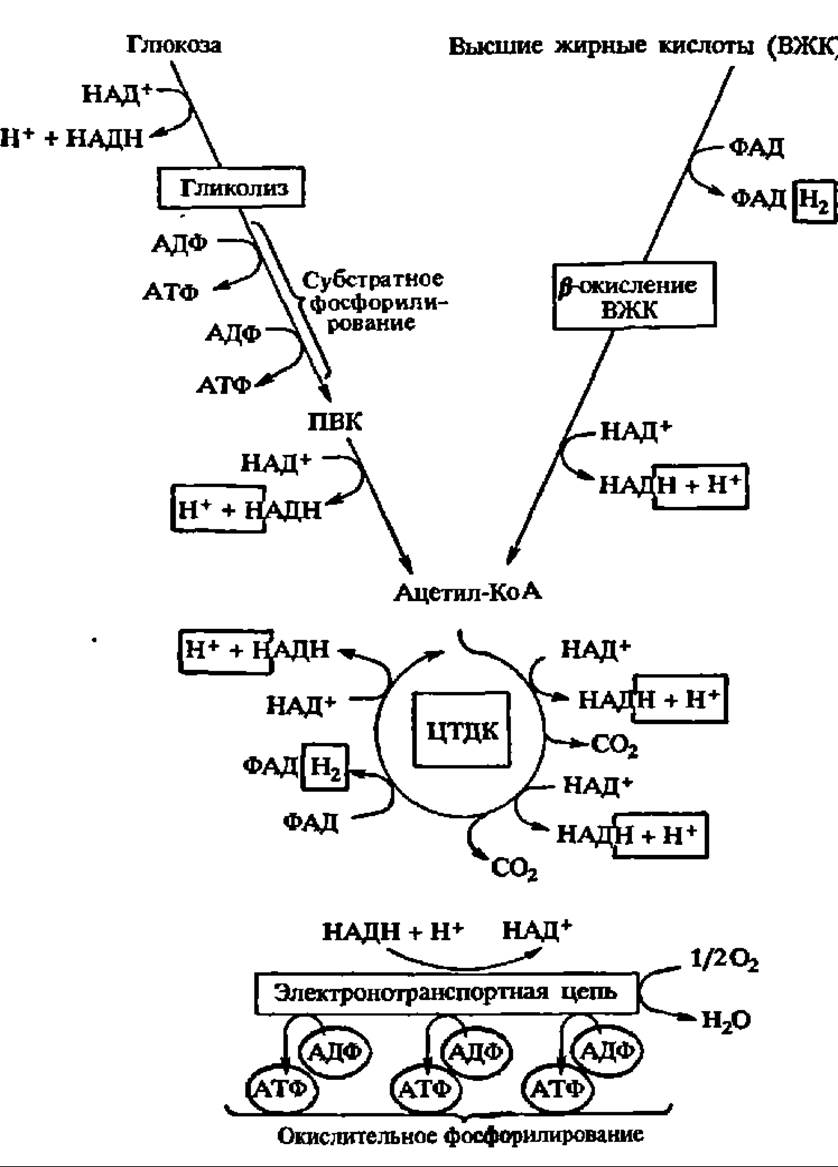
Рис. 128. Локализация синтеза АТФ при субстратном и окислительном фосфорилировании (пояснения в тексте)
Окислительное фосфорилирование. Главная масса АТФ у аэробных организмов синтезируется путем окислительного фосфорилирования в митохондриях — этих поистине энергетических фабриках клетки.
Атомы водорода, снятые с субстратов в цикле дикарбоновых и трикарбоновых кислот, при ß-окислении высших жирных кислот, при пируватдегидрогеназной, глутаматдегидрогеназной и некоторых других реакциях поступают в дыхательную цепь ферментов внутренней мембраны митохондрий. Универсальным донором атомов водорода для дыхательной цепи ферментов служит НАДН.
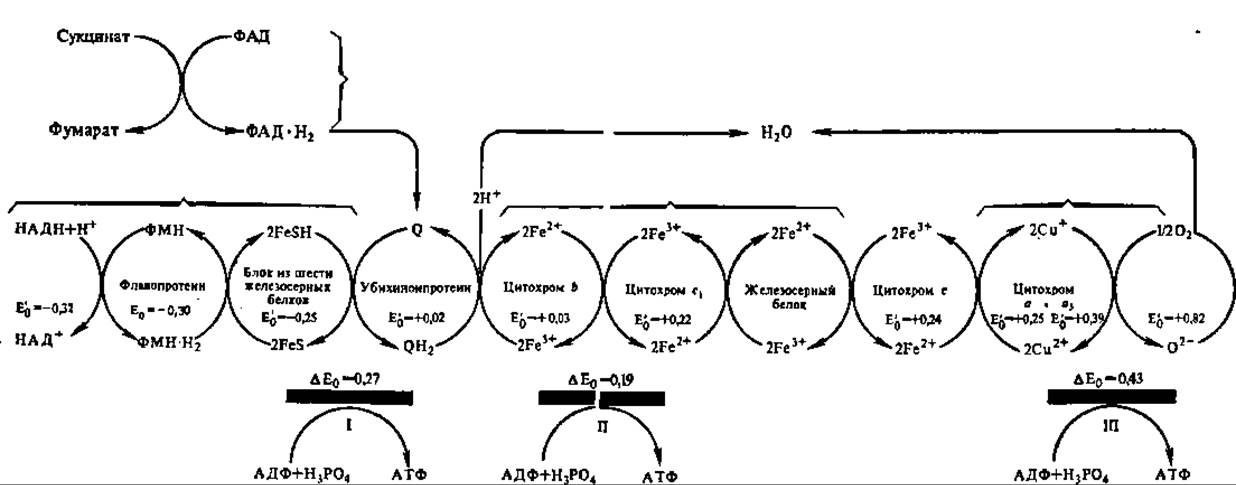
Рис. 129. Компоненты дыхательной цепи митохондрий:
E'0 — окислительно-восстановительные потенциалы компонентов дыхательной цепи; ∆Е0 — разность потенциалов между компонентами дыхательной цепи в точках сопряжения с фосфорилированием АДФ (подчеркнуты толстой черной линией); I, II, III — точки сопряжения. Дыхательная цепь митохондрий более сложна, чем это показано на рисунке. При определенных условиях из нее можно выделить 4 комплекса, каждый из которых характеризуется своей молекулярной массой, полипептидным составом и значениями окислительно-восстановительных потенциалов (Е'0). Комплекс I: М = 700—900 кДа, 2S полипептидов; комплекс II: М = 140 кДа, 4—5 полипептидов; комплекс III: М = 250 кДа, 9—10 полипептидов; комплекс IV: М = 160—170 кДа, S полипептидов. Дыхательная цепь примыкает к АТФ-синтазному комплексу (комплекс V: М = 500 кДа, 12—14 полипептидов), показанному на рис. 130 и 131. Таким образом, с трансформацией энергии в митохондриях связано около 70 различных полипептидов в 6 типов фосфолипидов сопрягающей мембраны (см. рис. «Блочная структура митохондриальной цепи» на форзаце в начале учебника)
![]()
Следовательно, и в этом случае атомы Н перед поступлением в дыхательную цепь передаются на НАД+ (рис. 128).
Другим первичным источником атомов водорода и электронов в дыхательной цепи сложит восстановленный флавопротеин, если он выполняет роль первичной дегидрогеназы, как, например, в случае окисления янтарной кислоты в цикле трикарбоновых и дикарбоновых кислот (см. рис. 117). Флавопротеин, но несколько иной природы, служит передаточной инстанцией для атомов водорода и электронов от НАДН к убихинонпротеину дыхательной цепи.
На рис. 129 представлена дыхательная цепь ферментов митохондриальной мембраны. Естественно, что она открывается НАДН, с которого атомы Н передаются на первый белковый компонент дыхательной цепи — флавопротеин, несущий флавинмононуклеотид (ФМН) в качестве кофермента. Остальные компоненты дыхательной цепи располагаются в порядке возрастания их нормальных (измерены при 1 М концентрации и температуре 25° С, что обозначают индексом Е0 и pH 7,0 и маркируют значком ') окислительновосстановительных потенциалов (E'0), обеспечивающих упорядоченную передачу атомов водорода и электронов по такой редоксцепи.
Самой примечательной особенностью дыхательной цепи ферментов является наличие в ней участков, где соседние компоненты резко отличаются значениями окислительно-восстановительных потенциалов (∆E0):
Нормальные окислительно-восстановительные потенциалы соединений, участвующих в биологическом окислении
Окисленная форма |
Число передаваемых электронов |
Восстановленная форма |
E'0, в |
Ацетат + СO2 |
2 |
Пируват |
-0,70 |
Сукцинат + СO2 |
2 |
а-Кетоглутарат |
-0,67 |
Ацетат |
2 |
Ацетальдегид |
-0,60 |
O2 |
1 |
O-2 |
-0,45 |
Ферредоксин (окисл.) |
1 |
Ферредоксин (восст.) |
-0,43 |
2Н+ |
2 |
Н2 |
-0,42 |
Ацетоацетат |
2 |
ß-Гидроксибутират |
-0,35 |
НАД+ |
2 |
НАДН + Н+ |
-0,32 |
НАДФ+ |
2 |
НАДФН + Н+ |
-0,32 |
ФМН-протеин |
2 |
ФМН ∙ Н2-протеин |
-0,30 |
Липоат (окисл.) |
2 |
Липоат (восст.) |
-0,29 |
1,3-Дифосфоглицерат |
2 |
Глицеральдегид-3-Р + Рн |
-0,29 |
Глутатион (окисл.) |
2 |
Глутатион (восст.) |
-0,23 |
ФАД |
2 |
ФАД ∙ Н2 |
-0,22 |
Ацетальдегид |
2 |
Этанол |
-0,20 |
Пируват |
2 |
Лактат |
-0,19 |
Оксалоацетат |
2 |
Малат |
-0,17 |
а-Кетоглутарат + NH+4 |
2 |
Глутамат |
-0,14 |
Метиленблау (окисл.) |
2 |
Метиленблау (восст.) |
0,01 |
Фумарат |
2 |
Сукцинат |
0,03 |
Коэнзим Q |
2 |
KoQ ∙ Н2 |
0,04 |
Цитохром b (Fe3+) |
1 |
Цитохром b (Fe2+) |
0,07 |
Дегидроаскорбат |
2 |
Аскорбат |
0,08 |
Цитохром c1 (Fe3+) |
1 |
Цитохром c1 (Fe2+) |
0,23 |
Цитохром c (Fe3+) |
1 |
Цитохром c (Fe2+) |
0,25 |
Цитохром a (Fe3+) |
1 |
Цитохром a (Fe2+) |
0,29 |
1/2 O2 + Н2O |
2 |
H2O2 |
0,30 |
Феррицианид |
2 |
Ферроцианид |
0,36 |
Нитрат |
1 |
Нитрит |
0,42 |
Цитохром а3(Fe3+) |
1 |
Цитохром а3(Fe2+) |
0,55 |
Fe3+ |
1 |
Fe2+ |
0,77 |
1/2 O2 + 2Н+ |
2 |
H2O |
0,82 |
Именно здесь происходит сопряжение окисления с фосфорилированием АДФ (рис. 129), так как разность энергетических уровней электрона, транспортируемого с огромной скоростью (около 1 мс от одного переносчика к другому), вполне достаточна для синтеза макроэргической связи и составляет 51 кДж для I, 36 — для II и 80,7 кДж для III точки сопряжения. В целом интенсивность окислительного фосфорилирования определяется энергетическим зарядом, т. е, соотношением моно-, ди- и трифосфатов аденозина:
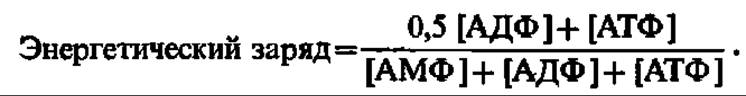
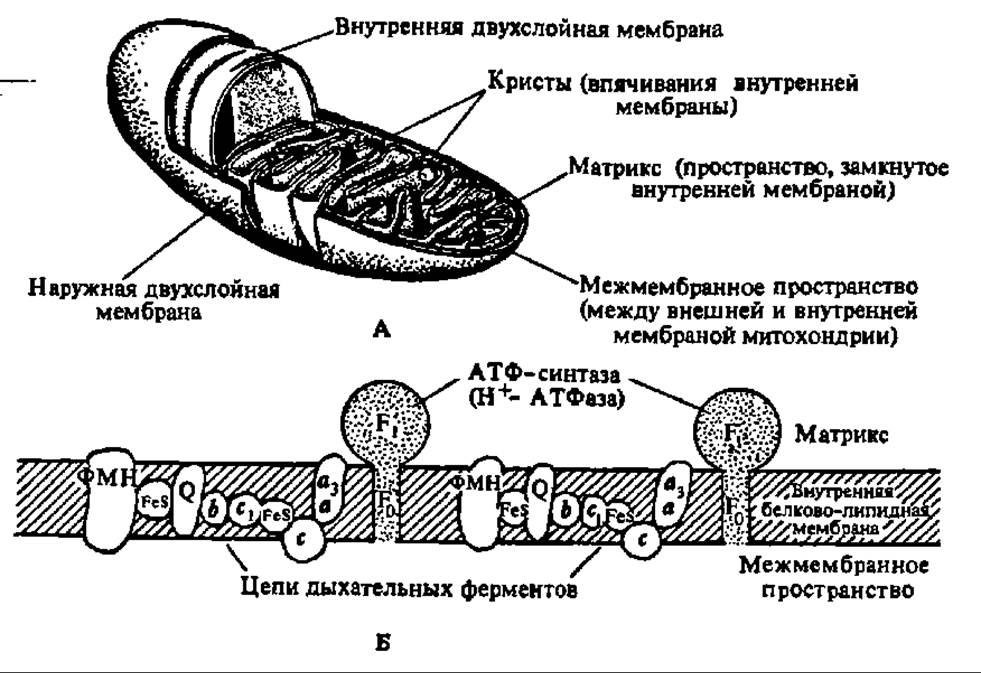
Рис. 130. Структура митохондрии (A) и схема расположения ферментов дыхательной цепи и АТФ-синтазного комплекса в ее внутренней мембране (Б):
ФМН — флавопротеин с флавинмононуклеотидом я качестве коферменте; FeS — железосерные белая; Q — убихинонпротеин; b, c1 и с — цитохромы; а — цитохромоксидаза
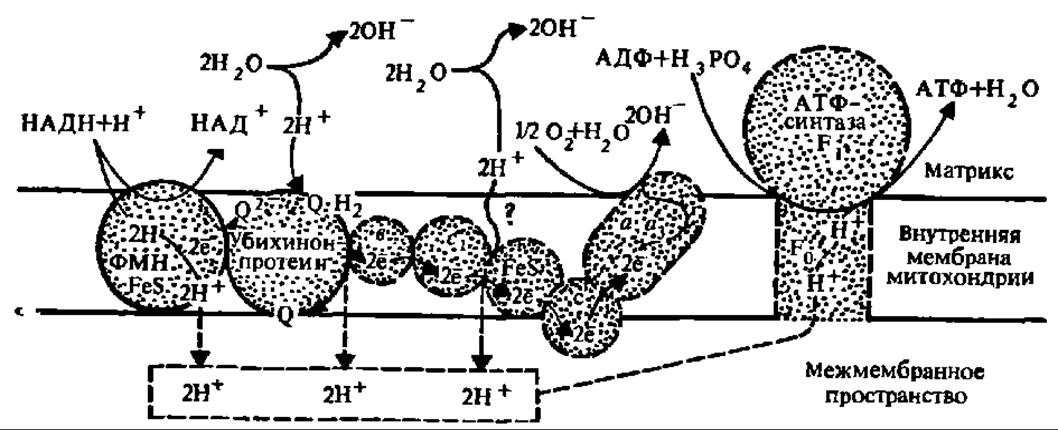
Рис. 131. Трансмембранный перенос электронов и протонов и сопряжение его с синтезом АТФ (обозначения те же, что на рис. 129)
Мембраны, несущие ферменты переноса электронов и сопряженного с ним фосфорилирования, называются сопрягающими. К ним относятся: внутренняя мембрана митохондрий, мембрана тилакоидов хлоропластов зеленых растений, мембрана хроматофоров фотосинтезирующих бактерий и клеточные мембраны аэробных бактерий, обладающих дыхательным типом энергетики. Они характеризуются толщиной в 7,0—9,0 нм, преобладанием белков над липидами (2:1), низким содержанием холестерола и наличием кардиолипина; примерно третья часть входящих в их состав белков принадлежит ферментам дыхательной цепи, собранным в ансамбли (рис. 129), — в каждой митохондрии клеток печени крысы, например, их содержится несколько тысяч.
Наиболее полно изучены структура и функция сопрягающей мембраны митохондрий. Наряду с дыхательным ансамблем ферментов в ней находится АТФ-синтазный комплекс, ответственный за образование АТФ. Каким же образом расположены они в митохондрии? Ответ на этот вопрос дает рис. 130. И тот и другой ферментные комплексы локализованы во внутренней мембране митохондрий (рис. 130, Б), причем АТФ-синтазный комплекс представлен так называемыми грибовидными выростами, которые усеивают внутреннюю мембрану и обращены в сторону матрикса митохондриальных частиц.
Проблема сопряжения окисления с фосфорилированием необыкновенно сложна и далека еще от окончательного разрешения. Ранние гипотезы по этому вопросу: гипотеза химических переносчиков (Е. Слейтер, 1953) и конформационная гипотеза (П. Бойер, 1964) представляют в настоящее время лишь исторический интерес, хотя отдельные элементы той и другой в некоторой мере присутствуют в общепризнанной сейчас хемиосмотической гипотезе П. Митчела, поддержанной и развитой в нашей стране благодаря трудам В. П. Скулачева и сотр.
Согласно хемиосмотической гипотезе, именно структурные и функциональные особенности сопрягающей мембраны (этот термин введен в биоэнергетику В. П. Скулачевым) обеспечивает биосинтез АТФ. В процессе функционирования дыхательной цепи ферментов в сопрягающей мембране митохондрий, не проницаемой ни для НАДН, ни для протонов, происходит активный перенос шести Н+ из матрикса в межмембранное пространство (рис. 131) на каждую пару электронов, проходящих по электронотранспортной цепи. По поводу механизма этого переноса высказаны разные мнения. Сущность некоторых из них ясна из рассмотрения рис. 131. Предполагают также, что перенос протонов идет при участии протонных транслоказ — специфических белков, локализованных в сопрягающей мембране и обеспечивающих перенос протонов сопряженно с транспортом электронов при помощи белкового комплекса, как, например, в случае цитохромоксидазы (рис. 132) или НАДН: ß-оксидоредуктазы.
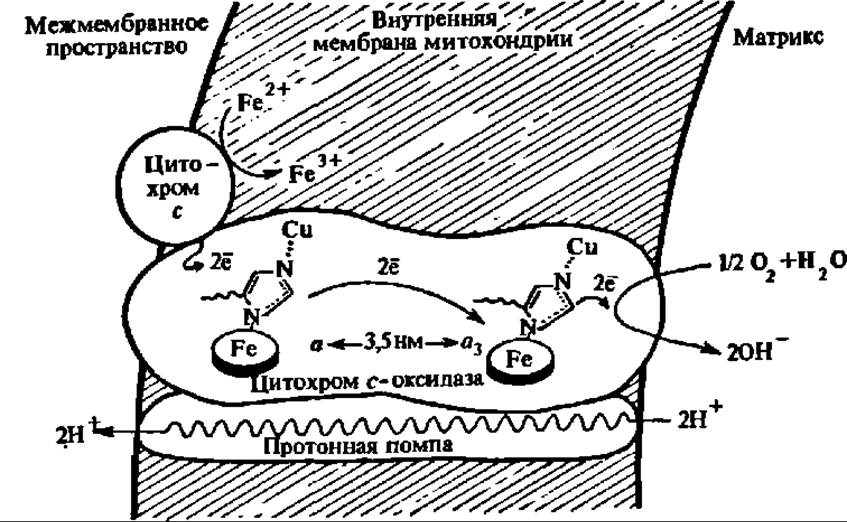
Рис. 132. Протонная помпа, сопряженная с цитохром с-оксидазой митохондриальной мембраны
При М = 140000 цитохром с-оксидаза состоит из 7 субъединиц, содержащих 2 атома Cu и 2 атома Fe (в составе гема, показан овальным кружком), соединенных координационными связями с атомами азота радикалов гис. Так как атомы Сu я Fe цитохрома а ∙ а3 находятся на расстоянии 3,5 нм, то возможен только тоннельный перенос электронов между ними. Цитохромоксидаза, изменяя конформацию при переносе электронов, либо сама выполняет функцию протонной помпы, либо для этого служит тесно прилегающий к ней белок. Как видно из рисунка, механизм активирования молекулярного кислорода цитохромоксидазой вполне аналогичен таковому у диоксигеназ и некоторых монооксигеназ, т. е. осуществляется за счет передачи на кислород электронов с Fe2+ и Cu+.
В результате создается трансмембранная разность потенциалов, так как с внешней стороны внутренней мембраны митохондрий, в межмембранном пространстве, накапливаются Н+, а на внутренней ее стороне, в матриксе, — ОН- (см. рис. 131). Возникает градиент электрохимического потенциала Н+ (его обозначают как ∆μН+). Он складывается из градиента электрического потенциала — ∆ψ и градиента концентрации водородных ионов — ∆рН и является движущей силой синтеза АТФ.
Естественно, что ионы Н, накопившиеся в межмембранном пространстве митохондрии, перенесенные туда за счет потерянной электронами энергии в процессе их транспорта по дыхательной цепи ферментов и перехода с более высокого энергетического уровня в окисляемом субстрате на более низкий энергетический уровень в активированной молекуле кислорода (см. рис. 129), стремятся вернуться в митохондриальный матрикс. Энергезированная, электрически заряженная внутренняя мембрана митохондрий способна деэнергезироваться, разрядиться. Этот процесс осуществляется при помощи протонной АТФазы.
Протонная АТФаза (Н+-АТФаза) — липопротеиновый комплекс, гидролизующий АТФ сопряженно с трансмембранным переносом водородных ионов против их электрохимического градиента (∆μН+). Энергия для такого переноса Н+ против градиента их концентрации черпается за счет энергии распадающейся макроэргической связи в молекуле АТФ при ее гидролизе. В условиях нарушения целостности комплекса F0F1 (рис. 132) митохондрий, Н+-АТФаза ускоряет именно этот процесс, обеспечивая обратный транспорт Н+ и создание ∆μН+- Но в составе энергезированной митохондриальной мембраны, при нормальном состоянии комплекса F0 ∙ F1 функция протонной АТФазы сводится не к переносу ионов водорода из матрикса в межмембранное пространство, а, наоборот, к транспорту протонов внутрь митохондрии, к снятию электрохимического градиента Н+ и, само собой разумеется, к синтезу (сопряженно с переносом Н+ с внешней стороны сопрягающей мембраны на ее внутреннюю сторону) АТФ. Поэтому ее называют также АТФ-синтазоЙ, что подчеркивает ее истинную функцию в митохондриальной мембране.
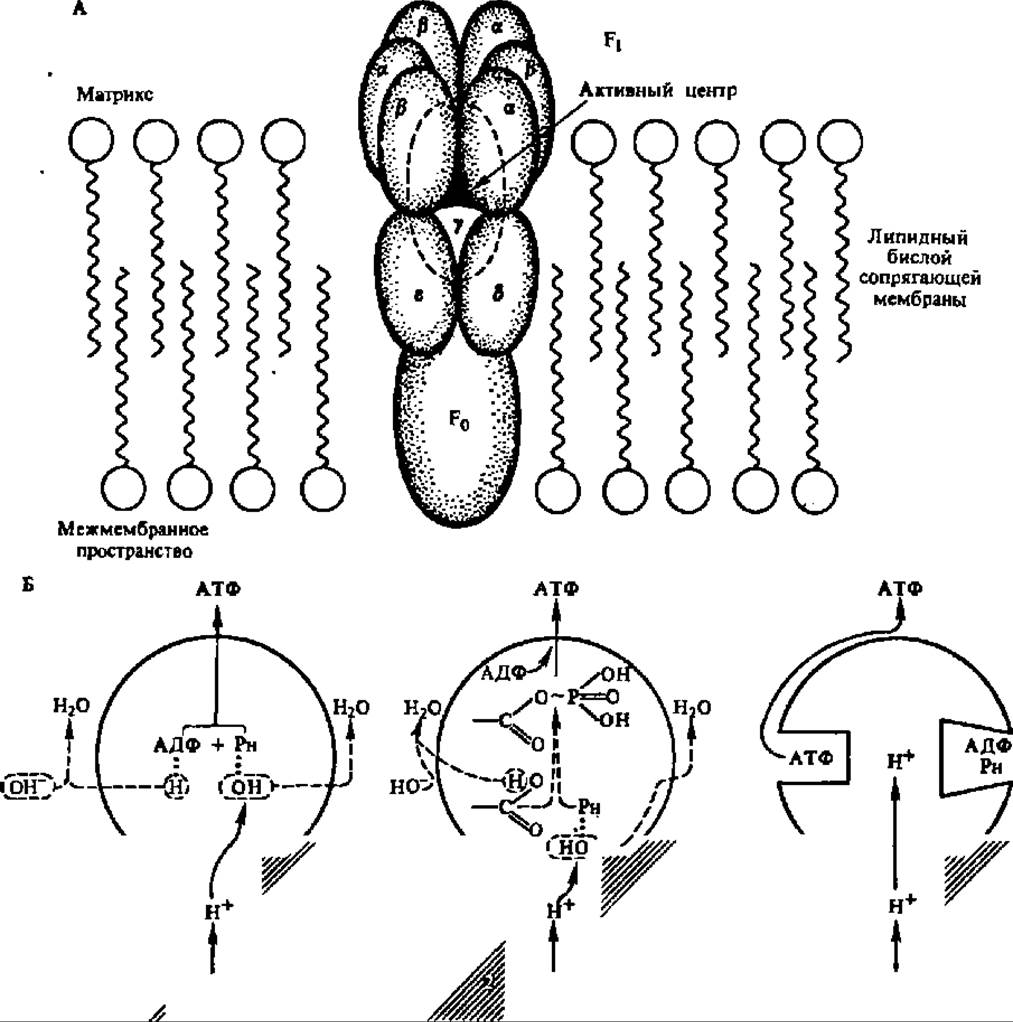
Рис. 133. Строение протонной АТФазы (пояснение в тексте)
АТФ-синтаза (протонная (АТФаза) представлена двумя белковыми комплексами, состоящими, в свою очередь, из субъединиц (рис. 133, А). Первый из них, полностью «утопленный» в сопрягающую мембрану и пронизывающий ее насквозь, состоит из трех видов гидрофобных полипептидных цепей (с различающимися в зависимости от объекта молекулярными массами порядка 19000—24000, 13500—18000 и 5400—8400 в соотношениях 1:2:5 или близких к этому) и обозначается как F0. Его функция состоит в доставке протонов из межмембранного пространства, куда он открывается, ко второму белковому комплексу, плотно к нему примыкающему.
Второй комплекс включает в свой состав пять различных белков и выступает, будучи частично погруженным, из сопрягающей мембраны в виде грибовидного выступа. Это F1-фактор или сопрягающий фактор, непосредственно ответственный за биосинтез АТФ. Его молекулярная масса, слегка варьирующая в зависимости от объекта выделения, составляет в среднем 368000, а субъединицы представлены полипептидами с М ~ 57 000 (а), 53 000 (ß), 34 000 (у), 17000 (δ) и 10000 (ε). По данным ряда авторов, субъединичный состав сопрягающего фактора подчиняется формуле a3β3уδε. Полагают, что каталитический центр, ускоряющий реакцию синтеза АТФ из АДФ и Н3РO4, находится на ß-субъединице, а а-субъединица прикрывает его от воздействия ингредиентов митохондриального матрикса. Есть также мнение, что Е-субъединица регулирует деятельность протонной АТФазы, ингибируя ее способность гидролизовать АТФ. Аналогично построены и действуют хлоропластная и бактериальная Н+-АТФазы.
Каким же образом возникает АТФ при посредстве АТФ-синтазы? На этот вопрос еще нет исчерпывающего ответа, но предложено несколько заслуживающих внимания концепций.
Первая из них сводится к предположению, что протоны, поступающие по протонпроводящему каналу F0, активируют неорганический фосфат (РH), связанный активным центром ß-субъединицы, отнимая от него ОН-группу (реакция элиминирования воды). Одновременно ОН-группа концевого фосфата АДФ, также присоединенного к активному центру ß-субъедийицы, теряет протон за счет взаимодействия с ОН- -группой матрикса (где ОН- -группы накапливаются в результате переноса Н+ в межмембранное пространство, см. рис. 131). Активированные фосфат и АДФ соединяются и образуют АТФ (рис. 133, Б, 1).
Вторая концепция состоит в допущении, что ионы Н в активном центре сопрягающего фактора активируют фосфат и карбоксильную группу одной из Субъединиц F1-фактора, в результате чего возникает фосфоэнзим, где фосфат присоединен макроэргической связью. При последующем взаимодействии АДФ и фосфоэнзима образуется АТФ (рис. 133, Б, 2). Здесь в видоизмененном состоянии представлена гипотеза переносчиков.
Tретья концепция исходит из предположения, что роль транслоцируемых в F1-фактор протонов состоит в изменении конформации F1-фактора. Обладая не менее чем двумя центрами связывания АДФ и неорганического фосфата, F1-фактор способен синтезировать АТФ из АДФ и РH, если связывающий центр находится в закрытом состоянии. При этом АДФ и Рн в нем находятся в окружении аминокислотных радикалов, способствующих отнятию молекулы воды и синтезу АТФ (рис. 133, Б, 3, правая сторона F1-фактора). При транслокации протонов центр связывания открывается, и АТФ из него поступает в матрикс (левая сторона F1-фактора на рис. 133, Б.3), а ее место занимают АДФ и РH Новый цикл конформационных перестроек переводит этот центр связывания в закрытое состояние с одновременным высвобождением готовой АТФ из другого связывающего центра, переходящего в открытое состояние. Легко заметить, что в этом объяснении механизма биосинтеза АТФ использованы идеи конформационной гипотезы сопряжения окисления с форфорилированием.
В последнее время появились новые точки зрения на механизм АТФ-синтазной реакции. А. Д. Виноградов предложил кинетическую модель, в соответствии с которой синтез АТФ в АТФазном комплексе и гидролиз АТФ F1-АТФазой идут разными путями и каталитически ускоряются разными формами фермента, причем синтазные центры локализованы на а-субъединице, агидролазные — на ß-субъединице. Л. Ф. Дмитриев обосновал вариант химической гипотезы, где роль интермедианта играет энергизированный липидный радикал сопрягающей мембраны и учитывается роль электрохимического потенциала и внутримембранных протонов в процессе сопряжения окисления с фосфорилированием.
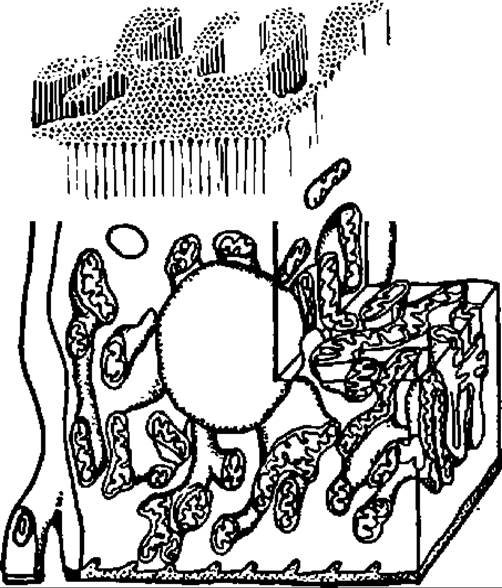
Рис. 134. Гигантские разветвленные митохондрии в клетках почечных канальцев
Кроме биосинтеза АТФ, электрохимический потенциал ∆μH+, возникающий на сопрягающей мембране и переводящий ее в энергетически заряженное, энергезированное состояние, является источником энергии для механической работы (например, для движения жгутиков у мутантов бактерий, утративших синтез АТФ за счет сопряжения окисления с фосфорилированием, вращения хлоропластов у харовых водорослей, вбуравливания цианобактерий в ил и т. п.), для поддержания осмотического давления и переноса веществ против градиента концентрации, для теплопродукции при утрате митохондриями дыхательного контроля (например, при переохлаждении животных, в период испарения цветами эфирных масел для привлечения насекомых и др.), для обращения вспять переноса электронов в дыхательной цепи ферментов, для синтеза пирофосфата и полифосфатов (как макроэргических соединений).
Источником энергезированного состояния мембраны может быть также возникновение электрохимического потенциала ∆μNa+, что характерно для некоторых морских бактерий. У них ∆μNa+ используется для приведения в движение жгутиков, создания солевых градиентов и, что самое важное, для синтеза АТФ при посредстве Na+-зависимой АТФазы (Na+-АТФ-синтазы). В связи с этим возникает вопрос о статусе других металлозависимых АТФаз (Na+, К+-АТФазы, Са2+-АТФазы) и не исключено, что эта область исследований станет в перспективе «горячей точкой» биоэнергетики.
Сказанное, по мнению В. П. Скулачева, наводит на мысль о том, что возникновение ∆μH+, а в ряде случаев ∆μNa+ на сопрягающей мембране есть универсальный способ запасения энергии в клетке, предшествовавший ее консервированию в макроэргических связях АТФ.
Более того, современные наблюдения говорят о том, что в клетках, например мышечных, существует митохондриальный ретикулум, при помощи которого митохондрии связаны в единую цепь или представляют собой одну гигантскую разветвленную митохондрию. По ее энергезированной мембране ∆μH+ может передаваться на значительные расстояния для того, чтобы в нужном месте обеспечить синтез необходимого количества АТФ или выполнить иные функции, присущие мембранному электрохимическому потенциалу (рис. 134).