ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 2. МЕХАНИЗМЫ ДЕЙСТВИЯ ФЛАВОНОИДОВ
2.1. Биодоступность и фармакокинетика флавоноидов
Клетки животных и человека не способны синтезировать флавоноиды. Поэтому они поступают в организм в результате потребления растительной пищи. Ежедневное потребление флавоноидов с пищей может находиться в пределах от десятков миллиграммов до нескольких граммов в зависимости от диеты. Поступление флавоноидов в организм происходит путем транспорта через клетки эпителия жеудочно-кишечного тракта. В адсорбции флавоноидов главную роль играют энтероциты тонкого кишечника (клетки каемчатого эпителия), которые выстилают более 90 % поверхности тонкого кишечника. Биодоступность флавоноидов очень низка. Из кишечника в кровь поступает менее 1 % флавоноидов, содержащихся в пище.
Молекулы большинства флавоноидов, потребляемых в пищу, за исключением флаван-3-олов, являются гликозидами и содержат один или несколько углеводных остатков пиранозидов или фуранозидов. В просвете кишечника они обычно подвергаются действию гидролаз, обладающих широким спектром активности в отношении флавоноид-О- гликозидов, в результате чего высвобождаются агликоны флавоноидов (рис. 36).
Рис. 36. Схема метаболического пути флавоноидов. В просвете кишечника гликозиды флавоноидов (ГФл) теряют гликозидную часть под действием лактозо-флоризин гидролазы (ЛФГ) и превращаются в агликоны флавоноидов (АФл), после чего (1) - часть из них всасываются кишечным эпителием и попадает в кровь; (2) - часть трансформируется с участием уридин-5-дифосфоглюкуронозил-трансферазы (УГТ). Далее к ним прикрепляется остаток глюкуроновой кислоты (ГлК), образующиеся конъюгаты поступают в воротную вену, доставляются в печень, где происходит их метилирование (Мет) и сульфатирование (Сульф) с участием ферментов катехол-О-метилтрансферазы (КОМТ) и фенолсульфотрансферазы (ФСТ). (3) - Значительная часть флавоноидов разрушается бактериями кишечника и продукты деградации выводятся с калом или (4) - доставляются в печень, окисляются с участием цитохрома Р450, выводятся с желчью в просвет кишечника, после чего удаляются с калом. Находящиеся в крови флавоноиды и продукты их модификации выводятся с мочой.
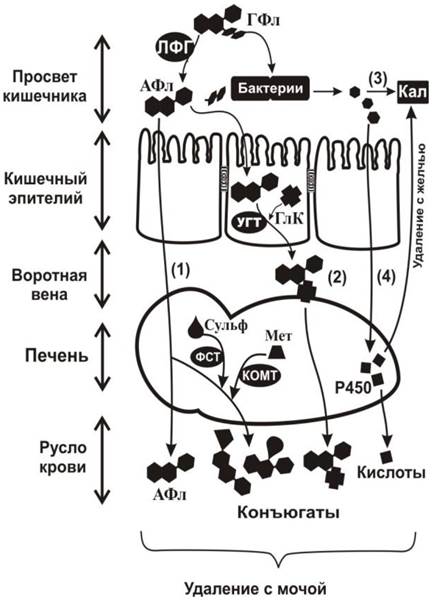
Высвобождающийся агликон флавоноида может всасываться клетками эпителия. Гидролиз может также происходить после проникновения гликозидов в цитоплазму клеток каёмчатого эпителия кишечника (энтероцитов) с участием фермента β-глюкозидазы. В цитоплазме энтероцитов эти молекулы дегликозилируются и к ним прикрепляется остаток глюкуроновой кислоты. Перед тем, как попасть в кровяное русло, эти вещества по воротной вене доставляются в печень, где они метилируются и сульфатируются с помощью соответствующих трансфераз (рис. 37). В кровяном русле преобладающей формой флавоноидов являются глюкурониды. Повышенная растворимость этих веществ в воде позволяет продлить их присутствие в кровяном русле.
Рис. 37. Некоторые примеры метаболитов кверцетина, присутствующих в кровяном русле. А - исходный кверцетин агликон, В - 3’-О-метилкверцетин, С - депротонированная форма кверцетин-3’-О-сульфата, D - депротонированная форма кверцетин-3- О-глюкуронида.
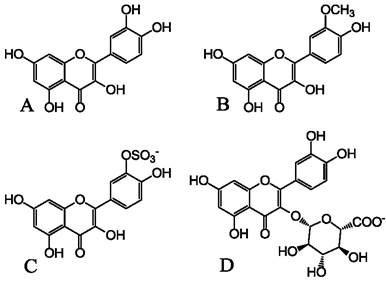
Антиоксидантная активность и способность связывать свободные радикалы у метаболитов кверцетина обычно несколько ниже, чем у исходных молекул, хотя существенные различия проявляются только в молекулах, модифицированных одновременно по нескольким гидроксильным группам. В физиологических условиях и при нейтральном рН глюкурониды и сульфаты флавоноидов депротонированы и несут отрицательный заряд. Это связано с низкой величиной кажущейся константы диссоциации (рКа) функциональных групп. Так, для глюкуронидов полифенолов рКа = 2,9-3,1.
Усвоению флавоноидов может препятствовать процесс их обратного транспорта из эпителия в просвет кишечника, происходящий вследствие работы АВС-транспортеров (семейство транспортеров АТФ- связывающей кассеты), определяющих множественную устойчивость к лекарствам. Кроме того, часть флавоноидов и продуктов их деградации и окисления с участием цитохрома Р450 попадает в состав желчи и секретируется обратно в просвет кишечника через желчный проток.
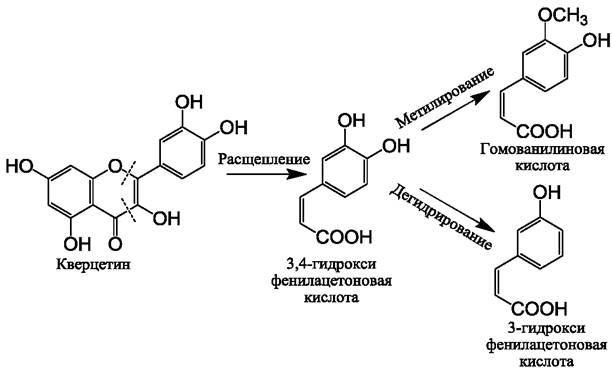
Значительная часть флавоноидов и их производных, которые не адсорбировались в тонком кишечнике, попадают в толстую кишку, где соответствующая микрофлора расщепляет молекулы флавоноидов (рис. 38), в результате чего образуются фенольные кислоты и гидроксициннаматы, которые затем адсорбируются эпителием, попадают в печень после некоторых метаболических изменений, попадают в русло крови и в дальнейшем экскретируются в мочу.
Рис. 38. Деградация кверцетина энтеробактериями. Образубщиеся кислоты являются гидроксициннаматами (производными коричной кислоты).
Так, при исследовании радиоактивно меченного кверцетин-4’- гликозида было показано, что при прохождении пищеварительного тракта он конвертируется в фенольные кислоты и через 72 часа 69 % метки удаляется с мочой. В результате этих процессов концентрация продуктов катаболизма некоторых флавоноидов в кровяном русле может превосходить концентрацию исходных флавоноидов.
Флавоноиды и их продукты разложения подвергаются метаболическим превращениям в кишечном эпителии и в печени, включая метилирование гидроксильных групп и восстановление карбоксильных групп, а также конъюгацию с глюкуроновой кислотой. Эти конъюгаты экскретируются с мочой в качестве конечных продуктов метаболизма. Часть из них может поступать в желчь и в дальнейшем удаляться с калом. Фармакокинетику полифенольных соединений в организме человека можно описать следующим образом (табл.1).
Таблица 1. Судьба полифенольных соединений, потребляемых в течение суток.
Пути перемещения и метаболизм растительных полифенолов |
Агликоны (мг/день) |
Общее потребление в сутки |
450-600 |
(1) 5-10 % адсорбируется в тонком кишечнике и экскретируется с мочой |
20-60 |
(1а) 5-10 % неизмененные полифенолы в крови |
<6 |
(1б) 90-95 % образование конъюгатов |
15-55 |
(2) 90-95 % ферментируется в толстом кишечнике и удаляется с калом или всасывается, трансформируется в печени и удаляется с желчью |
400-570 |
Среди продуктов питания, потребляемых ежедневно, чай наиболее богат флавоноидами. Прежде всего, следует упомянуть зеленый чай, который содержит до 30 % катехинов в расчете на сухой вес листьев. Через два часа после потребления одной чашки зеленого или черного чая (350-600 мл) в плазме крови обнаруживается 0,3-1,0 мкМ катехинов. При повышении дозы концентрация катехинов в крови может достигать 10 мкМ. Кверцетин, нарингенин и гесперидин характеризуются меньшей биодоступностью, чем катехины, но при потреблении больших количеств овощей и фруктов их концентрация также может достигать десятков и сотен наномолей на литр.
Возникает вопрос, каким образом флавоноиды проникают через гидрофобный барьер плазматической мембраны клеток эпителия. Известно, что агликоны флавоноидов плохо растворимы в воде и достаточно гидрофобны, чтобы самостоятельно проникать через фосфолипидный бислой биологических мембран, как это было показано на примере таксифолина. Однако было обнаружено, что водорастворимые гликозиды флавоноидов, например, моногликозиды кверцетина (но не дигликозиды), могут проникать в клетки эпителия с участием переносчиков сахаров, таких как Na-зависимый GLUT1 или GLUT2. С участием переносчиков процесс адсорбции гликозидов протекает даже быстрее, чем агликонов кверцетина. Кроме того, гидрофобные агликоны, возможно, также проникают в клетки эпителия при участии главного инсулинозависимого переносчика глюкозы GLUT4. Примечательно, что флавоноид генистеин способен подавлять транспортную активность этого переносчика, и таким образом влиять на инсулинозависимый транспорт глюкозы адипоцитами. Аналогично, флавоноиды нарингенин и флоризин способны подавлять адсорбцию сахаров кишечным эпителием, что может быть использовано в лечении диабета.
Транспортер билирубина билитранслоказа способен также участвовать в транспорте флавоноидов в кишечнике. Флавоноиды могут также ингибировать работу белков, принадлежащих к семейству монокарбоксилат-переносчиков, например, MST2 и SLC-16, участвующих в транспорте лактатов, пируватов, кетонных тел и различных лекарственных веществ. Однако возможность участия этих транспортеров в переносе флавоноидов остается под вопросом.
При деградации флавоноидов бактериями образуются гидроксифенил-ацетоновые кислоты. Образующиеся при деградации кемпферола и кверцетина кислоты могут обладать транквилизирующим действием. Можно предположить, что в некоторых случаях лекарственное действие оказывают продукты метаболизма флавоноидов, тогда как сами флавоноиды являются лишь предшественниками этих агентов.
Находясь в русле крови, флавоноиды взаимодействуют с белками, прежде всего с альбуминами. Взаимодействие наблюдалось в исследовании кемпферола и галандина, диосметина, лютеолина, таксифолина и катехинов. Это взаимодействие осуществляется спонтанно с выделением энергии и связано с действием гидрофобных сил. Так, апигенин спонтанно связывается с бычьим сывороточным альбумином (BSA) с отрицательной величиной энергии Гиббса в сайте I субдомена II. С аналогичным сайтом сывороточного альбумина человека (HSA) связывается фисетин. Спонтанное взаимодействие с высвобождением свободной энергии наблюдалось также в исследовании дигидрохалкона. Эпикатехин связывается с BSA с константой связывания 1,0 х 106 М-1 в сайте II субдомена IIIA, тогда как константа связывания эпикатехин-галлата составляет 6,6 х 107 М-1 в сайте I субдомена IIA. Наблюдающиеся различия авторы объясняют влиянием галлоильной группы. Гесперетин связывается с сывороточным альбумином человека (HSA) с константой связывания 1,941 х 104 М-1. Морин связывается с BSA в сайте II субдомена IIIA.
При взаимодействии с альбумином флавоноиды могут конкурировать за места связывания с некоторыми токсинами. Например, в результате конкуренции между охратоксином А (ochratoxin A, продуцируемый плесневыми грибами Aspergillus ochraceus и распространенный в пищевых продуктах) и некоторыми флавоноидами токсин удаляется с поверхности молекулы альбумина и токсическое действие снижается. Тяжелые металлы (Cd2+, Hg2+, Pb2+) способны оказывать влияние на взаимодействие флавоноидов с альбуминами, что может быть связано с конформационными изменениями молекулы белка.
Флавоноиды могут также связываться с липопротеинами крови. Так, кверцетин связывается с липопротеинами низкой плотности (LDL). При связывании с окисленной формой LDL наблюдается защитное действие кверцетина в отношении макрофагов, для которых окисленные LDL токсичны и вызывают апоптоз. Аналогичное защитное действие против окислительного стресса наблюдалось при связывании дельфинидин- 3-глюкозида с окисленными LDL.