ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 2. МЕХАНИЗМЫ ДЕЙСТВИЯ ФЛАВОНОИДОВ
2.2. Антиоксидантные свойства флавоноидов
2.2.1. Окислительно-восстановительные реакции
В биологических системах процессы окисления чаще всего сопровождаются присоединением кислорода или удалением водорода, в результате чего молекула отдает электрон, что соответствует понятию «окисление». Эти процессы лежат в основе многих метаболических путей. Однако некоторые агенты, не вовлеченные непосредственно в метаболические цепи реакций, могут инициировать появление побочных продуктов окисления и вызывать повреждение клеток. Такие агенты называются прооксидантами. К прооксидантам относят так называемые реактивные (у некоторых авторов - «активные») формы кислорода - ROS (reactive oxygen species - ROS). Существуют также реактивные формы азота (RNS), хлора, серы, фосфора.
Необходимо отметить, что в нормальных процессах метаболизма постоянно возникают ROS, которые в малых концентрациях участвуют в процессах клеточной сигнализации. Повреждение клеток наступает только при избыточной продукции ROS. Кроме того, повреждение клеток агентами ROS наблюдается не только в патологических процессах, но также используется фагоцитами для разрушения инородных белков и одноклеточных организмов. Агенты, препятствующие возникновению ROS и тем самым защищающие клетки от повреждений, называются антиоксидантами.
Для поддержания нормальной жизнедеятельности в клетке должен соблюдаться баланс процессов окисления и восстановления. Это в полной мере относится к вопросу о необходимости сбалансированного содержания антиоксидантов и агентов ROS в организме. В литературе часто обсуждаются вопросы, связанные с избыточной продукцией ROS, приводящей к так называемому окислительному стрессу, с которым предлагается «бороться» путем повышения концентрации антиоксидантов. Однако не следует забывать, что избыток восстанавливающих агентов также нежелателен и может быть причиной развития восстановительного стресса, который менее изучен, но требует не менее пристального внимания со стороны исследователей, поскольку может быть причиной различных заболеваний. Так, избыточное содержание в клетке глутатиона, одного из важнейших восстановительных агентов цитоплазмы, может парадоксальным образом оказывать токсическое действие вследствие активации окислительных процессов в митохондриях.
2.2.2. Окислительный стресс в живых системах
За два столетия, прошедших с момента открытия кислорода Антонио Лавуазье, необходимость контроля взаимодействия этого агента с молекулярными компонентами живых систем приобретает все большую актуальность. Термины «антиоксиданты», «окислительный стресс», «окислительное повреждение» и, наконец, «свободные радикалы» часто используются в биологии и медицине. Впервые термин «свободные радикалы» был введен американским исследователем Мозесом Гомбергом. Следует заметить, что в настоящее время, в соответствии с рекомендациями IUPAC, считается, что слово «свободные» является избыточным, поскольку не существует «несвободных» радикалов. В середине 50-х гг. прошлого века в работах Даниэля Гильберта (Daniel Gilbert) и Ребекки Гершам (Rebecca Gersham) впервые были высказаны идеи о роли радикалов в биологических процессах, приводящих к старению организмов.
Многочисленные исследования, проведенные в последние годы, раскрывают механизмы, благодаря которым неуловимые методами традиционной химии частицы, содержащие атомы кислорода, хлора, серы или азота, не только участвуют в важных процессах функционирования живых систем, но также в некоторых случаях являются ядами, вызывающими разнообразные патологические процессы, лежащие в основе многих заболеваний.
2.2.2.1. Радикалы
Наиболее характерной особенностью радикалов является их высокая реакционная способность. Радикалами следует называть атомы, молекулы или ионы, имеющие один или два неспаренных электрона на внешней орбитали, т. е. образующих незаполненную электронную оболочку, способную вступать в химические реакции. Наличие неспаренного электрона на внешней орбитали обычно придает молекуле повышенную реакционную способность. Для образования пары молекула стремится присоединить дополнительный электрон от соседних молекул, что определяет окислительные свойства радикалов.
Молекула кислорода является одним из основных источников окисления веществ на Земле. В основном стабильном состоянии молекулы кислорода имеют два неспаренных электрона p-орбитали на внешнем втором уровне. Такое состояние называется триплетным и обозначается 3Σg- (рис. 39).
Рис. 39. Электронное строение атома кислорода. Атом кислорода имеет восемь электронов, которые располагаются на двух энергетических уровнях в соответствии с формулой 1s22s22р4. Как следует из формулы, на внешнем, втором уровне р-орбиталь содержит два неспаренных электрона, способных вступать в химические реакции и определяющих валентность кислорода, равную двум.
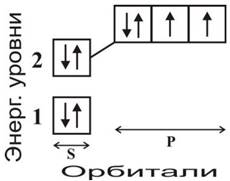
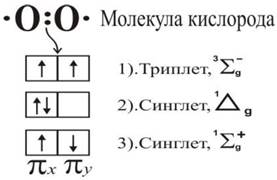
Формально молекулу кислорода можно рассматривать как бирадикал, однако ее реакционная способность не очень велика, поскольку электроны триплетного кислорода имеют одинаковые (параллельные) спины (рис. 40). Существенное повышение реакционной способности наблюдается в том случае, если молекула кислорода находится в возбужденном синглетном состоянии, когда спины электронов антипараллельны. Известны два возбужденных синглетных состояниях 1∆g и 3Σg+. При этом, только состояние 1∆g достаточно стабильно и имеет существенное значение в окислительных процессах живой клетки.
Рис. 40. Электронное строение р-орбитали второго энергетического уровня электронов в молекуле кислорода, участвующих в образовании связи между атомами. Показаны триплетное (основное) и два синглетных (возбужденных) состояния электронов молекулы кислорода.
2.2.2.2. Номенклатура радикалов
В химической формуле неспаренный электрон, находящийся на внешней орбитали, обозначается точкой в верхнем индексе справа, за которой при необходимости следует указание величины и знака заряда, например, О2•- (но не О2-•), или РO3•2-. Если неспаренных электронов несколько, перед точкой ставится цифра, при этом могут использоваться скобки, например: О22• или NO(2•)-.
Необходимо отметить, что металлы, их ионы или комплексы, содержащие неспаренные электроны, не следует считать радикалами, а их неспаренные электроны не обозначают точкой в формуле, поскольку они находятся на внутренних орбиталях. Однако в случаях, когда к металлу присоединен лиганд, являющийся радикалом, точку, обозначающую радикал, следует использовать.
Не связанные (свободные) атомы, не имеющие заряда, называют по названию элемента, перед которым при необходимости может стоять приставка «моно». В названиях полиатомных радикалов может использоваться две стратегии: заместительная номенклатура и координационная номенклатура. Координационная номенклатура более эффективна в названиях малых неорганических молекул. Заместительная номенклатура пригодна в названиях сложных органических молекул.
В координационной номенклатуре сначала избирается центральный атом, например, Si, C, Sb, As, P, N, S, I, Br, Cl, O, F. Это может быть также группа одинаковых или различных атомов, например, N3•, Cl2•-, HO3•, ClOO•, (СN)2•-. Для гомополиатомных заряженных радикалов, например, О2•-, используется суффикс «ид», а для гетерополиатомных заряженных радикалов, включая те, которые содержат два различных атома, один из которых водород, как например (HS)2•-, используется суффикс «ат». Сам атом водорода никогда не избирается центральным атомом, но может рассматриваться как присоединенный атом.
Заместительная номенклатура основывается на названиях гидридов исходных (родительских) молекул. Например, для СН4, NН3, H2O, PH3, H2S предлагаются названия метан, азан, оксидан, фосфан и сульфан соответственно. Различные особенности или модификации родительских молекул обозначаются суффиксами. Радикал обозначается суффиксом «-ил». Положительный заряд обозначается суффиксом «-иумил», а отрицательный - суффиксом «-идил». Например, чтобы дать название О2•-, необходимо исходить из того, что прародителем этого вещества является диоксидан (перекись водорода), который потерял сначала один гидрон (Н+), в результате чего получился диоксиданид, а затем потерял второй гидрон, в результате чего получился диоксиданидил (О2•-).
2.2.2.З. Прооксиданты
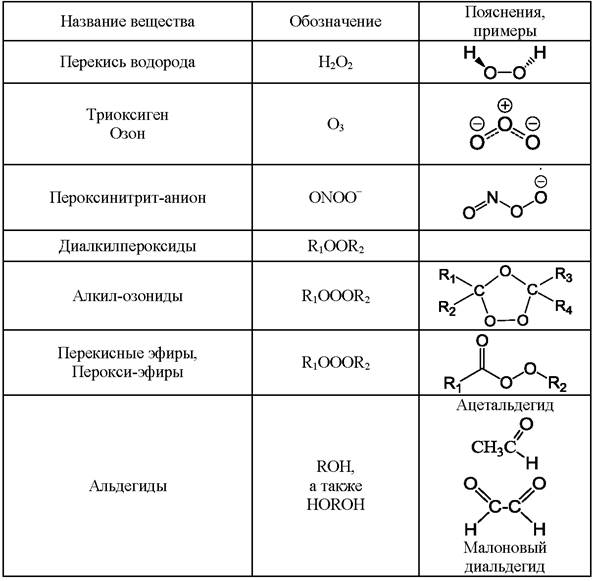
К прооксидантам относятся радикалы и разнообразные активные окислители, не являющиеся радикалами (табл. 2 и 3). Кроме атомов кислорода, радикалы могут содержать атомы хлора, азота, серы и других элементов. В соответствии с этим различают активные формы кислорода, активные формы хлора, активные формы азота и т. д.
В природе радикалы образуются в результате расщепления молекул под действием высоких температур или радиации, однако в живой клетке радикалы постоянно образуются в различных химических реакциях с участием ферментов и металлов переменной валентности, которые могут служить донорами или акцепторами электронов.
Таблица 2. Примеры некоторых прооксидантов - активных форм кислорода, азота, хлора, серы, фосфора, являющихся радикалами.
Название вещества |
Формула. |
Название вещества |
Формула |
(1) Диоксид (•1-) (2) Диоксиданидил Диоксид-анион-радикал Супероксид-анион-радикал |
O2•- |
(1) Сульфид (•1-) (2) Сульфанидил |
S•- |
(1) Диоксиген (•1+) |
O2•+ |
(1) Диоксидосульфат (•1 -) |
SO2•- |
(1) Триоксид (•1-) (2) Триоксиданидил Триоксид-анион-радикал Озонид |
O3•- |
(1) Триоксидосульфат(•1-) |
SO3•- |
(1) Оксидонитроген (•) (2) Оксоазанил Нитрозил-радикал |
NO• |
(1) Тетраоксидосульфат(•1-) |
SO4•- |
(1) Оксидонитрат (2•1-)(триплет) Нитроксил-бирадикал |
NO(2•)- |
(1) Дисульфид (•1-) (2) Дисульфанидил |
S2•- |
(1 )Диоксидонитроген(•2-)Нитрозооксиданил Нитрил-радикал |
(1) Монохлорин(^) Хлорозил-радикал |
Сl• |
|
(1) Диоксидонитрат(•2-) |
(1) Оксидохлорин(•) Хлорозил-радикал |
СlO• |
|
(1 )Триоксинитроген(•) Нитрооксиданил (2) Нитрозодиоксиданил |
ONOO• (NO3•) |
(1) Диоксидохлорин(•) |
ClO2• |
(1) Гидридодиоксиген (•) (2) Диоксиданил Надпероксид-радикал |
HO2• |
(1) Триоксидохлорин(•) |
СlO3• |
(1) Гидридотриоксиген (•) (2) Триоксиданил Озонид-радикал |
НO3• |
(1) Тетраоксидохлорин |
СlO4• |
(1) Гидридосульфур (•) (2) Сульфанил |
НS• |
Гипохлорит-анион |
СlO- |
(1) Дигидридонитроген (•) (2) Азанил |
NH2• |
(1) Дихлорид (•1-) |
Сl2•- |
(1) Оксидофосфорус (•) (2) Оксофосфанил Фосфорил-радикал |
РO• |
(1) Гидридооксикарбон(•) (2) Оксометил Оксометил-радикал |
НСO• |
(1) Триоксидофосфат (•1-) |
РO3•2- |
Алкоксил-радикалы |
RO• |
(1) Тетраоксидофосфат(•2-) |
РO4•2- |
Алкилдиоксил-радикалы Алкилпероксил-радикалы Алкилпероксидные радикалы |
RO2• |
Примечание. B таблице представлены различные варианты названий и обозначений, предложенные Международным обществом чистой и прикладной химии (IUPAC), а также часто встречающиеся в литературе. Цифрой (1) обозначаются названия, данные в соответствии с координационной номенклатурой, цифрой (2) - заместительной номенклатурой. Последующие названия следует считать тривиальными названиями, часто встречающимися в литературе.
Таблица 3. Примеры активных форм кислорода - не радикалов. Представлены продукты окисления органических и неорганических веществ, являющиеся прооксидантами.
Присутствие в тканях и цитоплазме перекиси водорода имеет большое значение в окислительных процессах. Перекись водорода образуется в процессе дисмутации (взаимодействия) супероксидных анион-радикалов O2•- в матриксе митохондрий и в цитозоле клеток с участием фермента супероксиддисмутазы (СОД). Реакция может быть записана следующим образом:
2O2•- —> 2Н+ —> Н2О2 + О2.
В дальнейшем, образовавшиеся компоненты реакции могут участвовать в формировании еще более активного прооксиданта - гидроксил-радикала (ОН•) в реакции:
О2 + Н2О2 —> О2 + ОН- + ОН•.
Ионы железа могут существенно ускорить этот процесс. Одним из наиболее хорошо известных примеров формирования радикалов с участим железа является реакция Фентона, названная в честь Генри Фентона (H. Fenton), впервые обнаружившего необычные особенности взаимодействия перекиси водорода с ионами железа в 1894 г. Более детальное описание этого процесса и предположение о формировании свободных радикалов было сделано полвека спустя. Лишь в 50-60 гг. XX века было обнаружено изменение степени окисления железа и некоторых других металлов переменной валентности в реакциях с участием перекиси водорода. Кроме того, было исследовано биологическое значение процессов, названных химией Фентона. В литературе часто используются также название «реакция Фентона». В этих процессах происходит окисление и восстановление железа в присутствии перекиси водорода:
(1) Fe2+ + H2O2—> Fe3++ HO• + OH-,
(2) Fe3+ + О2•- —> Fe2+ + O2,
суммарный процесс: Н2О2 + О2•- —> HO• + O2.
Реакция (1) впервые была описана в работе Хабера и Вейса, где получила название «реакция Фентона». Образующийся в результате расщепления перекиси водорода гидроксил-радикал (HO•) участвует во многих процессах окисления органических веществ, включая белки, нуклеиновые кислоты, но главным образом липиды. В результате этих реакций образуются новые активные радикалы и перекиси, что может стать причиной лавинообразного развития процессов по механизму цепной реакции. Это связано с высокой активностью гидроксил-радикала в сравнении с другими прооксидантами (табл. 4).
Таблица 4. Активные формы кислорода и родственные соединения.
Соединения |
Название |
Формула |
Относительная активность |
Радикалы |
Супероксид-анион-радикал Пероксил-радикал Гидроксил-радикал Алкоксил-радикал Алкилпероксил-радикал |
О2•- HO2• НО• RО• RO2• |
0 1 107 104 1 |
Нерадикалы |
Пероксид водорода Синглетный кислород Гипохлорит-анион Пероксинитритная кислота |
Н2О2 1О2 СlO- ОNООН |
0 1 103 102 |
Несмотря на значительные различия в активности прооксидантов, представленных в таблице, все они могут оказывать существенное влияние на метаболизм клетки, вызывать окислительный стресс и даже гибель клетки, если механизмы защиты работают недостаточно эффективно. Необходимо учитывать условность представленных в табл. 4 данных, поскольку для оценки истинной активности этих веществ в клетке необходимо учитывать также время их «жизни» и концентрацию в цитоплазме. Кроме того, активность прооксидантов может значительно изменяться в средах различной полярности. Так, активность O2•- в водном окружении низка, но существенно повышается в неполярных средах, таких как гидрофобная область липидного бислоя.
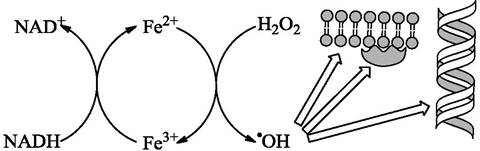
В живой клетке различные процессы участвуют в формировании гидроксил-радикала, являющегося самым активным окислителем. Кроме процессов окисления железа в присутствии перекиси водорода, он образуется также в аналогичном процессе окисления меди. Кроме того, он образуется при разложении пероксинитритной кислоты. В клетке присутствует также значительное количество перекиси водорода, которая образуется в процессе дыхания митохондрий. При этом, металлы железо и медь находятся в цитоплазме преимущественно в восстановленном состоянии благодаря присутствию восстановителей, таких как NADH, NADPH и др. Процесс продуцирования гидроксил-радикала в клетке происходит в цепи циклических реакций (рис. 41).
Рис. 41. Циклический процесс окисления и восстановления ионов железа внутриклеточными восстановителями (NADH) и окислителями (Н2O2) в реакции Фентона приводит к образованию радикалов гидроксила, что может вызывать окислительное повреждение мембранных липидов, белков и нуклеиновых кислот.
2.2.3. Индуцированное окисление липидов
Известны три механизма индуцированного окисления липидов: автоокисление радикалами, фотоокисление и ферментативное окисление. В живой клетке радикальные процессы и реакции участвуют в таких важных процессах, как транспорт электронов в дыхательных цепях ферментов, метаболизм липидов, включая синтез эйкозаноидов, к числу которых принадлежат такие важные вещества, как лейкотриены, простагландины, тромбоксаны и катехоламины. Эти вещества регулируют пролиферацию и дифференциацию клеток, эндоцитоз и секрецию веществ, апоптоз и гибель клеток. Интенсивность перекисного окисления липидов (ПОЛ) зависит от соотношения активности прооксидантов и антиоксидантов в клетке. Парадоксально, но именно восстановители - легкоокисляющиеся вещества, могут служить наиболее активными прооксидантами, способными индуцировать появление свободных радикалов. К их числу следует отнести НАДФН2 и НАДН2, полиненасыщенные жирные кислоты, продукты метаболизма простагландинов и катехоламинов. Прооксидантами могут быть также витамины, например, А и D, если они находятся в избытке.
Существенную роль в процессах окисления мембранных липидов играет супероксид-анион-радикал (O2•-), поскольку его химическая активность существенно возрастает в неполярном окружении фосфолипидного бислоя. Супероксид-анион-радикал способен атаковать эфирную связь, в результате чего происходит отщепление жирной кислоты. Еще большей активностью обладает пероксид-радикал (НО2•), который к тому же не несет заряда и поэтому лучше растворяется в гидрофобной области липидного бислоя, чем супероксид-анион-радикал.
Одним из наиболее ярких примеров разрушительного действия процессов окисления липидов является так называемый «дыхательный взрыв» - резкое повышение потребления кислорода нейтрофилами и макрофагами в процессе иммунного ответа. При этом кислород участвует в продуцировании супероксид-анион-радикала. В результате дальнейших реакций в цитоплазме накапливаются такие активные окислители, как гипохлорит и пероксинитрит, которые являются мощными цитотоксическими агентами и участвуют в иммунной реакции против бактериальных, грибковых и гельминтозных инфекций, а также в развитии аутоиммунных заболеваний. Примечательно, что при окислении углеводородных цепей ненасыщенных липидов, жирные кислоты также могут удалятся в результате атаки эфирных связей фосфолипазой А2. В результате происходит существенное нарушение барьерных свойств мембран, что может приводить к гибели клеток.
Повреждающее действие процессов перекисного окисления на клеточные мембраны связано с потерей в составе мембран полиненасыщенных липидов и накоплении в бислое продуктов окисления, включая свободные жирные кислоты, их окисленные продукты, а также их олигомеры, образующиеся в результате поперечных сшивок. Кроме того, накопление низкомолекулярных токсических продуктов окисления, включая альдегиды и диальдегиды, например, малоноваый диальдегид, способны образовывать поперечные сшивки в цепях белков и нуклеиновых кислот.
Различают три этапа перекисного окисления липидов (ПОЛ) с участием радикалов: инициация, распространение, завершение. Рассмотрим их подробнее.
2.2.3.1. Стадия инициации ПОЛ
Если в среде нет перекиси водорода, процесс инициации ПОЛ начинается с отсоединения атома водорода от метиленовой группы (-СН2-) в углеводородной цепи. Этот процесс может протекать в полиненасыщенных жирных кислотах под действием радикала гидроксила (ОН•), тогда как супероксид-анион-радикал O2•- недостаточно активен для этого. Реакция протекает по формуле: -СН2- + ОН• —> -СН• + Н2О.
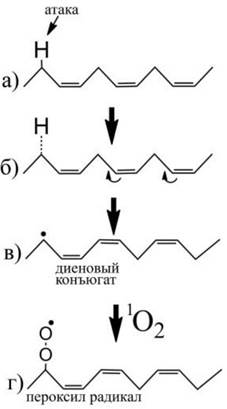
Процесс ПОЛ может наблюдаться даже в анаэробной среде, если присутствуют достаточно активные радикалы (рис. 42). Присутствие двойной связи в цепи ослабляет связь С-Н углеродного атома, соседнего с двойной связью, облегчая тем самым атаку радикалов и отсоединение водорода. В процессе реакции происходит изменение положения двойных связей, в результате чего соседние двойные связи сближаются и образуют диеновый конъюгат. Конечным продуктом этой стадии окисления является алкильный радикал. В присутствии синглетного кислорода происходит дальнейшее окисление углеводородной цепи, в результате которого образуется пероксильный радикал.
Рис. 42. Процесс ПОЛ в полиненасыщенных углеводородах, например, в жирных кислотах фосфолипидов биологических мембран. В отсутствие кислорода происходит:
(а) - атака углеводородной цепи свободными радикалами, (б) - реорганизация молекулы углеводорода, (в) - образование алкильного радикала и конъюгация двойных связей с образованием диеновых конъюгатов. В присутствии синглетного кислорода происходит: (г) - окисление алкильного радикала до алкилпероксильного радикала.
2.2.3.2. Стадия распространение ПОЛ
Алкилпероксильные радикалы также могут активно взаимодействовать с соседней углеводородной цепью, особенно полиненасыщенных липидов, и захватывать атом водорода.
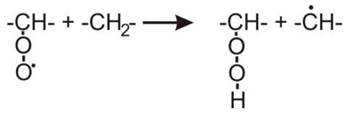
В результате реакции образуется неактивный алкилгидропероксид и алкильный радикал, способный снова взаимодействовать с кислородом и образовывать алкилпероксильный радикал. Таким образом, реакция повторяется многократно, а концентрация перекисей растет.
2.2.3.3. Стадия терминации ПОЛ
Терминация (обрыв цепи окислительных реакций) может наступить, если образование алкильного радикала не происходит. Такие реакции могут инициироваться, например, в присутствии α-токоферола, который в мембранах является главным агентом, прерывающим цепи окисления. Так, алкильный радикал R• может взаимодействовать с перокидным радикалом ROO• и образовывать стабильный мостик между двумя углеводородными цепями ROOR, или молекулы пероксида, взаимодействуя с флавоноидами, могут образовывать неактивную форму гидроксилированого производного ROH, как это будет показано далее.
2.2.4. Другие продукты окисления
2.2.4.1. Образование эпоксидов
Другим важным классом соединений, образующихся в процессе ПОЛ, являются эпоксиды. Эпоксиды формируются при атаке двойной связи алкилпероксильным радикалом:
![]()
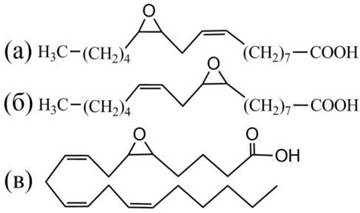
Эпоксиды обнаруживают в биологических тканях, претерпевших окислительный стресс, например, в результате повреждения при ожоге или при ишемии. Эпоксиды жирных кислот обладают высокой биологической активностью. Например, эпоксиды линолевой кислоты токсичны и получили название лейкотоксины (рис. 43).
Рис. 43. Биологически-активные эпоксиды, образующиеся в процессе перекисного окисления липидов. Лейкотоксины: (а) - 12,13-эпокси-9-октадеканоевая кислота,
(б) - 9,10-эпокси-12-октадеканоевая кислота, (в) - продукт окисления арахидоновой кислоты: 5,6-эпокси-8,11,14-эйкоза- триеновая кислота (ЭЭТ).
Продукт окисления арахидоновой кислоты - эпоксиэйкозо- триеновая кислота (ЭЭТ) обладает антивоспалительным действием и может регулировать активность тирозинкиназы. Она участвует в кальциевой сигнализации и способна регулировать скорость кровяного потока, агрегацию кровяных пластинок, миграцию клеток, апоптоз, фибринолиз, секрецию стероидных гормонов. ЭЭТ продуцируется многими тканями, включая печень, почки, поджелудочную железу, яичники, клетки эндотелия и мозга.
2.2.4.2. Окисление холестерина
В зависимости от условий окисления и химической природы окислителя могут появляться различные формы окисленного холестерина (рис. 44). Окислении эфиров холестерина зависит от присутствия различных видов окисленных жирных кислот. Подробное описание процессов окисления стероидов, химического строения, а также биологической активности окисленных продуктов холестерина можно найти в обзоре Шроепфера. Анализ продуктов окисления фитостеролов можно найти в обзоре Ховенкампа.
Рис. 44. Примеры продуктов окисления холестерина: (а) - холестерин, неокисленный, (б) - 7α-ОН или 7β-ОН холестерин, (в) - 7-кето холестерин, (г) 5,6α- или 5,6β-эпоксихолестерин.
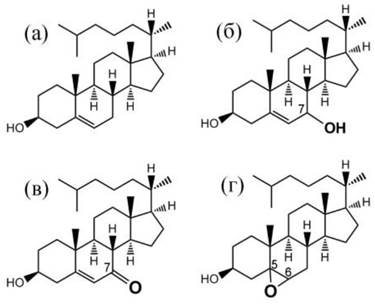
Многие наиболее важные оксистеролы продуцируются в клетке с участием белков комплекса цитохрома Р450. Для человека наиболее важными являются 27-, 24-, 7α- и 4β-ОН-гидрохолестерины. Аналогичные продукты могут также образовываться при термической обработке пищи в процессе приготовления, в результате так называемого автоокисления холестерина. Наиболее важными продуктами автоокисления являются 7-кето- и 7β-ОН-холестерины. Продукты окисления холестерина могут обладать цитотоксическим действием, влиять на экспрессию генов, а также на процессы клеточной сигнализации.
2.2.4.3. Конечные продукты окисления липидов
В процессе ПОЛ происходит фрагментация полиненасыщенных углеводородных цепей, в результате чего могут образовываться малые химически активные молекулы, которые называют конечными продуктами окисления (advanced lipoxidation end products) (рис. 45). К ним можно отнести альдегиды - акролеин, кротоновый альдегид, гексанал, малоновый диальдегид и глиоксаль, а также 4-гидрокси-2-ноненал (hydroxynonenal HNE) и др. вещества.
Рис. 45. Конечные продукты окисления полиненасыщенных липидов: малоновый диальдегид (а); глиоксаль (б); 4-гидроксиноненал или 4-гидрокси-2-ноненал (в).
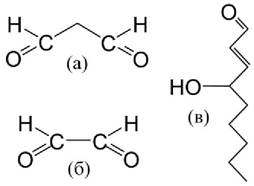
Наиболее известным и давно исследуемым является малоновый диальдегид (МДА), образующийся во многих процессах перекисного окисления природных липидов (рис. 46). Измерение содержания МДА часто используется для оценки интенсивности окислительных процессов в тканях. Однако точный механизм формирования МДА не установлен. Возможно, что предшественниками МДА являются моноциклические пероксиды, образующиеся при окислении жирных кислот (рис. 46) Источником МДА могут служить также предшественники простагландинов. Так, тромбоксан синтаза может образовывать МДА наряду с тромбоксаном А2 при действии на эндопероксид простагландина в процессе активации кровяных пластинок человека. МДА является очень важным продуктом ПОЛ, поскольку он весьма реакционноспособен и может взаимодействовать с белками и полинуклеотидами, образуя поперечные сшивки между цепями. Альдегиды способны взаимодействовать с различными молекулами, включая белки, аминокислоты, и аминофосфолипиды, в результате чего наблюдаются значительные изменения из свойств, приводящие к гибели клеток и повреждению тканей. Продукты химического взаимодействия этих агентов с молекулярными компонентами клетки называются аддуктами (рис. 47).
Рис. 46. Предполагаемый процесс формирования МДА. Алкилпреоксильный радикал (а) взаимодействует с соседней двойной связью, находящейся на той же самой цепи, в результате чего образуется моноциклический пероксид, происходит реорганизация двойных связей, и следующий по положению атом углерода приобретает неспаренный электрон (б). В процессе дальнейшего окисления, образовавшегося алкилпероксильного радикала, формируется алкилгидропероксил, происходит расщепление углеводородной цепи (в) и образование МДА (г).
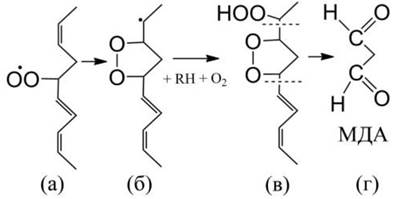
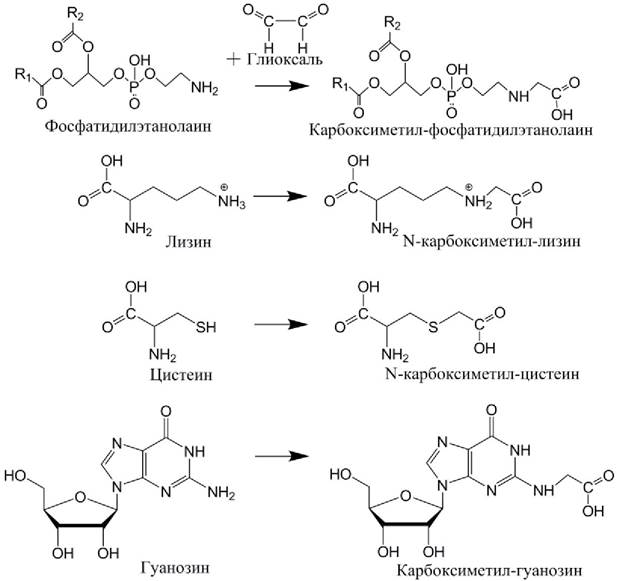
Рис. 47. Повреждения аминофосфолипидов, белков и ДНК альдегидными продуктами перекисного окисления липидов. В качестве примера показаны молекулярные аддукты (конечные продукты перекисного окисления), образующиеся при взаимодействии с диальдегидом глиоксалем. Образующиеся концевые карбоксильные группы способны вступать в дальнейшие взаимодействия, образуя поперечные сшивки между молекулами.
2.2.5. Флавоноиды как антиоксиданты
Антиоксидантные свойства флавоноидов широко известны. Многие гипотезы о влиянии флавоноидов на здоровье человека, включая положительное действие на сердечно-сосудистую систему, антиканцерогенное действие и т. д., также основаны на их антиоксидантных свойствах. Флавоноиды, наряду с другими антиоксидантами, поступающими в организм с пищей, например, витамины Е и С, являются важными компонентами антиоксидантной системы клетки. В соответствии с общепринятой точкой зрения, антиоксидантные свойства флавоноидов основаны на их способности служить ловушками для свободных радикалов, а также хелатировать ионы металлов, участвующих в перекисном окислении.
Полифенольные соединения (Фен) способны взаимодействовать с гидроксильным (L-О•)- и пероксильным (L-ОО•)-радикалами липидов (алькоксилами) благодаря их способности отдавать электрон (или атом водорода). В результате образуются радикалы фенолов - феноксилы, которые не участвуют в распространении окислительного процесса. Это связано с уникальной структурой их молекулы, в которой происходит стабилизация электронного облака:
(1) L-ОО• + Фен-ОН —> L-ООH + Фен-О•
(2) L-О• + Фен-ОН —> L-ОH + Фен-О•
Кроме того, возможно восстановление окисленных полифенолов, которое может происходить разными путями. Например, с участием аскорбиновой кислоты (Аск). В результате, образуется радикал монодигидроаскорбата (МДА•), который превращается в аскорбиновую кислоту и дегидроаскорбиновую кислоту (ДГА):
(1) 2Фен-О• + Аск —> 2Фен-ОН + 2МДА•
(2) МДА• + МДА• —> Аск + ДГА.
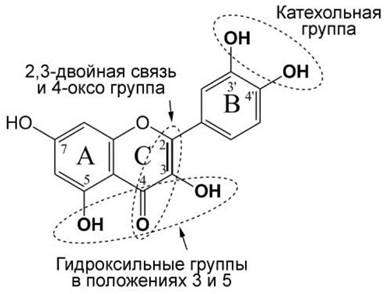
В молекулах флавоноидов имеется три области, в наибольшей степени ответственные за радикал-связывающие свойства (рис. 48): (1) - группа из двух соседних гидроксилов на В-кольце, названая катехольной группой; (2) - 2,3-двойная связь, конъюгированная с 4-оксо группой, которая предположительно способна инициировать делокализацию электронов В-кольца; (3) - гидроксильные группы в положениях 3 и 5, которые осуществляют захват радикалов.
Рис. 48. Молекула кверцетина. Указаны группы, в наибольшей степени ответственные за связывание свободных радикалов.
Предполагается, что гидроксилы катехольной группы кольца В, или гидроксильная группа в положении С-3 являются первичной мишенью для различных оксидантов. При окислении этих групп сначала образуются короткоживущие семихиноновые анион-радикалы, а затем ортохиноны. Предполагается, что указанные гидроксильные группы могут вовлекаться в единый процесс внутримолекулярных превращений (рис. 49).
Рис. 49. Возможная последовательность молекулярных превращений кверцетина, инициируемых атакой радикалов на катехольную группу кольца В.
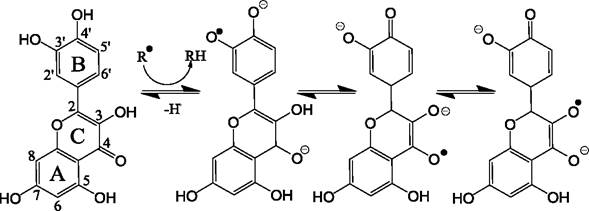
В соответствии с представленной таблицей (табл. 5), довольно большой активностью обладают кверцетин и мирицетин, поскольку они содержат практически все элементы, ответственные за способность связывать радикалы. В целом флаван-3-олы еще более активны, особенно эпигаллокатехин-галлат (ЕGCG). Необходимо отметить, что флаван-3-олы, т. е. флавоноиды, имеющие гидроксильную группу в положении 3, что важно для поддержания антирадикальной активности, приобретают дополнительную активность, если они имеют также катехольную группу. Напротив, флавоноиды, имеющие катехольную группу и двойную связь в положении 2,3, но не имеющие гидроксильной группы в положении 3, проявляют пониженную активность. Это свидетельствует о необходимости сочетания всех факторов для проявления высокой активности.
Таблица 5. Соотношение структуры и активности флавоноидов в присутствии радикала дифенлпикрилгидразина.
Флавоноиды |
3 |
5 |
7 |
3’ |
4’ |
5’ |
Флав: радикал, моль/моль |
Флавоны |
|||||||
Апигенин |
- |
ОН |
ОН |
- |
ОН |
- |
0 |
Лютеолин |
- |
ОН |
ОН |
ОН |
ОН |
- |
3,9 ± 0,4 |
Флавонолы |
|||||||
Фисетин |
ОН |
- |
ОН |
ОН |
ОН |
- |
6,1 ± 0,8 |
Кемпферол |
ОН |
ОН |
ОН |
- |
ОН |
- |
1,9 ± 0,1 |
Кверцетин |
ОН |
ОН |
ОН |
ОН |
ОН |
- |
6,6 ± 0,5 |
Мирцетин |
ОН |
ОН |
ОН |
ОН |
ОН |
О Н |
7,1 |
Флаван-3-олы |
|||||||
(-)-ЕС |
ОН |
ОН |
ОН |
ОН |
ОН |
- |
4,9 ± 0,4 |
(-)-ЕGС |
ОН |
ОН |
ОН |
ОН |
ОН |
О Н |
6,8 ± 0,6 |
(-)-ЕСG |
О-галлат |
ОН |
ОН |
ОН |
ОН |
- |
6,4 ± 0,7 |
(-)-ЕGСG |
О-галлат |
ОН |
ОН |
ОН |
ОН |
О Н |
9,3 ± 1,4 |
Примечание. ЕС - эпикатехин, EGС - эпигаллокатехин, ЕСG - эпикатехин-галлат, EGСG - эпигаллокатехин-галлат.
Немаловажным фактором для проявления антиоксидантной активности в отношении углеводородных цепей липидного бислоя является гидрофобность антиоксидантов. Так, было показано, что EGCG высоко гидрофобен и растворяется в бислое. Этот агент более гидрофобен, чем витамин Е, что объясняет его большую активность в защите липидного бислоя. Представленная выше упрощенная картина антиоксидантных свойств флавоноидов не может быть полной без более широкого анализа способности этих веществ захватывать свободные радикалы. Для сравнения способности флавоноидов служить ловушками для свободных радикалов можно использовать скорости реакций между флавоноидами и различными радикалами с использованием импульсного радиолиза. Было обнаружено, что радикал-связывающие свойства флавоноидов сильно варьируют в отношении различных агентов. Так, катехин-галлаты проявляют высокую активность только в отношении супероксид-радикала кислорода (O2•-), но не к остальным, подчас намного более активным радикалам. Напротив, малоактивные в отношении супероксид-радикала лютеолин и кемпферол проявляют наибольшую активность вотношении радикалов ОН•, N3•, t-BuO•. Еще более скромными выглядят способности кверцетина в защите процессов автоокисления во фракции мембран, полученных из мозга крысы, в сравнении с флавоноидами нарингенином и гесперетином.
Теоретические исследования показывают, что антиоксидантная активность катехинов связана со способностью гидроксилов катехольной группы образовывать водородные связи с двумя кислородами пероксидного радикала липидов, в результате чего происходит захват пероксидного радикала и образование компактного реакционного комплекса.
В настоящее время не существует общей теории, позволяющей связать структуру флавоноидов с их антиоксидантной активностью, однако можно предположить, что существует специализация флавоноидов в защите организма от различных повреждающих агентов. Неверно утверждать, что какие-то флавоноиды более эффективны, чем другие, не учитывая конкретных условий эксперимента и особенностей окислителя. Большое разнообразие флавоноидов в природе позволяет этим веществам осуществлять всестороннюю защиту организмов от множества различных угроз внешней среды.
2.2.6. Продукты окисления в клеточной сигнализации
В клетке существуют нормальные физиологические процессы продуцирования супероксид-радикала кислорода О2•- с участием NADPH- оксидаз, присутствующих во всех типах клеток. Кроме того, О2•- генерируется митохондриями, которые имеют ряд различных сайтов продуцирования супероксида. Это убихинон-связывающие сайты комплекса I (сайт IQ) и комплекса III (сайт IIIQo), глицерол-3-фосфат- дегидрогеназа, комплекс флавина I (сайт IF), электронпереносящий флавопротеин Q-оксидоредуктаза (ETFQOR) β-окисления жирных кислот, цитохром с оксидоредуктаза, комплекс цитохрома bc1, и наконец, пируват- и 2-оксиглутарат-дегидрогеназы. Возможность повреждения матрикса или ДНК митохондрий зависит от локализации этих сайтов. Все сайты имеют локализацию в матриксе, но сайты IIIQo и глицерол-3-фосфатдегидрогеназа находятся также в межмембранном пространстве, что способствует выходу супероксида в цитоплазму. Относительный вклад этих сайтов в продуцирование супероксида в значительной мере зависит от типа клеток и может изменяться в различных физиологических состояниях. Митохондриальная супероксиддисмутаза способна нейтрализовать образующийся супероксид-радикал - главный компонент митохондриальных реактивных форм кислорода (ROS), которые регулируют процессы клеточного выживания или смерти, регулируют ретроградный путь клеточной сигнализации из цитоплазмы к ядру и участвуют в развитии многих физиологических процессов (рис. 50).
Рис. 50. Локализация в клетке центров продукции и распространения супероксид-радикала и перекиси водорода. Супероксид продуцируется снаружи клетки с помощью NADPH- оксидазы, располагающейся на поверхности мембраны (1), далее дисмутирует с участием внеклеточных супероксиддисмутаз и образует Н2О2 (2), который может проникать в цитоплазму через аквапорин (3). Супероксид может проникать в клетку через анионный канал (4), где дисмутирует в Н2О2 и О2 с участием Cu- и Zn-зависимых супероксиддисмутаз Cu/ZnSOD (5). В цитоплазме пероксидоксины Prdx (6) и глутатионпероксидазы Gpx (7) быстро удаляют Н2О2. Реакции сопряжены с процессом окисления глутатиона (GSH) и тиоредоксина Trx(SH)2, в результате чего образуются дисульфиды глутатиона GSSG и тиоредоксина TrxS2. Каталаза, присутствующая в пероксисомах, также удаляет избыток Н2О2 (8). Супероксид продуцируется митохондриями путем окисления убисемихинона (9) благодаря реакции, инициируемой с участием Mn-зависимой супероксиддисмутазы MnSOD (10), в результате чего образуется Н2О2. Если на внешней поверхности внутренней мембраны митохондрии генерируется О2•-, то он будет дисмутировать при участии Cu/Zn SOD (11), что приводит к образованию Н2О2 и О2. NADPH-оксидаза, присутствующая на внешней мембране ядра или на мембранах эндоплазматического ретикулума, продуцирует О2•- (12). Подробнее об этом можно прочитать в обзоре.
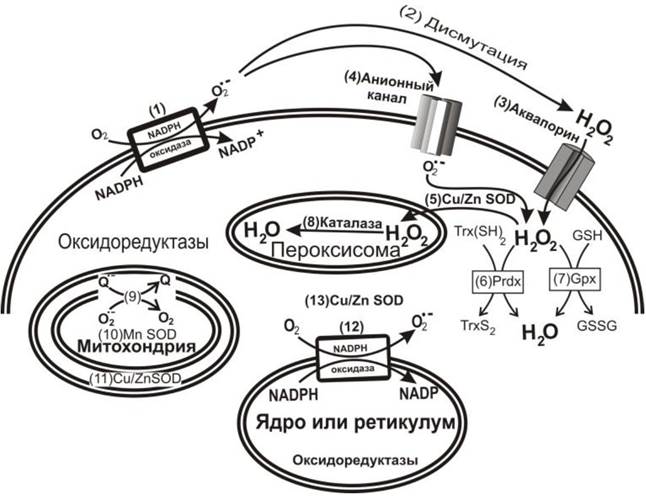
Этот механизм распространения сигналов между митохондриями, другими органеллами и клеточным окружением является мишенью многих лекарственных веществ. Попадая в клеточное окружение, супероксид может проникать в цитоплазму соседних клеток через анионный канал и участвовать в процессах сигнализации. Однако при проникновении в цитоплазму он может быстро удаляться супероксиддисмутазой, которая присутствует в высокой концентрации и обладает поразительно высокой активностью. При этом образуется перекись водорода и вода. Поэтому вопрос о действительном участии супероксид-радикала в межклеточной коммуникации остается открытым.
В отличие от супероксид-радикала, участие перекиси в качестве вторичного мессенджера хорошо известно. При этом супероксид-радикал является ее непосредственным и основным предшественником благодаря активности супероксиддисмутазы в митохондриях. Дополнительным источником перекиси водорода могут служить две NADPH-оксидазы семейства Nox/Duox, катализирующие двухэлектронное окисление кислорода в митохондриях фагоцитов, обеспечивая бактерицидное действие этих клеток. Перекись водорода может также использоваться для сигнализации клеточного роста в процессах ангиогенеза, в развитии иммунных процессов, в клеточном ответе на гипоксию и окислительную модификацию белков внеклеточного матрикса. Благодаря этому NADPH-оксидазы семейства Nox/Duox служат мишенью для терапевтического воздействия при лечении рака, воспалительных процессов, нейродегенеративных заболеваний, регуляторов роста кардиомиоцитов, клеток легочного эпителия и др.
Еще одним важным регулятором, влияющим на сигнальные пути посттрансляционной модификации, является продукт окисления полиненасыщенных жирных кислот 4-гидроксиноненал (4-hydroxynonenal, 4-HNE). Этот агент обнаруживают во всех типах ткани животных при активации процессов окислительного стресса. Предполагается, что 4-HNE может играть ключевую роль в передаче сигналов клеточного деления и клеточной адгезии.
Присутствие в тканях 4-HNE может служить причиной воспалительных, нейродегенеративных, респираторных и раковых заболеваний. В клетке уровень 4-HNE регулируется активностью глутатион-S-трансфераз (GST), которые конъюгируют глютатион-содержащие пептиды с 4-HNE, в результате чего образуются водорастворимые молекулы GS-HN, которые не способны инициировать развитие окислительного стресса.
Недавно было обнаружено, что некоторые флавоноиды также оказывают защитное действие на клетки при повышенных концентрациях 4-НNE. Так, кемпферол способен защищать клетки РС-12 от апоптоза, вызванного действием 4-НNE. Кемпферол взаимодействует непосредственно с цитоплазматической субъединицей NADPH-оксидазы (субъединица р-47рhох), благодаря чему наблюдается ингибирование повышенной активности NADPH-оксидазы, вызванной действием 4-НNE. Благодаря этому происходит терминация сигнального пути от NADPH-оксидазы к протеинкиназе с-Jun-N и далее к белкам апоптоза Вс1-2 и каспазе-3 (сигнальный путь NОХ-JNK). Предполагается, что кемпферол может служить эффективным профилактическим средством против нейродегенерации, связанной с действием NADPH-оксидазы.
Ранее, этими же исследователями было показано, что аналогичным действием могут обладать флавоноиды красного вина и процианидины какао. Примечательно, что наибольшей активностью обладал не самый известный агент красного вина ресвератрол, а флавоноиды кверцетин и мирицетин, также присутствующие в вине. Авторы объяснили способность этих флавоноидов препятствовать апоптозу клеток тем, что наблюдалась защита поли-(АДФ-рибозо)-полимеразы от ингибирующего действия 4-HNE. Что касается процианидинов какао, то их мишенью служили белки апоптоза Вс1-2 и Вс1-Х, активность которых снижалась. При этом повышалась активность каспазы-3, наблюдалась активация с-Jun-N-концевой протеинкиназы (JNK), а также митоген-активируемой протеинкиназы 4 (МКК4).
Многочисленные исследования показывают, что изофлавоны сои снижают риск развития рака молочной железы также благодаря защите от действия 4-HNE. В частности, было обнаружено, что генистеин способен влиять на экспрессию глютатион-S-трансферазы в клетках эпителия молочной железы человека, нарушенную токсическим действием продуктов перекисного окисления и, в частности, 4-HNЕ. При этом снижается возможность повреждения клеточной ДНК, наблюдающаяся в присутствии 4-HNE, что предотвращает возможность неопластического роста этих тканей и развития опухоли.