ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 2. МЕХАНИЗМЫ ДЕЙСТВИЯ ФЛАВОНОИДОВ
2.5. Влияние флавоноидов на сигнальные системы клетки
Сигнальные системы клетки участвуют в передаче химических сигналов с поверхности клетки в цитоплазму, благодаря чему клетка способна реагировать на изменения окружающей среды. Для этого клетки имеют на поверхности плазматической мембраны специализированные рецепторы, способные распознавать присутствие в среде определенных молекул, называемых внеклеточными сигнальными молекулами. Другие молекулы различной природы, называемые вторичными мессенджерами, относящиеся к белкам, пептидам, липидам, нуклеотидам, катионам металлов и др., передают этот сигнал внутрь клетки. При этом может наблюдаться «усиление сигнала», заключающееся в росте числа молекул, участвующих в процессе. В результате этого одна сигнальная молекула может вызывать множество разнообразных ответов.
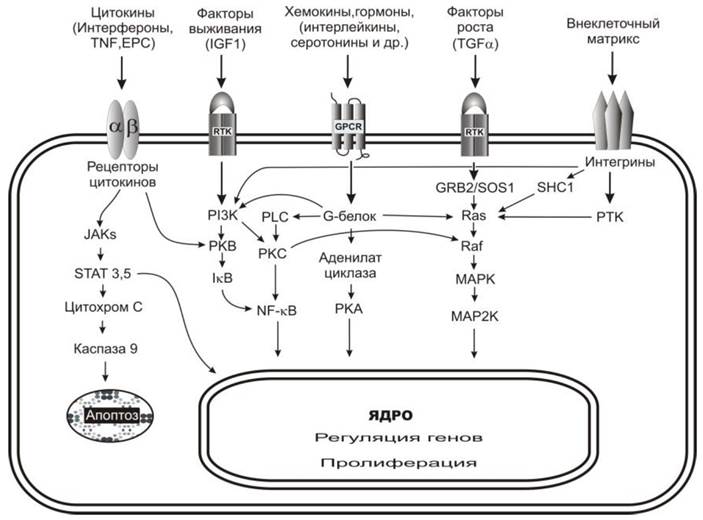
Растительные полифенольные соединения способны влиять на функционирование рецепторов цитокинов, рецепторов тирозинкиназы (RТК), рецепторов, связанных с G-белком (GРСR) и широкого класса трансмембранных белковых переносчиков сигналов, названных интегринами (рис. 71). Молекулярные механизмы этого влияния и пути распространения сигналов изучены недостаточно. В последние годы появились лишь разрозненные сведения, свидетельствующие об изменениях активности или экспрессии белков той или иной сигнальной системы в присутствии некоторых полифенолов.
Рис. 71. Упрощенная схема клеточной сигнализации, показывающая некоторые пути передачи сигнала от поверхности клетки к ядру, на которые оказывают влияние флавоноиды. Кроме движения от поверхности к ядру, сигнал может распространяться в «горизонтальном» направлении, вовлекая в процесс другие сигнальные системы. Результатом передачи сигнала может быть изменение экспрессии генов, пролиферация или гибель клеток, изменения подвижности и адгезивных свойств клеток. JAK - тирозинкиназа Януса, STAT - переносчик сигналов и активатор транскрипции, RTK - рецептор тирозинкиназы, PKB - протеинкиназа В, IkB - ингибитор ядерного фактора каппа-В, PKA - протеинкиназа А, GPCR - рецептор, связывающий G-белки, GRB2 - фактор роста, SOS1 - мембранный белок, участвующий в передаче сигналов клеточного роста и дифференцировки, Ras - белки семейства малых ГТФ-аз, Raf - протоонкоген, MAPK и MAP2K - митоген-активируемые протеинкиназы, PTK - тирозинкиназа, SHC1 - белок-регулятор апоптоза.
2.5.1. Рецепторы цитокинов
Цитокины - это небольшие молекулы, относящиеся к белкам, пептидам или гликопротеинам, участвующее в процессах коммуникации между клетками и определяющие рост, дифференцировку, функциональную активность и апоптоз клеток различных тканей. Известно более 30-ти различных цитокинов (интерлейкинов, лимфокинов, хемокинов и интерферонов), являющихся иммуномодуляторами воспалительных процессов. В тканях их концентрация может составлять 10-12 М, но при развитии воспалений, связанных с травмой или инфекцией, концентрация цитокинов может возрастать до 10-9 М. На поверхности клеток имеются специфические рецепторы цитокинов, которые начинают каскад внутриклеточных процессов сигнализации, регулирующих экспрессию определенных генов.
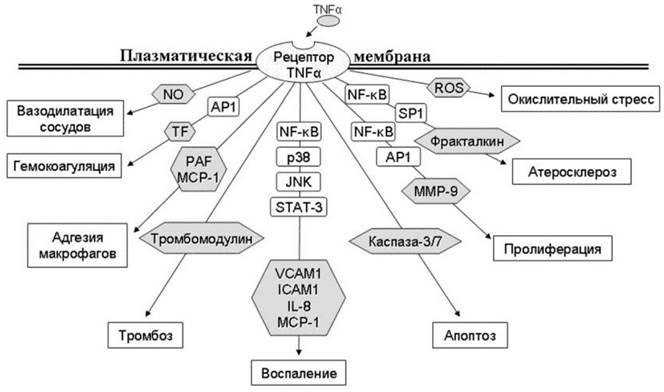
Так, например, белковый цитокин, называемый фактором некроза опухолей TNF-α, продуцируется макрофагами и некоторыми другими клетками, переносится кровью и лимфой в различные органы и служит сигналом к развитию воспаления и апоптоза. Взаимодействуя со своим рецептором на поверхности различных клеток, TNF-α может участвовать в регуляции многих процессов (рис. 72).
Рис. 72. Показано участие рецептора цитокина TNF-α в различных физиологических процессах. NO - окись азота, AP1 - белок-активатор, фактор транскпипции, TF - фактор транскрипции, PAF - фактор активации тромбоцитов, MCP-1 - белок хемотаксиса моноцитов, NF- кВ - ядерный фактор транскрипции каппа-B, p38 - митоген-активируемая протеинкиназа, JAK - тирозинкиназа Януса, STAT-3 - переносчик сигналов и активатор транскрипции, VCAM1 - васкулярный белок клеточной адгезии, ICAM1 - молекула клеточной адгезии, IL-8 - интерлейкин 8, MCP-1 - белок хемотаксиса моноцитов, MMP-9 - металлопептидаза матрикса, ROS - реактивные формы кислорода.
В настоящее время известно, что растительные полифенольные соединения могут влиять на функционирование рецепторов таких цитокинов, как фактор некроза опухолей (TNF), или рецепторов некоторых интерлейкинов (IL), что может быть использовано в терапии раковых, иммунных и других заболеваний. Так, кверцетин и нарингенин способны защищать бета-клетки поджелудочной железы от действия цитокинов, вызывающих апоптоз. Защитное действие может быть связано с активацией Akt и Bad, относящихся к сигнальному пути киназы PI3-K. Кверцетин также способен препятствовать развитию контактного дерматита благодаря блокированию высвобождения тучными клетками цитокинов воспаления IL-8 и TNF, что достигается путем повышения концентрации внутриклеточного кальция и активации NF-kB. Кверцетин подавляет продуцирование цитокинов воспаления TNF-α и IL-1β в бронхоальвеолярной жидкости экспериментальных животных. В защите клеток от ультрафиолетовой радиации действие кверцетина не сводится к простому экранированию от проникающих лучей. В значительной степени защита клеток обеспечивается благодаря подавлению продукции цитокинов воспаления, что приводит к снижению связывания ядерного фактора NF-kB с ДНК, снижению продуцирования цитокинов: IL-1β, IL-6, IL-8 и TNF-α.
EGCG - один из самых активных флавоноидов зеленого чая, обладает способностью нормализовать многие клеточные процессы благодаря нейтрализации повреждающего действия высоких концентраций цитокинов, возникающих в процессе воспаления. Так, при действии на инсулин-продуцирующие β-клетки поджелудочной железы EGCG защищал от действия IL-1β и TNF-α и восстанавливал способность клеток продуцировать инсулин под действием глюкозы. При этом снижалось содержание в цитоплазме продуктов окисления и активных форм кислорода, восстанавливался потенциал на мембранах митохондрий, прекращался выход цитохрома с из митохондрий в цитоплазму, снижалась концентрация окиси азата в цитоплазме за счет подавления экспрессии генов синтазы окиси азота под действием цитокинов. В модельных экспериментах на крысах было показано, что EGCG нормализовал уровень TNF-α и оказывал вазодилаторное действие в ответ на ацетилхолин. Наблюдалось также снижение уровня фракталкина вследствие подавления экспрессии ядерного фактора NF-kB, наблюдалось ингибирование хемоаттрактанта моноцитов MCP-1 и повышение активности белка АР-1 в клетках эндотелия сосудов.
Апигенин, лютеолин, кемпферол, кверцетин и некоторые другие флавоноиды способны снижать адгезию моноцитов на эндотелиальных клетках плаценты человека (HUVEC) благодаря нормализации уровня белка адгезии 1 и экспрессии Е-селектина, инициированных повышенным содержанием TNF-α. Фенольный экстракт из масла оливы (Olea europea L.) также оказывает положительное влияние на β-клетки поджелудочной железы благодаря снижению токсического действия цитокинов IL-1β и TNF-α. При этом снижается концентрация активных форм кислорода в цитоплазме и восстанавливается продукция инсулина. EGCG способен также влиять на функционирование Т-лимфоцитов путем подавления экспрессии рецепторов интерлейкинов IL-7 и IL-15, ответственных за гомеостаз Т-лимфоцитов. Комбинация EGCG и цитостатика метотрексата обладает антивоспалительным действием и препятствует развитию артрита благодаря подавлению экспрессии цитокинов IL-6 и TNF-α. При этом проявляется также существенное антиоксидантное действие вследствие повышения концентрации каталазы, супероксиддисмутазы и глютатионредуктазы. В исследовании защитного действия EGCG зеленого чая и ресвератрола винограда, которым богаты красные вина, было обнаружено, что снижение концентрации цитокина TNF-α сопровождается резким снижением концентрации продуктов окисления липидов, о чем можно судить по содержанию малонового диальдегида в среде. Флавоноиды, экстрагированные из полыни (Artemisia herba alba), способны оказывать положительное влияние на течение мультисистемного воспалительного заболевания (болезнь Бехчета) за счет регулирования продукции цитокинов Т-хелперными клетками Th1 и Th2. Кроме того, они препятствуют повреждающему действию окиси азота.
2.5.2. Рецепторы тирозинкиназ
Рецептор тирозинкиназ (RTK) играет существенную роль в регуляции процессов, связанных с пролиферацией или гибелью клеток.
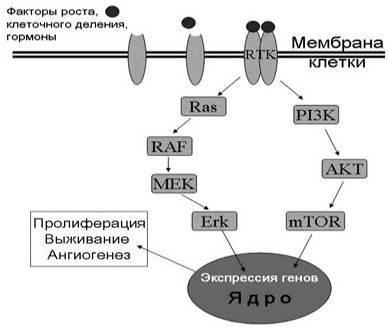
Кроме того, этот рецептор является молекулярной мишенью для многих лекарственных веществ, применяемых в лечении рака. Рецептор представляет собой трансмембранный белок, с которым взаимодействуют различные факторы роста, клеточного деления и некоторые гормоны (рис. 73). Соответственно, различают около 20 различных видов RTK. К ним относятся рецептор инсулина, рецепторы фактора роста эпидермиса, фибробластов, васкулярного эндотелия, гепатоцитов, рецептор эфрина - белка, регулирующего межклеточные взаимодействия и миграции клеток, рецептор ангиопоэтина, ответственного за ангиогенез, и др.
Рис. 73. Регуляция различных процессов через рецептор тирозинкиназы (RTK). После взаимодействия с лигандом рецептор образует димер и передает сигнал в ядро. Показано два пути передачи сигнала, через: 1). GTP-азы RAS, серин/треонин-проте- инкиназу RAF, митоген-активируемую протеинкиназу MEK и протеинкиназу Erk. 2) . Фосфатидилинозитол-3-киназу, серин/треонин-протеинкиназу AKT и рапамицин-чувствительный белок mTOR.
Полифенольные соединения зеленого чая, и в частности катехины, могут оказывать терапевтическое действие на многие типы раковых клеток, а также на развитие опухолей животных в модельных экспериментах, благодаря подавлению сигналов RTK. Находясь в плазматической мембране, этот рецептор чувствителен к изменению физических свойств липидов, на которые могут влиять флавоноиды. Среди них катехины чая, возможно, являются одними из наиболее эффективных антиканцерогенных агентов среди растительных полифенолов. Одно из возможных объяснений их активности предполагает, что флавоноиды являются миметиками адениновой части молекулы АТФ и способны блокировать АТФ-связывающие сайты рецепторов протеинкиназ. Кроме того, обращает внимание их способность влиять на латеральную сегрегацию липидов плазматической мембраны и образование липидных рафтов, что нарушает функционирование мембранных рецепторов, таких как RTK или рецептор фактора роста эпителия EGFR. Так, флавоноид EGCG препятствует связыванию фактора роста эпителия с соответствующим рецептором и ингибирует функционирование других RTK, что определяет антиканцерогенное действие этих полифенолов. Аналогичное действие на RTK, вероятно, оказывает также флавоноид силибинин.
EGCG зеленого чая оказывает влияние и на другие компоненты сигнальной цепи RTK, находящиеся в цитоплазме, включая сигнальный путь митоген-активируемой протеинкиназы MAPK. EGCG блокирует ДНК- связывающую активность NF-kB, накопление в цитоплазме ряда интерлейкинов, экспрессию провоспалительных генов, индуцируемых присутствием липополисахаридов бактериальных клеток. Причем, именно фосфорилирование белков сигнальной системы МАРК, включая белки МЕК, Raf и др., лежит в основе ингибирующего действия катехинов чая. Фосфорилирование подавляется вследствие блокирования действия инсулиноподобных факторов роста IGF-I и IGF-II. На сигнальную систему МАРК действуют и другие полифенолы, например, кверцетин, ресвератрол, ферруловая, ванильная и танниновая кислоты.
2.5.3. Интегрины
Интегрины - поверхностные клеточные рецепторы, передающие в цитоплазму сигналы об изменениях химического состава матрикса, окружающего клетки. Интегрины присутствуют на поверхности клеток большинства многоклеточных организмов, от губок до млекопитающих, и обычно состоят из двух субъединиц α и β, которые образуют 24 различные димерные молекулы. Каждая субъединица имеет трансмембранный сегмент, экстраклеточный и цитоплазматический домены. Интегрины могут служить для прикрепления патогенных агентов к поверхности клеток, например, вирусов, они участвуют в инвазии бактерий. Большое значение интегрины имеют в регуляции межклеточного взаимодействия, адгезии клеток и их миграции. Интегрины принимают участие в различных заболеваниях, включая развитие опухолей и процессы метастазирования. Соответственно, интегрины служат мишенями для терапевтического воздействия различных лекарственных веществ.
Обнаружено, что катехины зеленого чая, и прежде всего, наиболее активный из них EGCG, способны снижать подвижность и адгезивные свойства макрофагов крови - моноцитов, играющих важную роль в развитии иммунного ответа и развитии процессов воспаления. Это связано со способностью EGCG ингибировать активность интегрина β1, что позволяет рассматривать этот флавоноид как перспективное противовоспалительное средство. Кверцетин и катехины способны влиять на экспрессию циклооксигеназы COX-2, а также интегрина β2 благодаря чему снижается провоспалительный ответ моноцитов. EGCG способен влиять на адгезивные свойства и миграцию мастоцитов (тучных клеток) и их способность активировать моноциты благодаря снижению экспрессии интегринов α5β3, что существенно в регуляции роста и метастазирования опухолей. EGCG может ингибировать миграцию и способность к адгезии B-лимфоцитов, также принимающих участие в развитии иммунного ответа путем блокирования экспрессии интегрина CD11b. EGCG способен также подавлять экспрессию рецептора фактора роста эпидермиса благодаря действию на интегрин α5β1, что имеет большое значение в развитии карциномы человека. Имеются также данные о влиянии EGCG на подвижность и миграцию фибробластов благодаря подавлению экспрессии интегрина α2β1, что может иметь значение в противоопухолевой активности этого катехина.
Другие флавоноиды также могут оказывать влияние на экспрессию интегринов, что препятствовует росту и метастазированию опухолей. Так, апигенин, присутствующий во многих лекарственных травах (ромашка, фиалка, адонис, мелисса и др.) может блокировать интегрин р5 в клетках рака молочной железы. Кемпферол, флавоноид из тмина, чая, калины и др., подавляет TNF-α-индуцируемую экспрессию интегрина β2 эозинофилов, что препятствует их инфильтрации в дыхательный эпителий у мышей с аллергической астмой. Глабридин, флавоноид из солодки (лакрицы), подавляет экспрессию интегрина αnuβ3, что наряду с подавлением активности некоторых других компонентов сигнальной системы (FAC/Src, Akt, RhoA) препятствует миграции, инвазии и ангиогенезу клеток опухоли легких.
2.5.4. Пероксисомы и PPAR
Полиненасыщенные жирные кислоты, а также продукты их окисления простагландины и лейкотриены, образующиеся с участием липооксигеназ, могут участвовать в регуляции экспрессии генов. Один из наиболее изученных путей такой регуляции начинается со взаимодействия этих веществ с рецепторами, активирующими пролиферацию пероксисом (PPAR - Peroxisome proliferator-activated receptors), находящимися в ядре. Эти рецепторы способны функционировать в качестве факторов транскрипции и участвовать в развитии и дифференцировке клеток, оказывая влияние на метаболизм белков, липидов, углеводородов (рис. 74).
Рис. 74. Регуляция генов жирными кислотами, простагландинами и лейкотриенами через рецептор PPAR. Растворенные в крови жирные кислоты проникают в клетку и связывются с PPAR (Peroxosome proliferator-activated receptor), находящимся в ядре. C PRAR взаимодействуют также продукты ферментативного окисления липидов с участием липооксигеназы (LOX) или циклооксигеназы (COX). После активации PPAR соответствующим цитокином образуется гетеродимер PPAR/RXR (Retinoid X receptor), который связывается с HRE- последовательностью ДНК (Hormone response element), благодаря чему осуществляется транскрипция определенных генов.
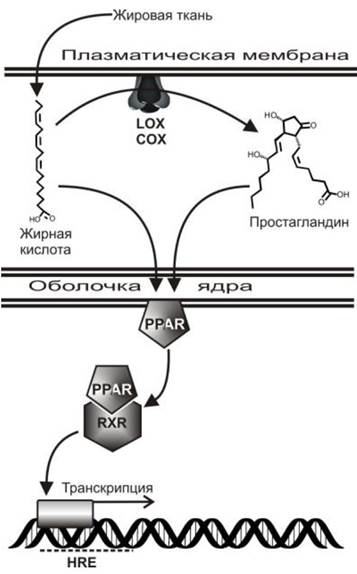
Рецептор, после связывания молекулы жирной кислоты с участием рецептора PPAR-α или простагландина с участием PPAR-β, образует гетеродимер с RXR (Retinoid X receptor), после чего взаимодействует со специфической последовательностью ДНК, отвечающей за гормональную регуляцию (HRE - hormone response element). HRE является промотором генов, связывающим рецепторы определенных гормонов и им подобных регуляторов, с экспрессией соответствующих генов.
Было обнаружено, что изофлавоны являются агонистами PPAR. Благодаря этому они проявляют противовоспалительную активность, предотвращают развитие метаболического синдрома, атеросклероза и других заболеваний, связанных с воспалительными процессами. Способность активировать PPAR была показана в исследовании суммарной метанольной фракции изофлавонов семян сои, которые содержали даидзин, даидзеин, глицитин, генистин, малонилдаидзин, малонилглицитин, генистеин. Указанная фракция способствовала повышению транскрипции PPAR. При этом в экспериментах in vitro активность флавоноидов в отношении PPAR была выше активности лекарственного препарата безафибрата, используемого в лечении метаболического синдрома. Спиртовой экстракт изофлавонов из растения Pterocarpus marsupium, используемого в народной медицине Индии для лечения диабета, также проявлял активность в отношении PPAR. Одна из фракций этого экстракта снижала уровень глюкозы в крови сопоставимо с инсулином или антидиабетическим лекарственным препаратом розиглитазоном, селективным агонистом PPAR. Ранее в экспериментах на мышах было показано, что изофла- воны сои также проявляют антидиабетическое действие, благодаря активации рецепторов PPAR. Действие изофлавонов, например, генистеина, на рецепторы PPAR может оказывать благоприятное влияние в лечении болезни Альцгеймера. При этом противовоспалительный эффект генистеина был сравним с действием эстрадиола. Защитный эффект байкалеина на нервные клетки в условиях ишемии и реперфузии объясняется подавлением экспрессии белка PPAR этим флавоном. Активация экспрессии PAAR наблюдается также при действии экстрактов флавоноидов из корней софоры (Sophora flavescens), или из цветов бузины черной (Sambucus nigra), которые обладают противовоспалительным и антидиабетическим действием.
Однако не все флавоноиды, эффективные против ожирения и инсулинорезистентности, способны действовать через сигнальную систему PPAR. Например, кверцетин способен повышать секрецию адипонектина, не оказывая влияния на PPAR. Однако в другом исследовании на клетках рака легких было показано, что кверцетин подавляет деление клеток благодаря действию на сигнальную систему PPAR.
Нарингенин из винограда также способен активировать PPAR. Благодаря этому нарушается сборка частиц вируса гепатита С. В экспериментах на клеточных культурах действие нарингенина было сравнимо с действием интерферона.
2.5.5. Ядерный фактор NF-kB и медиаторы воспаления
Воспаление является основным механизмом восстановления тканей после повреждения или стресса, инициированного патогенами. Этот механизм включает каскад клеточных реакций на присутствие внешних или внутренних агентов, которые распознаются организмом хозяина как «чужие». Каскад воспалительных процессов включает повышение проницаемости капилляров, миграцию клеток иммунной системы в область повреждения, высвобождение медиаторов воспаления, клеточный апоптоз, удаление погибших в результате апоптоза клеток посредством фагоцитоза, и наконец, рост новой ткани и кровеносных сосудов.
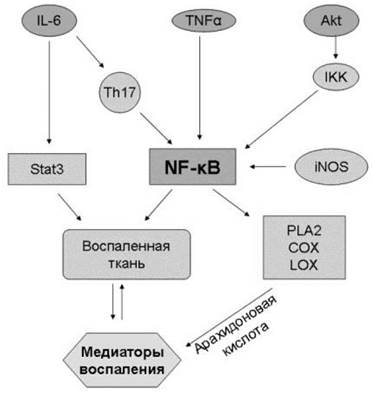
Существует несколько различных сигнальных путей, участвующих в развитии воспалительных процессов. При этом, центральное место в их регуляции занимает молекула ядерного фактора NF-кВ. Этот путь начинается от провоспалительных цитокинов, например, таких как фактор некроза опухолей ТNF-α и интерлейкин 6 (IL6), проходит через NF-кВ и ведет далее по сигнальному пути арахидоновой кислоты (рис. 75). Таким образом, NF-кВ становится важной мишенью для антивоспалительных лекарственных веществ.
Рис. 75. Сигнальный путь ядерного фактора транскрипции NF-kB - белкового комплекса, регулирующего развитие воспалительных процессов путем высвобождения эйкозаноидов. TNF-α-фактор некроза опухолей α; IL-6 - интерлейкин 6; Akt - фосфатидил-инозитол-3-киназа; Stat 3 -трансдуктор и активатор транскрипции; IKK - ингибитор каппа-В-киназы; iNOS - индуцируемая форма синтазы оксида азота; PLA2 - фосфолипаза А2; COX - циклооксигеназа; LOX - липоксигеназа.
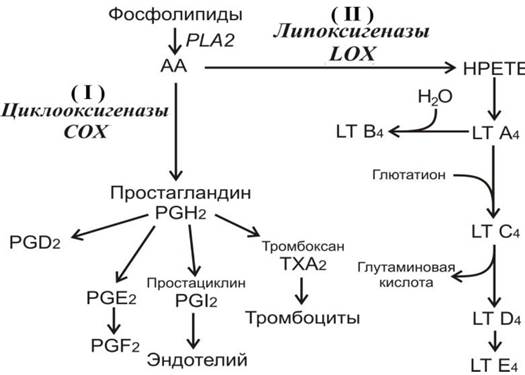
Далее следует путь арахидоновой кислоты, который подлежит регуляции со стороны провоспалительных цитокинов, таких как Akt, TNF-α и IL-6. Арахидоновая кислота (АА) является липидным медиатором, образующимся в результате действия фосфолипазы А2 на мембранные липиды. В дальнейшем АА подвергается окислению ферментами циклооксигеназой и липоксигеназой, в результате чего образуются вещества, принадлежащие к группе эйкозаноидов, которые являются медиаторами воспаления (рис. 76).
Рис. 76. Пути биосинтеза эйкозаноидов из арахидоновой кислоты (АА), которая отщепляется от молекул фосфолипидов под действием фосфолипазы А2 (РLA2). На схеме показано наличие двух путей синтеза эйкозаноидов: (I) - с участием циклооксигеназ (СОХ) образуются простагландины (РG) и тромбоксаны (ТХ); (II) - с участием липоксигеназ (LОХ) образуеся НРЕТЕ - гидроперокси-эйкозотетраеновая кислота, а затем лейкотриены (LТ).
Эйкозаноиды являются сигнальными молекулами, образующимися в процессе ферментативного окисления полиненасыщенных незаменимых жирных кислот с длиной углеводородной цепи С20, принадлежащих к омега-3 (ω-3) и омега-6 (ω-6)-группам. К числу жирных кислот, являющихся предшественниками эйкозаноидов, относятся эйкозапентановая кислота (EPA) - ω-3 кислота, имеющая пять двойных связей; арахидоновая кислота (АА) - ω-6 кислота с четырьмя двойными связями, и дигомо-гамма-
линоленовая кислота - ω-6-кислота с тремя двойными связями. Эйкозаноиды, принадлежащие к группе ω-6, являются более активными инициаторами воспаления, чем ω-3. Существуют четыре группы эйкозаноидов: простагландины, простациклины, тромбоксаны и лейкотриены. Эти группы, в свою очередь, подразделяются на две или три подгруппы, происходящие от ω-3 или ω-6 жирных кислот.
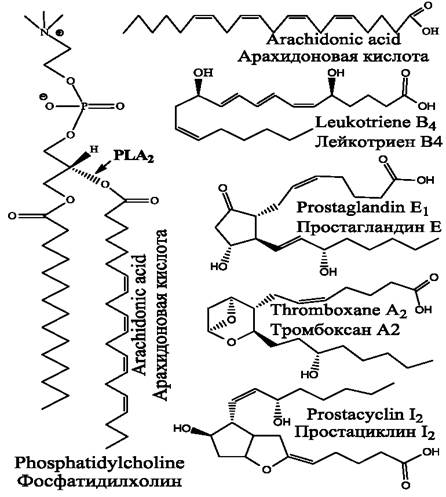
Синтез эйкозаноидов активируется под действием различных стимулов, к числу которых следует отнести механические травмы, действие цитокинов и некоторых гормонов. При этом активируется фосфолипаза А2, способная отщеплять жирные кислоты от молекул фосфолипидов клеточных мембран (рис. 77).
Рис. 77. Примеры эйкозаноидов. Показана молекула фосфатидилхолина, содержащая остаток арахидоновой кислоты, которую отщепляет фосфолипаза А2 (РLA2). Свободная арахидоновая кислота окисляется соответствующими оксидазами, в результате чего образуются лейкотриены, простагландины, тромбоксаны и простациклины.
Среди растительных полифенолов имеется большое число веществ, способных ингибировать активность фосфолипазы А2, а также ферментов LОХ и СОХ, участвующих в синтезе эйкозаноидов. Некоторые полифенольные ингибиторы СОХ-1 действуют при концентрациях менее 1мкМ и могут быть более эффективны, чем ацетилсалициловая кислота (аспирин), мишенью которой также является СОХ-1, поскольку суточные дозы ее потребления составляют от десятков миллиграммов до нескольких граммов, при том что это лекарство обладает нежелательными побочными эффектами.
Таблица 10. Некоторые примеры полифенольных (большей частью флавоноидных) ингибиторов ферментов сигнальной цепи арахидоновой кислоты.
Фосфолипаза А2 |
IC50 |
Циклооксигеназа 2 |
IC50 |
12-липоксигеназа |
IC50 |
Kampferol |
7,50 |
Gambogenic acid |
13,60 |
Anadanthoflavone |
13,00 |
Morelloflavone |
0,60 |
Genistein |
15,00 |
Artonin E |
2,30 |
Quercertin |
6,50 |
Glycitein |
2,50 |
Baicalein |
0,64 |
Циклооксигеназа 1 |
Tectorigenin |
3,00 |
Cirsiliol |
1,00 |
|
Artonin E |
2,50 |
Ohenethyl ferulate |
4,35 |
Fisetin |
0,25 |
Chrysin |
5,00 |
Rosmarol |
2,50 |
5-липоксигеназа |
|
Isoliquiritigenin |
8,00 |
Baicalein |
1,00 |
Artonin E |
0,36 |
Kurarinone |
0,60 |
Resveratrol |
50,00 |
Cirsiliol |
0,10 |
Kuraridin |
0,60 |
Ginkgetin |
0,33 |
||
Morusin |
1,60 |
Kenusanone A |
0,50 |
||
Quercetin |
8,00 |
15-липоксигеназа |
Luteolin |
0,10 |
|
Sophoraflavanone G |
0,10 |
Apigenin |
4,00 |
Quercertin |
0,30 |
Sophoraflavanone A |
5,00 |
Baicalein |
1,60 |
Gingerol |
0,00 |
Catechin |
0,11 |
Fisetin |
1,50 |
Ginkgetin |
0,33 |
Baicalein |
0,67 |
Luteolin |
0,60 |
Baicalein |
7,00 |
Resveratrol |
15,00 |
Mousin |
3,30 |
Resveratrol |
1,37 |
Примечание. Представлены наиболее эффективные ингибиторы. Концентрации полифенолов, достаточные для ингибирования указанных ферментов на 50 % (IС50), представлены в мкМ. Более подробные сведения можно найти в работе.
Кроме того, как следует из представленной таблицы (табл. 10), растения содержат также большое число высокоэффективных ингибиторов сигналов воспаления, действующих на различные мишени, эффективность которых еще предстоит исследовать. Так, эффективность наиболее изученных флавоноидов, например кверцетина, в подавлении аллергических процессов представляется довольно скромной в сравнении с активностью ресвератрола и, особенно, байкалеина, способных действовать одновременно на COX- и LOX-зависимые сигнальные пути.
2.5.6. Рецепторы, сопряженные с G-белком
Эйкозаноиды действуют на рецепторы, сопряженные с G-белком (GPCRs, G-protein coupled receptors), известные также как семиспиральные трансмембранные рецепторы, участвующие в передаче сигнала через мембрану эукариотических клеток, включая клетки млекопитающих и человека, с поверхности в цитоплазму. Лиганды, связывающиеся с этими рецепторами, чрезвычайно разнообразны: молекулы пахучих веществ, гормоны, нейромедиаторы, и даже кванты света в рецепторах зрения. Эти рецепторы участвуют в таких сигнальных путях, как циклоаденозин-монофосфатный и глутаматный. Однако наибольшее количество белков принадлежит к родопсиноподобным рецепторам. В сумме эти рецепторы кодируются примерно 800-ми генов, составляют 4 % генома человека или около 10 % мембранных белков. Белки семейства GPCR являются важными мишенями для терапевтического воздействия в лечении таких заболеваний, как рак, воспалительные процессы, заболевания иммунной, нервной, сердечнососудистой и выделительной систем. Эти белки служат мишенями более чем 40 % лекарственных препаратов.
Количество и соотношение этих групп эйкозаноидов имеет непосредственное отношение к развитию различных заболеваний, таких как ревматоидный артрит, аллергии, астма и рак. Так, ревматоидный артрит связан с инфильтрацией клеток иммунной системы (таких как лимфоциты, нейтрофилы, макрофаги) в синовиальную жидкость суставов, где эти клетки высвобождают медиаторы воспаления, в результате чего происходит разрушение хряща. В этих процессах доминирующую роль играют Т-хелперные клетки первого типа (Th1), индукция которых осуществляется провоспалительными цитокинами TNF-α, IL-1, IL-6, IL-17. Напротив, Т-хелперные клетки второго типа (Th2), индуцируемые цитокинами IL-4 и IL-13, участвуют в развитии аллергии и астмы. Соответственно, соотношение количества Th1/Th2 имеет большое значение в определении характера иммунного ответа.
Одним из наиболее перспективных путей в лечении иммунных заболеваний является контроль содержания цитокина IL-23, который является ключевым в развитии иммунного ответа. Было показано, что IL-23 участвует в активации Т-хелперов 17-го типа (Th-17). В этих процессах также участвует ряд других интерлейкинов, а также TNF-α. Использование антител к этим интерлейкинам, и прежде всего, к IL-23, позволяет успешно лечить некоторые виды аллергических заболеваний, например, псориатический артрит. Кроме того, в снижении иммунной реакции большое значение имеет использование ингибиторов активности фосфолипазы А2, в результате чего снижается концентрация свободной арахидоновой кислоты.
Белок NF-кВ играет существенную роль на завершающих стадиях воспалительных процессов, поскольку способствует экспрессии антивоспалительных генов и регулирует апоптоз лейкоцитов. Этот белок, присутствующий в клетках всех тканей, способен взаимодействовать с молекулой ДНК и является наиболее универсальным фактором, регулирующим транскрипцию. Его активация является первым «быстрым» ответом клетки на повреждающее воздействие. Индукторами активности NF-кВ являются активные формы кислорода, окись азота, ионизирующая радиация, ТNF-α, некоторые интерлейкины, липополисахариды бактериальных стенок и многие другие токсические агенты. Подавление активности NF-кВ может быть эффективным путем в лечении многих иммунных заболеваний. Кроме того, блокирование сигнальных путей на определенных стадиях может иметь существенное значение в лечении болезней. Так, подавление продукции простагландинов, тромбоксанов и лейкотриенов может оказывать благотворное влияние на купирование болевых проявлений остеоартрита. Контролирование продукции простаноидов (простагландинов и тромбоксанов) или блокирование рецепторов к этим агентам имеет большое значение в лечении различных аллергических и иммунных заболеваний, включая различные виды дерматитов, астмы, ревматоидного артрита, энцефаломиелита, рассеянного склероза.
2.5.7. Адипокины и метаболический синдром
Метаболический синдром включает набор нарушений, повышающих риск сердечно-сосудистых заболеваний и сахарного диабета второго типа. Наиболее очевидным признаком метаболического синдрома является накопление жира в области живота и увеличение размеров талии. Кроме того, нарушается метаболизм глюкозы и жиров, повышается кровяное давление. Хотя в настоящее время представления о причинах и механизмах возникновения метаболического синдрома весьма противоречивы, большинство исследователей полагают, что отложения жира на внутренних органах, особенно отложения жира в печени, могут быть причиной нарушения инсулин-зависимой регуляторной системы, которая является движущей силой всех последующих нарушений метаболизма. Таким образом, нарушение регуляции метаболизма сахаров, связанное с повышением устойчивости к инсулину, называемое преддиабетическим синдромом, непосредственно следует за метаболическим синдромом и является фактором риска возникновения сердечно-сосудистых заболеваний. Их развитие начинается с разрушения клеток эндотелия и приводит к нарушениям всей артериальной системы, сопровождающееся эрозией и тромбозами. Это связано с активацией лейкоцитов, вызывающих окислительный стресс, а также с активацией экспрессии металлопротеаз, разрушающих белки внеклеточного матрикса коллаген, фибронектин и ламинин. Наблюдается также развитие воспалительных процессов, аллергических реакций и разрушение тканей, связанное с активацией иммунных клеток соединительной ткани мастоцитов, что приводит к высвобождению в кровь гистамина, цитокинов, хемокинов и протеаз (химаз и триптаз). Метаболический синдром может быть причиной не только сердечно-сосудистых заболеваний, но также и большого числа других дисфункций, связанных с процессами воспаления, накопления в тканях активных форм кислорода и аллергических реакций. Так, повышается риск неврологических нарушений, включая инсульт, болезнь Альцгеймера, депрессии, сексуальные дисфункции. Возможно развитие простатита, нефрологических дисфункций и парадонтозов.
Для более полного понимания развития метаболического синдрома необходимо рассмотреть анатомические и физиологические особенности жировой ткани. Жировая ткань является рыхлой соединительной тканью, содержащей адипоциты, в цитоплазме которых присутствуют жировые капли. Кроме того, жировая ткань содержит фибробласты, макрофаги и клетки эндотелия. Она также пронизана мелкими кровеносными сосудами. У человека жировая ткань располагается в виде жировых отложений под кожей (подкожный жир), вокруг внутренних органов (висцеральный жир), в мышечной ткани (внутримышечный жир), в костном мозге, в тканях молочной железы. Биохимический состав и физио - логические особенности, а также локализация жировой ткани в различных органах различаются.
У молодых женщин жир откладывается в области ягодиц и бедер, что определяется гормонами. При достижении менопаузы и снижении уровня эстрогенов жир мигрирует в область талии и откладывается преимущественно в животе. Аналогичное расположение жира в области живота характерно и для мужчин. Жир в области живота (абдоминальный жир) может располагаться поверхностно, но обычно большая его часть находится в виде отложений на внутренних органах (брыжеечная, околопочечная, околопеченочная жировая ткань). Абдоминальное ожирение коррелирует с сердечно-сосудистыми заболеваниями, диабетом второго типа, инсулинорезистентностью, определенными видами рака и артритов. Непосредственно под поверхностью кожи также находятся значительные отложения жира. Считается, что подкожный жир в меньшей степени, чем висцеральный, может служить причиной сердечно-сосудистых заболеваний и, предположительно, может даже оказывать защитное действие на организм.
Адипоциты призваны поддерживать в крови необходимую концентрацию свободных жирных кислот и триглицеридов, а также регулировать инсулинорезистентность. Абдоминальный жир способен повышать инсулинорезистентность и развивать гипертонию. Накопление абдоминального жира увеличивается при стрессе и может служить причиной гормональных сдвигов, приводящих к нарушению здоровья. Это связано с тем, что жировая ткань является одним из важнейших органов эндокринной системы. В жировой ткани продуцируются цитокины, называемые адипокинами, которые участвуют в поддержании гомеостаза глюкозы, в регуляции процессов воспаления и иммунных реакций, свертывании крови, метаболизме липидов, ангиогенезе, канцерогенезе и многих других процессах.
Таблица 11. Адипокины и их влияние на метаболические процессы.
Адипокин |
Процессы |
Заболевания и факторы риска |
Адипонектин |
Повышает чувствительность к инсулину, антиатерогенный эффект |
Сахарный диабет второго типа, ишемическая болезнь сердца |
Апелин |
Гипотензивный эффект, стимуляция сердечных сокращений, подавление секреции вазопрессина, повышение резистентности к инсулину |
Заболевания сердечно-сосудистой системы, сахарный диабет второго типа типа и ожирение |
Висфатин |
Созревание B-лимфоцитов, апоптоз нейтрофилов, ускорение пролиферации нормальных клеток, предотвращение апоптоза раковых клеток, гипергликемический эффект |
Диабет второго типа, ревматоидный артрит, заболевания сердечно-сосудистой системы, онкогенез, воспаление и иммунитет, болезнь Альцгеймера |
Ингибиторактиватора Плазминогена(PAI-1) |
Уменьшение фибринолиза, ингибирование активности металлопротеаз матрикса |
Ишемическая болезнь сердца, геморрагический диатез, рак, метаболический синдром, фиброз |
Интерлейкин (IL-6) |
Воспаление, иммунный ответ, дифференцировка клеток |
Онкологические заболевания, кардиоваскулярные заболевания, диабет |
Лептин |
Подавление аппетита, снижение активности щитовидной, поджелудочной, половых желез |
Анорексия, геморрагический васкулит, тромбоз сосудов, ожирение, рак |
Фактор некроза опухоли (TNF-α) |
Подавление развития некоторых опухолей, апоптоз клеток, системные воспаления, регуляция иммунного ответа |
Инфекционные заболевания, лечение рака, ревматоидный артрит, системная волчанка |
Резистин (ADSF) |
Воспалительные процессы, энергетический гомеостаз, функция эндокринной системы, резистентность к инсулину |
Ожирение, сахарный диабет второго типа, сердечно-сосудистые заболевания |
К настоящему времени обнаружено более 600 адипокинов, являющихся белковыми биомаркерами метаболического синдрома, которые оказывают различное влияние на организм, хотя функции лишь немногих адипокинов подробно изучены. Было обнаружено, что нарушения секреции адипокинов, наблюдающиеся при ожирении, могут вызывать различные заболевания (табл. 11).
В целом, ожирение связано с избыточным потреблением калорийной пищи и недостаточным расходованием энергии. Большой вклад в развитие ожирения вносят генетические и гормональные факторы. Снижение потребления пищи не всегда эффективно против ожирения, если расход энергии низок и организм стремится сохранить массу тела. Поэтому для похудения могут использоваться различные лекарственные препараты. Растительные полифенольные соединения также могут быть эффективны в борьбе с ожирением и в профилактике развития различных заболеваний, связанных с ожирением. Исследования показывают, что механизм их действия может различаться.
Так, исследование действия кверцетина и ресвератрола на секрецию адипокинов у животных показало, что эти флавоноиды способны снижать секрецию висфатина, но ни один из указанных флавоноидов не оказывал влияния на секрецию лептина и адипонектина. Кверцетин и ресвератрол в ряду из более 20-ти исследованных флавоноидов оказались наиболее эффективными в нормализации уровня TNFα в крови, что приводило также к нормализации уровня факторов воспаления: некоторых интерлейкинов, хемоаттрактанта моноцитов (MPC-1), киназы c-Jun-NH (2), РРАР-y и др., регулируемых TNF-α. Таким образом, кверцетин и ресвератрол являются мощными ингибиторами процессов воспаления, связанных с ожирением. Исследования рутина на организм крыс показали, что этот флавоноид способен возвращать к норме течение многих хронических процессов, связанных с метаболическим синдромом, таких как толерантность к глюкозе, нарушения функций печени и сосудистой системы, окислительный стресс и воспаление. Экстракт шелухи лука, богатый кверцетином и его производными, также может использоваться в лечении метаболического синдрома. Примечательно, что экстракт шелухи лука оказывал более эффективное действие на организм животных, чем очищенный препарат кверцетина.
Иной механизм влияния на метаболический синдром был обнаружен в исследованиях действия нарингина у мышей, находящихся на высококалорийной диете. Было показано, что нарингин способен активировать АМФ-зависимую протеинкиназу (AMPK-α) посредством инициации фосфорилирования этого белка, что приводило к снижению инсулинорезистентности и подавлению окислительного стресса. Наряду с нарингином (или его агликоном нарингенином), способность снижать уровень глюкозы в крови была обнаружена в исследованиях даидзеина (dаidzein).
В профилактике метаболического синдрома, генистеин (genistein) оказался эффективным в предотвращении развития неалкогольного стеатогепатита. Известно, что метаболический синдром сопровождается накоплением триглицеридов в печени, что приводит к активации свободно-радикального окисления, стимуляции воспалительных процессов, фиброзообразованию вплоть до цирроза печени и гепатоцеллюлярной карциномы. Под действием генистеина в тканях печени и плазме крови наблюдалось снижение концентрации TNF- α и IL-6, ингибирование фосфорилирования IкВ-α и активация киназы JNК. Возможно, что главной мишенью генистеина является мембрана митохондрий адипоцитов, нарушение которой приводит к снижению уровня АТФ в клетке. Нарушение метаболической активности митохондрий наблюдается также при действии ресвератрола. В результате этого, происходит подавление роста и дифференцировки адипоцитов, снижение массы жировой ткани и снижение концентрации адипокинов в тканях. При этом снижается уровень глюкозы в крови. Нарушение дифференциации адипоцитов наблюдалось также при действии даидзеина, хотя механизмы действия этих флавоноидов несколько различаются.
Катехин зеленого чая ЕGCG обладает выраженным действием против ожирения. Этот флавоноид подавляет адипогенез путем приостановки клеточного деления адипоцитов. Наблюдается ингибирование экспрессии генов, ответственных за превращение фибробластов в адипоциты: С/ЕРВ-α и РРАR-y. При этом усвоение липидов пищи снижается и растет содержание липида в фекалиях. В митохондриях скелетных мышц экспрессируются гены, ответственных за окисление жирных кислот, т. е. активируются процессы «сжигания» жиров организмом, хотя по данным других исследователей эффект окисления жиров, скорее, можно отнести к действию кофеина, а не ЕGCG. Полифенолы зеленого чая могут быть эффективны в нормализации уровня глюкозы, триглицеридов и холестерина в крови. Они снижают содержание в плазме продуктов перекисного окисления липидов, повышают антиоксидантный статус плазмы: увеличивают концентрации супероксид- дисмутазы и других ферментов антиоксидантной системы.
Большое количество работ посвящено исследованию участия полифенольных соединений винограда и продуктов виноделия в профилактике метаболического синдрома. Так, было обнаружено, что проантоцианидины виноградных косточек снижают концентрацию маркеров воспаления у животных, находящихся на диете, богатой жирами и углеводами. Снижается уровень ТNF-α, IL-6, маркеров макрофагов, повышается экспрессия адипонектина. При этом наблюдается снижение процессов липогенеза в печени, экспрессируется ряд генов, участвующих в гликогенезе, гликолизе и липидном обмене в печени.
Экстракты полифенолов, которыми особенно богата кожура красных сортов винограда, также могут оказывать влияние на метаболизм липидов у человека и животных, находящихся на диете, богатой жирами и сахарами. Наблюдается снижение содержания триглицеридов в мышцах, повышается экспрессия инсулин-зависимого транспортера глюкозы GLUT4, что снижает инсулинорезистентность и концентрацию глюкозы в крови, экспрессируются ферменты окисления жиров в митохондриях, например, экспрессируется ген митохондриальной гидроксиацил-СоА-дегидрогеназы. Снижается транспорт жирных кислот и накопление жиров в мышцах.
Таблица 12. Влияние растительных полифенолов и полифенол-содержащих растительных продуктов на метаболический синдром.
Полифенолы или их источник |
Механизм действия |
|
Яблочый сок (неосветленный) |
Снижение веса тела испытуемых после 4 недель приема по 750 мл/день. Осветленный сок не обладает этим действием. |
|
Флавоноиды цитрусовых |
Подавление экспрессии генов стеарил-КоА- десатуразы-1, снижение содержания липидов и сахара в крови (регуляция через PPAR-α и PGC1- а). Возможно применение для профилактики атеросклероза |
|
Мандариновый сок |
Защита от окислительного стресса |
|
Полифенолы корицы |
Экспрессия белков семейства ТТР, оказывающих противовоспалительный эфект |
|
Полифенолы кожуры граната |
Стимуляция роста бифидобактерий в кишечнике, снижение уровеня холестерина в крови |
|
Антоцианины черного риса |
Снижение агрегации тромбоцитов, снижение концентрации триглицеридов в крови, снижение веса тела |
|
Масло семян рапса |
Экспрессия белков антиоксидантной системы, профилактика атеросклероза |
|
Флавоноиды плаунка (Selaginella tamariscina) |
Антидиабетическая активность: снижение уровня глюкозы в крови, триглицеридов, холестерина, жирных кислот. Экспрессия белков антиоксидантной системы |
|
Экстракт батата (Ipomoea batatas) |
Снижение секреции лептина, подавление эспрессии факторов воспаления и синтеза липидов, активация факторов липолиза |
|
Полифенолы черники |
Снижение инсулинорезистентности, экспрессия PPAR, снижение веса печени, снижение веса тела и массовой доли жира, снижение содержания триглицеридов в крови |
|
Различные части растения гранат (Púnica granatum) |
Противовоспалительная, антиоксидантая, противоопуолевая активность |
|
Полифенолы какао |
Подавление адипогенеза и ожирения. Действует на рецептор инсулина, ингибирует IR-киназу и компоненты соответствующего сигнального пути |
|
Полифенолы фасоли (Vigna angularis) |
Нормализация метаболизма липидов, снижение содержания липидов в печени, удаление избытка липидов с калом, снижение триглицеридов в крови, активация глицерол-3-фосфат-дегидрогеназы |
|
Экстракт ореха (Semecarpus anacardium) |
Существенное снижение (нормализация) концентрации глюкозы в крови, рост концентрации ферментов антиоксидантной системы |
|
Абакоптерин А изAbacopteris penangiana |
Гиполипидемическое и антивоспалительное действие посредством ингибирования экспрессии NF-кB |
|
Флавоноиды из Litsea Coreana |
Повышение чувствительности к инсулину, рост концентрации супероксиддисмутазы, снижение в крови уровня свободных жирных кислот и триглицеридов, нормализация функций печени. |
|
Антоцианины морковного сока |
Антиоксидантное и антивоспалительное действие. Снижение толерантности к глюкозе, нормализация функций печени |
|
Земляника |
Снижение в крови концентрации триглицеридов, холестерина, снижение содержания окисленных продуктов в липопротеинах низкой плотности |
|
Флавоноиды из Potentilla discolor |
Гипогликемическое и гиполипидемическое действие, повышение уровня антиоксидантных ферментов, защита β-клеток поджелудочной железы |
|
Экстракт из Dodonaea viscosa |
Снижение резистентности к инсулину, подавление окислительного стресса, нормализация содержания липидов в крови |
|
Плод, мука и масло ананаса |
По данным клинических испытаний, существенное снижение холестерина в плазме и липопротеинах высокой плотности |
|
Изофлавоны сои |
Предотвращение ожирения путем регуляции функции гипоталамуса |
|
Флавоноиды лотоса Nelumbo nucifera |
Снижение веса тела и массы жира. Регуляция активности ферментов липидного обмена печени |
|
Экстракт стебля Cissus quadrangularis |
Повышение чувствительности к инсулину, восстановление функций печени. Действие сравнимо с препаратом метформин |
|
Экстракт оливкового масла |
Нормализация функций сердечно-сосудистой системы и печени. Нет влияния на гипертонию |
|
Флавоноиды из масла солодки Glycyrrhiza glabra |
Снижение абдоминального ожирения, регуляция в печени ферментов PPAR-α и SREBP-1c |
|
Флаваноиды из Купены аптечной (Polygonatum odoratum) |
Повышение чувствительности адипоцитов к инсулину |
|
Флавоноиды облепихи (Hippophae rhamnoides) |
Существенное снижение веса тела, жира в печени и висцеральных жировых отложений, снижение уровня холестерина, триглицеридов и глюкозы в крови. |
|
Водный экстракт плодов шелковицы (Morus alba). |
Снижение веса тела и содержания жира в печени, нормализация жирового обмена, повышение уровня ферментов, защищающих от окислительного стресса |
|
Полифенолы из зерен кофе |
Снижение накопления жиров в печени и нормализация активности ферментов липогенеза |
|
Флавоноиды пилеи (Pilea microphylla) |
Антидиабетический эффект: предотвращение ожирения, защита островковых клеток поджелудочной железы, предотвращение гипертрофии гепатоцитов, повышение уровня антиоксидантов в крови. |
|
Спиртовой экстракт Гибискуса (Abelmoschus manihot) |
Снижение аккумуляции триглицеридов в адипоцитах, снижение уровня триглицеридов и свободных жирных кислот в крови, регуляция факторов транскрипции PPAR-y, CEBP-α, ap2 |
Примечание. В таблице не упомянуты наиболее изученные полифенолы, действие которых подробно описано выше. Большинство данных получено в экспериментах на животных, если не указано иное.
Кроме того, полифенолы винограда подавляют воспалительные процессы, действуя как антиоксиданты и активируя экспрессию белков- антиоксидантов. Полифенолы также блокируют экспрессию провоспалительных цитокинов, киназ и транскрипционных факторов, участвующих в развитии воспалительных процессов, и наоборот, активируют экспрессию генов, препятствующих воспалению. Обогащение экстрактов виноградных косточек катехинами или использование смесей экстрактов красного винограда, изофлавонов сои и L- карнитина, может усиливать профилактическое действие препаратов.
Полифенолы различных растительных продуктов, используемых в пищу или в качестве лекарственных препаратов, могут оказывать положительное влияние на течение метаболического синдрома и проявлений диабета второго типа. Однако механизмы их действия мало изучены и, вероятно, очень разнообразны (табл. 12). Большинство представленных исследований проведены на животных (мышах и крысах), тогда как наблюдается огромный недостаток полноценных клинических испытаний действия этих веществ на организм человека. Это заставляет с осторожностью относиться к широко распространенному использованию указанных растительных материалов в качестве биодобавок.
Необходимо также отметить, что взаимодействие полифенольных соединений с белками, вероятно, может снижаться при длительном повышении уровня глюкозы в крови. Это связано с образованием ковалентных сшивок глюкозы с белками посредством неферментативного процесса, называемого гликозилированием. Было обнаружено, что связывание полифенолов с гликозилированными белками плазмы крови может снижаться в десять и более раз в сравнении с негликозилированными белками. Если данное явление достаточно универсально при взаимодействии полифенолов с различными рецепторами на поверхности клеток, то можно ожидать снижения эффективности действия полифенолов при хронических нарушениях метаболизма.
2.5.8. Фактор апоптоза TRAIL и антиканцерогенное действие
Апоптоз, или программируемая гибель клеток, является основной целью большинства терапевтических подходов в борьбе с раком. Поэтому фактор апоптоза цитокин TRAIL(TNF-related apoptosis inducing ligand), принадлежащий к суперсемейству белков TNF, привлекает внимание исследователей с момента его открытия в 1995 г. до настоящего времени. В литературе белок TRAIL иногда называют также кластером дифференциации CD253 (cluster of differentiation 253), или APO2-L, или TRAIL/Apo2L.
Физиологическая роль TRAIL изучена недостаточно, однако было показано, что этот белок играет определенную роль в формировании памяти Т-лимфоцитов, в процессах гематопоэза, в развитии аутоиммунных заболеваний и множестве других явлений. TRAIL играет значительную роль в антиопухолевой активности Т-лимфоцитов и клеток натуральных киллеров - NK-клеток. Таким образом, через TRAIL осуществляется регулирование роста и метастазирования опухолей, что является важной частью иммунной защиты организма от развития канцерогенеза.
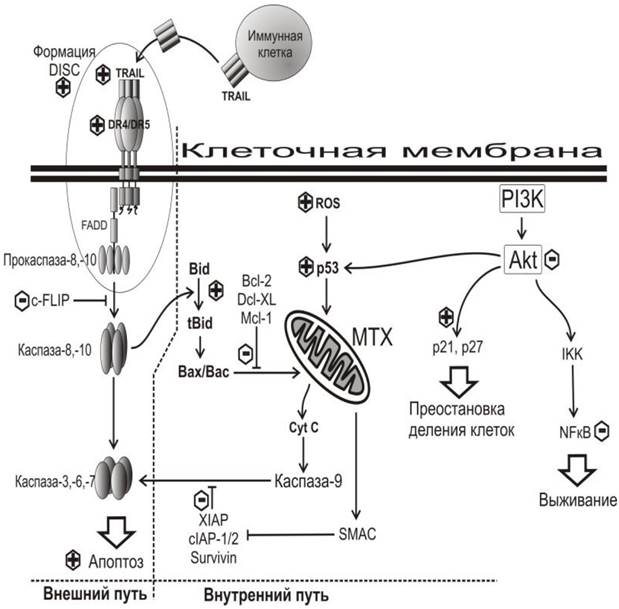
Этот белок содержит 281 аминокислоту и представляет гомотример, объединяющий три одинаковых молекулы. TRAIL находится на поверхности некоторых иммунных клеток (T-клетки, NK-клетки). Существует также водорастворимая форма белка TRAIL. Растворимая форма TRAIL проявляет меньшую токсичность в отношении печени, чем форма, связанная с мембраной, и может использоваться для инициации апоптоза опухолевых клеток. Циркулирующая в крови молекула TRAIL связывается с трансмембранными рецепторами клеточной смерти DR4 (TRAIL-R1) или DR5 (TRAIL-R2), находящимися на плазматической мембране раковых клеток (рис. 78), в результате чего запускается каскад химических процессов, приводящий к апоптозу.
Фактор апоптоза TRAIL продуцируется иммунными клетками (T- и NK-лимфоцитами), прикрепляется к рецепторам клеточной смерти DR4/DR5 на поверхности раковых клеток, после чего формируется комплекс DISC, в котором участвуют также адапторный белок FADD и прокаспаза-8 или -10. Образующаяся далее каспаза-8 или -10 активирует каспазу-3 (возможно также -6 или -7), которая является эффектором апоптоза. Этот путь называется внешним. На него может оказывать влияние регулятор апоптоза белок с-FLIP (имеет также название CASP8). Возможна также активация каспазы-3 через митохондрии (МТХ). В этом случае каспаза-8 или -10 активирует агонист апоптоза белок Bid(другое обозначение BH3), который через белки Bax и/или Bak действуют на мембраны митохондрий, в результате чего во внешней мембране митохондрий образуются поры, через которые высвобождается цитохром с (Cyt C). Последний через каспазы способен инициировать апоптоз. Действие белка Bax регулируется ассоциированными с ним реуляторными белками апоптоза Bcl-2, Dcl-XL и индуцибельным белком дифференциации клеток миелоидной лейкемии Mcl-1 (Induced myeloid leukemia cell differentiationprotein). Действие каспазы-9 и каспазы-3 может модулироваться ингибиторами апоптоза XIAP, cIAP и Survivin, которые регулируются митохондриальным активатором каспаз SMAC (известен также, как Diablo). Повреждение митохондрий может быть вызвано также супрессором опухолей белком р53, действие которого проявляется в присутствии активных форм кислорода (ROS) или протеинкиназы Akt, которая, в свою очередь, активируется фосфоинозитид-3-киназой (PI3K). На схеме показано, что Akt участвует также в регуляции клеточного деления через циклин-зависимые ингибиторы киназ р21, р27, или в регуляции выживания клеток через киназу IKK и ядерный фактор NF-kB.
Таблица 13. Действие растительных полифенолов на молекулярные мишени путей апоптоза, индуцированных TRAIL (с изменениями и дополнениями из обзора).
Молекулярная мишень |
Полифенол |
Тип рака |
Повышение экспрессии рецепторов клеточной смерти DR4/DR5 |
Кверцетин, кемпферол, апигенин, лютеолин, байкалеин, EGCG, силибин |
Рак прямой кишки, поджелудочной железы, простаты, шейки матки, легких, лейкемия, меланома, глиома |
Снижение экспрессии с-FLIP |
Ресвератрол, кверцетин, мирицетин, генистеин |
Меланома, глиома |
Активация каспазы-8 |
Кверцетин, кемпферол, мирицетин, апигенин, лютеолин, EGCG, генистеин, силибин, ресвератрол |
Рак прямой кишки, поджелудочной железы, печени, простаты, шейки матки, лейкемия, глиома |
Экспрессия, активация Bid |
Кверцетин, апигенин, лютеолин, генистеин, силибин |
Рак прямой кишки, печени, простаты, шейки матки, лейкемия, глиома |
Повышение экспрессии Bak |
Кверцетин, ресвератрол |
Рак простаты, нейробластома, лимфома |
Повышение экспрессии Bax |
EGCG, ресвератрол |
Рак желудка, простаты |
Снижение экспрессии Bcl-2 |
Кемпферол, мирицетин, EGCG, генистеин, даидзеин, ресвератрол |
Рак печени, простаты, шейки матки, глиома |
Снижение экспрессии Bcl-XL |
Кемпферол, EGCG, ресвератрол |
Рак печени, простаты, шейки матки, меланома |
Высвобождение цитохрома с |
Кверцетин, ресвератрол |
Рак прямой кишки, простаты |
Снижение экспрессии Akt |
Кверцетин, кемпферол, EGCG, генистеин |
Рак простаты, легких, глиома |
Снижение экспрессии сурвивина |
Кверцетин, кемпферол, EGCG, силибин, ресвератрол |
Рак простаты, легких, глиома, нейробластома |
Снижение экспрессии c-IAP |
Флавопиридол |
Лейкемия |
Снижение экспрессии XIAP |
Лютеолин, ресвератрол, флавокавин, лютеолин |
Рак простаты, шейки матки |
Активация каспаз- 8,-3 |
Кверцетин, EGCG, генистеин, силибин, ресвератрол |
Рак прямой кишки, поджелудочной железы, печени, |
TRAIL индуцирует апоптоз опухолевых клеток не только in vitro, но также на целом организме, как это было показано в доклинических исследованиях раковых заболеваний, проводимых на экспериментальных животных. По неизвестным пока причинам, активация сигнального пути TRAIL не оказывает токсичности в отношении нормальных клеток, что отличает указанный фактор от TNF или FasL. Последние также могут запускать процессы апоптоза, но их использование в медицине весьма проблематично, поскольку эти белки проявляют высокую токсичность в отношении здоровых клеток различных органов, особенно в отношении клеток печени.
Рис. 78. Влияние полифенолов на сигнальные пути апоптоза. Заимствовано с изменениями из обзоров. Знаками (+) и (-) выделены компоненты сигнального пути, на которые полифенолы оказывают положительное или отрицательное влияние. DISC - сигнальный комплекс, индуцирующий гибель клеток, c-FLIP - регулятор апоптоза, Bid - белок апоптоза, Mcl-1 - индуцибельный белок дифференциации клеток миелоидной лейкемии, Cit C - цитохром с, PI3K - фосфоинозитид-3-киназы, Akt - протеинкиназа В, р21 и p27 - ингибиторы клеточного деления на стадии G1, IKK - ингибитор киназы каппа-В.
Клинические испытания с использованием рекомбинантного человеческого TRAIL в сочетании с обычной химиотерапией показали обнадеживающие результаты. Однако некоторые раковые клетки обнаруживают устойчивость к активации сигнального пути TRAIL. Преодоление этой устойчивости и повышение способности клеток к апоптозу может существенно помочь в лечении различных видов рака.
Многие полифенольные соединения, в большинстве случаев флавоноиды, обнаруживают синергическое действие с TRAIL, оказывая влияние на различные белки, участвующие в регуляции апоптоза, выживаемости или скорости деления клеток опухоли. Так, Нишикава первым обнаружил, что эпигаллокатехин-3-галлат (EGCG) зеленого чая способен усиливать действие TRAIL на клетки гепатокарциномы человека, посредством отрицательного регуляторного воздействия на белки Bcl-2α и Dcl-XL. Аналогичный механизм действия через белки Bcl-2, Dcl-XL и ряд других белков (не указаны на схеме) был обнаружен при действии EGCG и TRAIL на клетки карциномы простаты. Позже была показана эффективность действия кемпферола и TRAIL в отношении глиобластом, где указанный флавоноид инициировал деградацию сурвивина (survivin, рис. 78) и ингибирование Akt, что приводило к гибели клеток карциномы простаты.
Кверцетин может усиливать действие TRAIL благодаря дефосфорилированию Akt и активации каспаз на клетках аденокарциномы человека. При этом не было обнаружено цитотоксичности в отношении нормальных клеток. Этими же авторами было показано, что кверцетин способен активировать каспазы-3, -8 и -9. Была обнаружена также способность кверцетина взаимодействовать с промотором сурвивина и препятствовать экспрессии этого белка [1171]. Сведения о действии флавоноидов и родственных соединений на различные компоненты сигнальной системы TRAIL-зависимого апоптоза приведены в таблице (табл. 13).
2.5.9. Профилактика нейродегенеративных заболеваний
В течение многих столетий традиционная медицина использует растительные материалы для лечения различных заболеваний нервной системы. Широко известны некоторые алкалоиды, которые могут взаимодействовать с различными рецепторами центральной нервной системы. Однако в последние годы было обнаружено, что растительные полифенолы также способны оказывать разнообразное действие на нервную систему, взаимодействовать со специфическими рецепторами на поверхности нейронов и клеток микроглии, защищать нервные клетки от окислительного стресса.
2.5.9.1. Проникновение через гематоэнцефалический барьер.
Для того, чтобы оценить возможность различных полифенольных соединений оказывать влияние на центральную нервную систему (ЦНС), прежде всего необходимо рассмотреть способность этих веществ проникать через гематоэнцефалический барьер (рис. 79).
Капилляры мозга характеризуются рядом отличий от капилляров других органов. Одним из таких отличий является образование плотных контактов между клетками, что существенно снижает проницаемость стенки капилляров для некоторых веществ. Эта функциональная особенность получила название гематоэнцефалический барьер (BBB).
Рис. 79. Упрощенная схема транспорта веществ через гематоэнцефалический барьер (BBB). Показан слой клеток эндотелия, выстилающего капилляры мозга. В отличие от эндотелия в других органах, между клетками эндотелия мозга имеются плотные контакты, образованные преимущественно белками окклюдином и клаудином. Плотные контакты затрудняют транспорт веществ в промежутках между клетками, присутствующий в капиллярах других органов. Хотя это ограничивает возможности переноса веществ через эндотелий, вещества продолжают транспортироваться из крови в ткани мозга путем пассивной диффузии через мембраны клеток (1) и через плотные контакты (2) с участием специализированных белковых рецепторов и транспортеров (3) или посредством трансцитоза, включающего последовательные процессы эндо- и экзоцитоза (4).
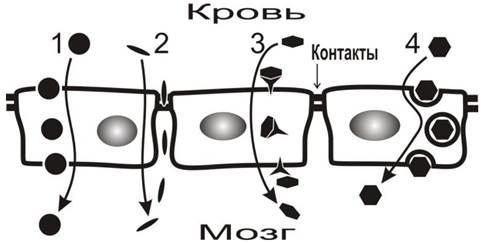
Наличие барьера не предполагает снижение потока питательных веществ через стенки капилляров. Напротив, мозг является самым энергопотребляющим органом в теле человека и требует постоянной доставки источников энергии и удаления продуктов метаболизма. BBB необходим для строгого контроля этих потоков и препятствует проникновению веществ, которые могли бы нарушить или изменить работу мозга. Аналогичные барьеры существуют не только в головном, но также в спинном мозге и в капиллярах сетчатки глаза.
Благодаря наличию плотных контактов между клетками эндотелия большинство веществ не могут свободно диффундировать в межклеточных промежутках, что создает условия для высокоизбирательного транспорта веществ через мембраны клеток эндотелия также весьма ограничена благодаря гидрофобному барьеру фосфолипидного бислоя мембран. Через гидрофобный барьер могут проникать, в основном, вещества мало растворимые в воде, но растворимые в жирах. Многие вещества транспортируются с помощью специализированных белковых переносчиков. Оценка проницаемости гематоэнцефалического барьера для жирорастворимых веществ является сложной задачей и производится экспериментально, как на клеточных моделях, так и на животных.
Таблица 14. Действие потребления (большей частью перорального) флавоноидов и флавоноид-содержащих растительных продуктов на когнитивные функции и внутриклеточные сигнальные системы мозга.
Вещество |
Действие |
|
Отвар какао, эпикатехин какао |
Улучшение памяти и обучаемости, снижение риска болезни Альцгеймера и инсульта, повышение жизнеспособности нейронов при интоксикации, повышение синаптической пластичности |
|
Экстракты флавоноидов из листьев гинкго (Ginkgobiloba) |
Повышение уровня внеклеточного дофамина и ацетилхолина |
|
Соки или флавоноиды из черники и земляники (клубники), ежевики, винограда, сливы |
Уменьшение риска снижения когнитивных функций у пожилых людей, положительное действие на когнитивные функции грызунов, повышение активности микроглии. Активация NF-kB и МАРК |
|
EGCG зеленого чая или отвар зеленого чая |
Нейропротекторная активность, улучшение когнитивных функций, улучшение внимания, транквилизация и анксиолитическое действие, действие на холинэргическую систему, систему глютатиона, системы CREB и Bcl-2, защита от окислительного стресса |
|
Проантоцианидины винограда |
Улучшение памяти, синаптической пластичности, способности к обучению, снижение риска болезни Альцгеймера |
|
Антоцианидины пальмы акаи |
Защитное действие на клетки микроглии, снижение COX-2, р38, TNF-α, NF-kB |
|
Полифенолы красного батата |
Улучшение когнитивных функций, усиление биогенеза митохондрий нейронов гиппокампа |
|
Нарингенин (Naringenin), нарингин (Naringin) |
Транквилизаторное и анксиолитическое действие, улучшение переносимости стресса обездвиживания, нейропротекторное, противовоспалительное, антиоксидантное действие, взаимодействие с сайтом связывания диазепина, рецептора GABA, защита митохондрий, повышение уровня TNF-α в мозге |
|
Пикногенол (Pycnogenol) из сосны приморской |
В исследовании на студентах обнаружено улучшение внимания, памяти, исполнительности и настроения. У пожилых женщин облегчение симптомов менопаузы |
|
Спиртовой экстракт плодов моринды цитрусолистной (Morinda citrifolia L.) |
Улучшение памяти, рост церебрального потока крови, ингибирование окислительного стресса и ацетилхолинэстеразной активности |
|
Генистеин (Genistein) |
Улучшение памяти и обучаемости, долговременное улучшение когнитивных функций при болезни Санфилиппо |
|
Силимарин (Silymarin) |
Защита от окислительного стресса, хелатирование Mn, активация ацетилхолиностеразы, улучшение состояния при болезни Альцгеймера |
|
Силибинин (Silibinin) |
Улучшение памяти, снижение окислительного стресса в мозге мышей, больных диабетом, действие на холин- эргическую систему, улучшение энергетического обмена мозга, ингибирование агрегации бета-амилоида |
|
Оливковое масло высокой чистоты (Extra virgin) |
Улучшение памяти и обучения у пожилых мышей, снижение проявлений болезни Альцгеймера |
|
Грецкие орехи |
После 8 недель потребления студенты колледжа улучшили результаты вербального теста по логике на 11,2 %. Изменений невербального теста по логике, памяти и настроения не обнаружено |
|
7,8-дигидроксифлавон |
Агонист рецептора тирозинкиназы В (TrkB), участвующего в патогенезе Альцгеймера. Молекула проходит через гематоэнцефалический барьер |
|
Лютеолин (Luteolin) |
Антидепрессант. При концентрации 1-10 мкМ предотвращает гибель нейронов и влияет на экспрессию белков стресса в гиппокампе |
|
Ликуритигенин (Liquritigenin) |
Улучшение памяти и способности к обучению, ингибирование астроцитов гиппокампа и сигнального пути Notch-2, относящегося к болезни Альцгеймера |
|
2’-метокси-6-метилфлавон |
Седативное и анксиолитическое действие. Активатор и модулятор рецептора GABA(A) |
|
Морин |
Терапия болезни Альцгеймера, снижение фосфорилирования Ʈ-белка и образования клубков филаментов в гиппокампе |
|
Кверцетин, рутин |
Улучшение памяти и способности к обучению у животных после интоксикации, защита нейронов гиппокампа |
|
Гесперидин (Hesperidin) |
Анксиолитическое действие, улучшение памяти после интоксикации |
|
Глабридин (Glabridin) |
Сохранение памяти и способности к обучению при диабете у крыс |
|
Изофлавоны сои |
Улучшение памяти и способностей к обучению в экспериментах на животных (на людях данные противоречивы). Защита от воспаления индуцированного бета- амилоидом при болезни Альцгеймера, подавление экспрессии NF-kB и Толл- подобного рецептора, повышение энергетики митохондрий тканей мозга |
|
Байкалеин (Baicalein) |
Седативный и анксиолитический эффекты, действие на систему GABA |
|
Апигенин (Apigenin) |
Защита мозга от токсического действия бета-амилоида |
|
Троксерутин |
Защита мозга мышей от повышенного содержания холестерина, проявлений диабета и болезни Альцгеймера, защита нейронов от апоптоза |
|
Икариин (Icariin) |
Нейропротекторное действие от окислительного стресса и нейродегенерации, активация MAPK, защита нейронов при болезни Альцгеймера у мышей, лечебное действие у пациентов с небольшими когнитивными нарушениями |
|
Абакоптерин Е (Abacopterin E) из папоротника (Abacopteris penangiana) |
Защита нейронов от окислительного стресса, улучшение памяти и обучаемости у животных |
|
Даидзеин, даидзин (daidzein, daidzin) |
Нормализация когнитивных функций животных при нарушениях холинэргической системы |
|
Фисетин (fisetin) |
Нейропротекторное действие у животных с болезнью Хантингтона, действие на протеинкиназы каскада ERK |
|
Нобилетин (nobiletin) из цитрусовых |
Улучшение памяти, антидепрессант, действие на норадренергетическую и дофаминовую системы |
Примечание. Большая часть экспериментов проведена на животных (грызунах). Эксперименты на человеке указаны в тексте.
веществ. Считается, что только небольшие полярные молекулы, такие как вода, глицерин или мочевина, способны проникать в области контактов. Свободная диффузия
Биодоступность полифенольных соединений для тканей мозга очень мала. Например, прямое введение в желудок больших количеств EGCG в течение суток позволяла получить очень высокие концентрации этого вещества в плазме крови, но при этом его концентрация в мозге составляла 5-10 % от концентрации в крови. Таким образом, для достижения терапевтических концентраций EGCG в мозге было необходимо повышать его концентрацию в крови до чрезмерно высоких значений. Исследование других флавоноидов показало, что кверцетин плохо проникает через ВВВ, но проникнув, накапливается в таких отделах мозга, как гиппокамп, полосатое тело (стриатум), мозжечок, где его концентрация может достигать 1 мг на грамм белка ткани мозга. Кемпферол и изорамнетин проникают лучше, и средняя концентрация этих веществ в мозге может достигать нескольких сот нанограммов на грамм белка. В настоящее время появились сомнения относительно адекватности оценок степени проникновения полифенольных соединений в мозг, а также эффективности действия малых концентраций этих веществ, поскольку, несмотря на кажущееся низкое содержание этих веществ в тканях нервной системы, имеется много экспериментальных свидетельств их эффективного действия на поведенческие реакции и когнитивные функции животных и человека (табл. 14).
Кроме того, было обнаружено, что после проникновения в ткани мозга флавоноиды могут подвергаться значительной модификации. Так, катехины конъюгируют с гликозидами и присутствуют в форме глюкуронидов, которые также обладают способностью защищать клетки от окислительного стресса и могут хелатировать катионы железа. Более того, химическая модификация флавоноидов и других растительных полифенолов может быть использована для доставки этих веществ в мозг, где они могут проявлять высокую активность. Так, предлагается использовать полностью ацетилированную форму EGCG в качестве предшественника лекарства. Было показано, что при этом активный EGCGвысвобождаться в цитоплазме клеток благодаря действию внутриклеточных эстераз. Использование флавоноидов в качестве строительных блоков для создания веществ, способных проникать через гематоэнцефалический барьер и проявлять лекарственную активность в клетках мозга, является одной из наиболее перспективных стратегий исследования.
2.5.9.2. Влияние флавоноидов на рецепторы нейронов
Влияние флавоноидов на деятельность мозга определяется не только антиоксидантной активностью, способностью хелатировать катионы металлов переменной валентности, влиять на активность протеинкиназ. Обнаружено также специфическое для нервной ткани действие этих веществ, поскольку некоторые флавоноиды способны оказывать влияние на рецепторы ацетилхолина и GABA. Так, цветы ромашки аптечной (Matricaria recutita) обладают успокаивающим действием благодаря присутствию апигенина. Цветы пижмы (Tanacetum parthenium), также богатые апигенином, используются в традиционной медицине для лечения мигрени и эпилепсии. Это действие может объясняться способностью апигенина влиять на рецепторы GABA, являющиеся главными тормозными медиаторами нервной системы. Успокаивающее действие цветов липы объясняют присутствием кверцетина и кемпферола, обладающих седативным эффектом. Успокаивающее действие вереска также объясняют высоким содержанием кверцетина и его способностью ингибировать активность моноаминоксидазы (MAO-A).
Рецепторы GABA
GABA (gamma-aminobutiric acid, или ГАМК - гамма- амномаслянная кислота) является основным тормозным медиатором позвоночных животных и человека. GABA является агонистом соответствующих рецепторов GABA. Различают ионотропные GABAA- и метаболотропные GABAВ-рецепторы. Ионотропные GABAA-рецепторы являются лиганд-зависимыми ионными каналами, тогда как рецепторы GABAB являются рецепторами, сопряженными с G-белком. Рецепторы GABAA являются членами суперсемейства лиганд-зависимых ионных каналов, находящихся в мембранах, представляют собой пентамерные белковые структуры, в состав которых входят различные комбинации субъединиц, содержащих четыре трансмембранных домена каждая. Один из доменов (ТМ2) участвует в образовании канала для хлора. Их структура имеет сходство с никотиновыми рецепторами ацетилхолина. Рецепторы образуются из комбинации субъединиц α1-α6, β-β3, y1-y3, δ. Хотя теоретически комбинаций может быть очень много, было обнаружено только 10 комбинаций, причем в мозге доминирует всего несколько комбинаций.
Фармакология рецепторов GABAA сложна и не до конца исследована. Известно, что эти рецепторы активируются гамма-аминомаслянной кислотой и избирательно блокируются алкалоидом бикукуллином (bicuculline). Рецептор GABAA содержит большое число различных сайтов аллостерического регулирования, способных модулировать работу этого рецептора. Среди них следует назвать бензодиазепины, барбитураты, нейростероиды, общие анестетики, антиконвульсанты и седативные агенты.
К числу агентов, способных влиять на рецептор GABAA, следует отнести также флавоноиды. Флавоноиды взаимодействуют с GABAA-рецепторами в тех же сайтах, что и бензодиазепины - одни из наиболее часто используемых лекарственных препаратов. Известно, что при взаимодействии с аллостерическими сайтами GABAA, так называемыми бензоадепиновыми сайтами, увеличивается поступление хлора в цитоплазму, повышается тормозной постсинаптический потенциал и снижается возбудимость нейронов. Благодаря этому, бензодиазепины и соответствующие флавоноиды действуют как антиконвульсанты, обладают седативным, снотворным и анксиолитическим эффектом.
Флавоноиды, в большинстве случаев принадлежащие к флавонам, а также их синтетические аналоги способны взаимодействовать с различными сайтами рецепторов GABA и благодаря этому влиять на их функционирование (рис. 80).
Рис. 80. Модулятор GABAA-рецепторов диазепам, известный под торговым названием валиум, а также флавоноиды, способные взаимодействовать с GABAA-рецепторами в сайтах связывания бензодиазепинов, подобных валиуму. Представлен природный флавоноид S-(-)- эквол и синтетические флавоноиды 6-бромофлавон, 6-хлоро-3’-нитрофлавон и 6,3-динитрофлавон. Рисунок составлен по материалам обзора.
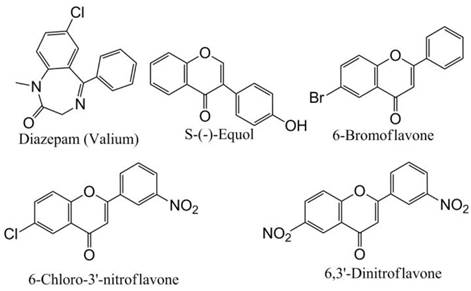
Такие природные флавоны, как апигенин из ромашки аптечной (Matricaria chamomilla) и пижмы девичьей (Tanacetum parthenium) способны взаимодействовать с сайтами бензодиазепинов с константой диссоциации Ki = 4мкМ. 6-метилапигенин из валерианы (Valeriana officinalis) взаимодействовал с константой диссоциации 495 нМ, что предполагает действие апигенина в качестве агониста GABA. Динатин (dinatin), скрофулеин (skrofulein) и гиспидулин (hispidulin), выделенные из полыни (Artemisia herba-alba) действовали на рецепторы GABAA с величинами полумаксимальной концентрации ингибирования IC50 1,3 мкМ, 23 мкМ, 104 мкМ и 8 мкМ соответственно.
Кризин (chrysin), полученный из страстоцвета (Passiflora coerulea), взаимодействовал с константой диссоциации Ki = 3 мкМ и проявлял выраженные свойства антиконвульсанта. Флавон байкалин из шлемника байкальского (Scutellaria baicalensis), обладает выраженным анксиолитическим и седативным эффектом. Было обнаружено, что этот агент взаимодействует предпочтительно с определенными субтипами GABAA-рецепторов, содержащих субъединицы α2 и α3, в отличие от бензоадепинов, не обладающих подобной специфичностью.
Синтетические производные флавонов могут обладать высокой активностью в отношении GABAA-рецепторов, существенно превышающей активность их природных аналогов. Некоторые из них обладают выраженной специфичностью в отношении определенных подтипов рецепторов GABAA, что предполагает возможность тонкого регулирования их действия на различные аспекты психической деятельности. Так, недавно полученные 3-Alkyl- и 3-amido-isothiazoloquinolin-4-ones обладали величиной сродства с рецепторами GABAA Ki= 2,8 нМ. Другой недавно полученный синтетический флавон 3-Hydroxy-2'-methoxy-6- methylflavone обладал величиной EC50= 1,4-2,5 нМ и проявлял анксиолитическое действие на мышах в количестве 1-100 мг/кг веса животного. При этом не наблюдалось седативного или миорелаксантного действия.
Было показано, что этот агент обладает способностью к позитивному аллостерическому модулированию строго определенного типа рецептов (α3β2/3y2L) и прямой активацией рецептора α4β2/3δ. Полученный в этой же лаборатории 2'-Methoxy-6-methylflavone взаимодействовал с другим сайтом на поверхности GABAA-рецептора и был способен непосредственно активировать проницаемостьионного канала у рецепторов, содержащих субъединицы α2/y2. В экспериментах на животных этот агент проявлял анксиолитическое и седативное действие, зависящее от дозы. Недавно проведенное исследование эфиров флаван-3-олов обнаружило их способность к позитивной модуляции работы GABAA рецепторов, что проявляется в действии, аналогичном действию общих анестетиков. Производное, обозначенное как Fa173, блокировало потенциацию GABAA-рецепторов в ответ на высокие, но не низкие, концентрации диазепама. Примечательно, что производные ретрохалконов, полученные путем метилирования и галогенирования определенных сайтов, также способны к положительной аллотропной модуляции GABAA-рецепторов.
Рецепторы глутамата
Флавоноиды способны влиять на функционирование рецепторов глутамата. Рецепторы глутамата располагаются на постсинаптической мембране и широко распространены в нервной системе. Они участвуют в постсинаптическом возбуждении нейронов. Их нормальное функционирование важно в формировании памяти и способности к обучению. Нарушение функции глутаматных рецепторов может быть причиной многих нейродегенеративных заболеваний. Известно несколько типов глутаматных рецепторов. Так, ионотропные рецепторы образуют трансмембранный канал, который открывается, когда глутамат связывается с рецептором. Классификация ионотропных глутаматных рецептов основана на способности некоторых веществ связываться с рецептором более специфично, чем глутамат, что приводит к открыванию канала (действие агонистов). Так, часть глутаматных рецепторов, агонистом которых является n-метил-D-аспартат (N-methyl-D-aspartate), называются NMDA- рецепторами. Глутаматные рецепторы, агонистом которых является производное пропионовой кислоты (α-amino-3-hydroxy-5-methyl-4- isoxazolepropionic acid - AMPA) называются рецепторами AMPA.
Известно, что чрезмерная активация этих рецепторов индуцирует вход Ca2+ в цитоплазму (дисгомеостаз кальция), что через сигнальную цепь может активировать ферменты, ответственные за продукцию свободных радикалов и другие процессы, приводящие к повреждению и гибели нейронов. Поэтому блокирование этих рецепторов широко используется в терапии когнитивных нарушений и нейродегенеративных заболеваний. В частности, при появлении чувства страха вследствие нарушений функционирования подкоркового ядра - миндалевидного тела (corpus amygdaloideum) и префронтальной коры мозга могут использоваться
блокаторы МNDА-рецепторов. В лечении эпилепсии или других психических нарушений, например, страшных воспоминаний, могут быть эффективны блокаторы или модуляторы АМРА-рецепторов.
Имеются свидетельства способности некоторых полифенольных соединений модулировать или блокировать работу AMPA- и MNDA- рецепторов или компонентов цепи передачи сигналов от этих рецепторов, что позволяет предотвращать апоптоз нейронов и нормализовать их функционирование (рис. 81).
Рис. 81. Схематическое изображение регуляции процессов апоптоза нейронов через глутаматные рецепторы NMDA и AMPA. При действии глутамата или соответствующих агонистов (NMDA или AMPA) трансмембранные каналы рецепторов открываются, в результате чего в цитоплазму проникают катионы кальция, которые могут увеличивать активность протеиназы кальпаина, что инициирует процессы апоптоза нейронов путем высвобождения активных форм кислорода (ROS) из митохондрий. Возможна также активация протеинкиназы С (PKC), которая изменяет (обычно увеличивает) проникновение кальция в цитоплазму путем фосфорилирования определенных аминокислот и увеличения времени открытого состояния каналов. Полифенольные соединения способны влиять на активность компонентов сигнальной системы.
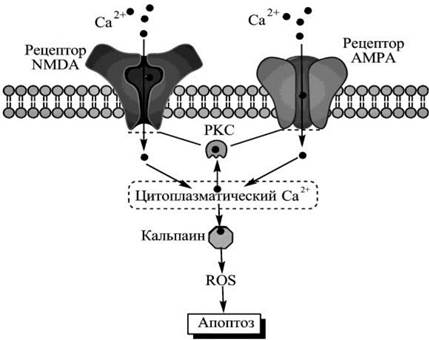
Наибольшее число работ посвящено изучению действия катехинов чая, прежде всего, действия EGCG на рецепторы NMDA, в результате которого наблюдается ингибирование избыточного входа кальция в клетку, снижается содержание активных форм кислорода и азота в цитоплазме и предотвращается нарушение функционирования и апоптоз нейронов. Подобно катехинам чая, на систему NMDA могут влиять кверцетин, троксерутин, мангиферин, морин, ресвератрол и байкалеин, которые способствуют восстановлению гомеостаза кальция и снижению концентрации ROS. Имеются также немногочисленные сведения о действии флавоноидов через рецептор AMPA. К ним относятся морин и ресвератрол.
Рецепторы ацетилхолина
Роль холинэргичской системы в развитии нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона, хорошо известна. В работе холинэргической системы ведущую роль играют рецепторы ацетилхолина (холинэргические рецепторы) и ацетилхолинэстераза. Известно два типа рецепторов ацетилхолина: никотиновые (nAChR) и мускариновые (mAChR), для которых агонистами являются никотин и мускарин соответственно.
Никотиновые рецепторы находятся преимущественно в преганглионарных синапсах центральной нервной системы, а также симпатической и парасимпатической нервных систем, в нервно-мышечных синапсах, в мозговом веществе надпочечников. Эти рецепторы обладают свойствами трансмембранных ионных каналов для Na+, K+, Са2+ и участвуют в деполяризации постсинаптической мембраны, необходимой для передачи сигнала возбуждения. Мускариновые рецепторы не являются каналами, но обладают метаболотропными свойствами и сопряжены с G-белками. Никотиновые рецепторы ацетилхолина находятся на постсинаптической мембране (рис. 82), и их функционирование зависит от присутствия ацетилхолина, который выбрасывается в синаптическую щель пузырьками пресинаптической терминали и удаляется из синаптической щели ацетилхолинэстеразой, находящейся на постсинаптической мембране. Активность этого фермента призвана прерывать передачу химического сигнала. Таким образом, регуляция синаптической передачи может осуществляться веществами, способными влиять как на рецепторы ацетилхолина, так и на работу ацетилхолинэстеразы.
Многие полифенольные соединения способны ингибировать ацетилхолинэстеразную активность, способствуя, таким образом, передаче сигнала в синапсе. В настоящее время известно более сотни флавоноидов, обладающих способностью ингибировать ацетилхолинэстеразную активность, и их число быстро растет.
Исследования на людях показывают, что диета, богатая растительными полифенольными соединениями, многие из которых принадлежат к флавоноидам, может быть эффективна в предупреждении развития нейродегенеративных заболеваний, возрастных изменений мозга и деменции. Кроме того, в экспериментах на животных было показано, что EGCG, кверцетин, богатые полифенолами экстракты черники могут облегчать течение когнитивных заболеваний, улучшать память и способность к обучению.
Было показано, что EGCG способен формировать докинг-комплекс с соответствующими сайтами на молекуле ацетилхолинэстеразы, благодаря чему осуществляется регуляция холинэргической передачи нервного импульса. Более того, наблюдается синергическое действие EGCG с некоторыми лекарственными веществами, используемыми в лечении болезни Альцгеймера, действие которых также направлено на ацетилхоли- эстеразную активность. Например, такой синергизм был обнаружен
в отношении ингибитора ацетилхолинэстеразы алкалоида гуперцина А (huperzine A), что позволяет существенно снизить лекарственные дозы токсичного алкалоида и увеличить время ингибирующего действия этого агента. Способность EGCG подавлять активность ацетилхолинэстеразы, а также оказывать на клетки разнообразное действие, способствующее их выживанию и функционированию, включая подавление окислительного стресса, снижение концентрации цитокинов (TNF-α), интерлейкинов, снижение экспрессии NF-кВ, каспазы-3, может существенно улучшать функционирование мозга после действия отравляющих веществ. Например, ежедневное потребление EGCG в количестве 50-100 мг на кг веса тела эффективно устраняет долгосрочные поведенческие отклонения и улучшает биохимические параметры мозга у животных после внутриутробного алкогольного отравления. Существенной ингибирующей активностью в отношении ацетилхолинэстеразы обладает также кверцетин, который в сравнительном исследовании оказался эффективнее (ингибирование на 76 %), чем флавоноиды генистеин, биоханин А, нарингин, силибинин, апигенин, лютеолин-7-О-галактозид, кемпферол-3-О-галактозид, диосмин и силимарин. Высокая активность кверцетина была показана также
в сравнении с тамариксетином (tamarixetin) и гликозидами мирицетина. Кверцетин (потребление 50 мг/кг в день) способен защищать нейроны гиппокампа от окислительного стресса, вызванного действием полихлорированных дифенилов, которые известны как высокотоксические загрязнители окружающей среды.
Рис. 82. Схематическое изображение синаптической передачи сигнала с помощью ацетилхолина. Ацетилхолин (АCh) находится в синаптических везикулах нервного окончания аксона нервной клетки. При деполяризации синаптической терминалы синаптические пузырьки сливаются с пресинаптичской мембраной и высвобождают ацетилхолин в синаптическую щель. Ацетилхолин достигает постсинаптической мембраны, находящейся на дендритах или теле другой нервной клетки, где может взаимодействовать с никотиновым ацетилхолиновым рецептором (nAChR), в результате чего в молекуле рецептора открывается канал для катионов, что вызывает деполяризацию постсинаптичской мембраны, необходимую для передачи нервного импульса. Часть ацетилхолина взаимодействует с ацетилхолинэстеразой и расщепляется, образуя ацетат и холин. Холин возвращается в синаптическую терминаль с помощью переносчика холина (ChС), вновь ацетилируется с участим фермента холинацетилтрансферазы (ChАТ). Образовавшийся ацетилхолин возвращается в синаптические пузырьки.
Производные изофлавонов рассматриваются как наиболее многообещающие ингибиторы ацетилхолинеэстеразной активности (рис. 83). Большой интерес представляют также флавоны и халконы. Для повышения активности в молекулах должны присутствовать ОMе-группы в положениях С6 и С7. Присутствие пиперидиновых, пирроли- диновых или аминоэтиловых групп в положениях С3’ или С4’ также повышает ингибирующие свойства флавоноидов. Для сравнения с наиболее активными синтетическими флавоноидами следует упомянуть также IС50 некоторых распространенных природных флавоноидов. Так, для кверцетина, по данным различных исследований, приведенным в обзоре, IС50находится в пределах 20-350 мкМ, апигенина около 120 мкМ, лютеолина 25-65 мкМ, кемпферола 3-93 мкМ, что свидетельствует о том, что их активность в тысячи раз ниже, чем активность указанных синтетических производных.
Рис. 83. Наиболее активные ингибиторы ацетилхолинэстеразы (IС50 <100 нМ). Все представленные соединения являются синтетическими производными природных продуктов. Звездочкой выделено наиболее активное соединение из всех известных в настоящее время (IС50 <4 нМ).
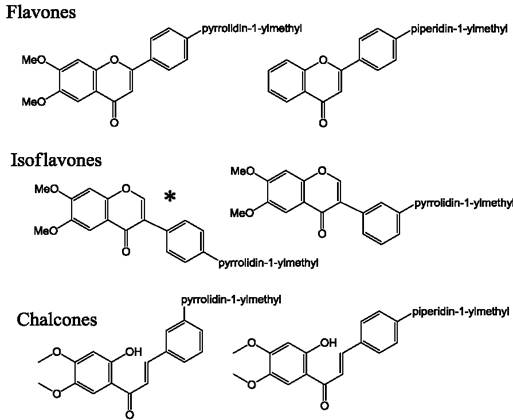
2.5.10. Флавоноиды в преодолении устойчивости к лекарствам
Пациенты, принимающие лекарственные препараты, со временем могут обнаружить снижение эффективности их действия. Это явление получило название лекарственной устойчивости. Более того, после приема одного лекарства можно наблюдать одновременное снижение эффективности целого ряда лекарственных веществ, иногда химически различных, что называется множественной лекарственной устойчивостью. Снижение эффективности лекарств может быть связано как с изменениями, происходящими в организме пациента, так и с изменениями источника инфекции (бактерий, вирусов, грибков, паразитов) в случаеинфекционных заболеваний, или изменениями в клетках опухоли в случае онкологических болезней. Было обнаружено, что некоторые природные соединения, включая флавоноиды, способны восстанавливать эффективностьлекарственных препаратов, преодолевая таким образом барьер лекарственной устойчивости.
Молекулярные механизмы лекарственной устойчивости
многообразны. Среди них можно упомянуть: 1) повышение скорости выведения лекарственного вещества из цитоплазмы клеток источника патогенеза (клеток бактерий, грибков, опухолей и т. д.); 2) химическую модификацию лекарственного вещества в организме человека или животного, снижающую его токсическое действие на клетки источника патогенеза; 3) снижение аффинности молекулярных мишеней к лекарству или снижение их доступности для лекарства; 4) снижение зависимости жизнедеятельности клеток источника патогенеза отизменений или повреждений молекулярных мишеней, вызванных действием лекарства; 5) повышение жизнеспособности клеток источника патогенеза или снижение их склонности к развитию апоптоза. В частности, интерес представляют механизмы лекарственной устойчивости клеток различных органов человека, связанные с функционированием транспортных систем плазматической мембраны, называемых АВС-транспортерами, которые участвуют в удалении лекарственных веществ из цитоплазмы.
Таблица 15. Основные группы АВС-транспортеров человека.
Группа |
Основная функция |
АВСА |
Транспорт холестерина и липидов |
АВСВ |
В митохондриях печени: транспорт компонентов желчи. В гематоэнцефалическом барьере: удаление токсинов и лекарств |
АВСС |
Секреция токсинов, транспорт ионов |
ABCD |
Присутствуют в пероксисомах |
ABCE/ABCF |
Немембранные белки, участвующие в экспрессии генов и синтезе белков |
ABCG |
Транспорт липидов, лекарств, компонентов желчи, холестерина и других стероидов |
АВС-транспортеры принадлежат к группе АТФ-связывающих транспортеров (ATP-binding cassette transporters), являющихся представителями большого и одного из наиболее древних семейств белков, присутствующих у про- и эукариот. В животном мире большинство АВС- транспортеров являются трансмембранными белками, использующими энергию гидролиза АТФ для удаления лекарственных и токсических веществ из цитоплазмы. У человека обнаружено 48 АВС- транспортеров, которые можно разделить на семь групп (табл. 15) и несколько подгрупп, но только 12 из них способны участвовать в транспорте лекарственных веществ.
У человека и млекопитающих наиболее изучены следующие ABC- транспортеры: Р-гликопротеин (P-gp), принадлежащий к семейству ABCB1, белок лекарственной устойчивости рака молочной железы (BCRP - breast cancer resistance protein), обозначается также ABCG2, и белок множественной лекарственной устойчивости 2 (MRP2 multidrug resistance- associated protein, обозначается также ABCC2). Эти белки присутствуют в апикальных мембранах эпителия кишечника, печени и почек. Благодаря этому они способны ограничивать биодоступность лекарств, принимаемых перорально. Кроме того, они могут способствовать выведению лекарств из крови с мочой или с желчью, или производить экскрецию веществ через кишечный эпителий и далее удалять их с калом. Эти белки также участвуют в селективной проницаемости гематоэнцефалического барьера. Подавление активности АВС- транспортеров является важным этапом повышения эффективности доставки лекарственных веществ в организм.
P-gp транспортеры
Функция этой группы ABC-транспортеров не ограничивается удалением лекарственных веществ из цитоплазмы. Главной функцией P-gp является транспорт липидов. Этот белок способен транспортировать холестерин и фосфолипиды клеточных мембран: фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, сфингомиелин, церамиды. Он участвует в транспорте через мембрану кортизола, дексаметазона и других кортикостероидов клетками кишечного эпителия или клетками эндотелия гематоэнцефалического барьера.
Природные полифенольные соединения, такие как флавоноиды, способны влиять на функционирование АВС-транспортеров. Предполагается, что они способны действовать на АТФ-связывающий домен этих белков, но могут также проникать в гидрофобную часть липидного бислоя и влиять на трансмембранные домены белка. Было показано, что байкалеин, некоторые флавоны, кверцетин, мирицетин, процианидин являются эффективными ингибиторам P-gp. Наиболее специфическим ингибитором P-gp, известным в настоящее время, по-видимому, является производное десмосдумотина (desmosdumotin) - флавона из кустарникового растения Desmos dumosus, произрастающего в Китае. В исследовании действия различных флавоноидов на способность P-gp удалять из цитоплазмы цитотоксические лекарственные вещества, используемые в химиотерапии, показали корреляцию между способностью флавоноидов влиять на АТФ-азную активность P-gp и лекарственной устойчивостью клеток к действию вибрастина и даунорубицина.
Сравнение молекулярного строения различных флавоноидов или их производных позволяет выявить некоторые закономерности, определяющие активность этих веществ в отношении Р-gr-транспортеров. Было обнаружено, что модификации, при которых гидрофобность флавоноидов увеличивается, сопровождаются увеличением их способности ингибировать удаление лекарственных веществ. В некоторых случаях значительное увеличение способности флавоноидов блокировать транспортные возможности Р-grнаблюдается при метилировании нескольких гидроксильных групп. При этом благоприятным фактором, способствующим активности флавоноидов, является наличие гидроксильных групп в положении 7 на А-кольце, и положении 5’ на В-кольце, а также наличие двойной связи в положении С2-С3 на С-кольце, что способствует поддержанию плоской структуры молекулы. Большое значение может иметь способность флавоноидов связываться с NBD2- субъединицей Р-gr транспортера, ответственной за гидролиз АТФ. Было показано, что аффинность флавоноидов к NBD2-субъединице падает в ряду дегидросилибин> халкон> флавонол> флавон> изофлавон> флавонон. Для обеспечения аффинности к NВD2-субъединице флавоно- иды должны иметь ОН-группы в положениях 3 и 5 на кольце А, карбонильную группу в положении 4 и двойную связь в положении С2-С3.
Недавние работы по молекулярному моделированию позволяют определить положение различных групп в пространстве, необходимое для оптимизации связывания флавоноидов с NВD2-субъединицей. В NBD2-субъединице сайт связывания АТФ располагается рядом с сайтом связывания стероидов. Вначале предполагалось, что флавоноиды взаимодействуют с АТФ-связывающим сайтом. При некоторых модификациях молекулы флавоноида возможно также связывание с сайтом стероидов. Действительно, в экспериментах с флавоноидом верапамилом было показано наличие корреляции между нарушением транспорта лекарственных веществ (вимбластина, даунорубицина или колхицина) и АТФ- азной активностью Р-gr. Однако молекулярное моделирование показало, что сайт связывания флавоноида не соответствует точно АТФ- связывающему сайту, но создается при проникновении молекулы флавоноида в гидрофобный карман, находящийся в этой области. Кроме того, было обнаружено, что димеры флавоноидов также могут взаимодействовать с NBD-субъединицей, при этом их активность в подавлении транспортных функций Р-gp может быть выше, чем мономеров.
Предполагается, что для ингибирования работы АВС- транспортеров необходимо, чтобы агент либо препятствовал взаимодействию молекулы транспортера с транспортируемым субстратом, либо блокировал процессы взаимодействия, гидролиза или использования энергии АТФ для перемещения субстрата через мембрану. Возможно также, что ингибитор производит изменения в липидном бислое, препятствующие нормальному функционированию транспортной системы. Сравнительный анализ различных флавоноидов показал, что для эффективного ингибирования Р-gp необходимы: 1) достаточно высокая липофильность молекулы (log P> 2,92); 2) длинная ось молекулы должна составлять не менее 18 атомов углерода; 3) молекула должна содержать хотя бы один четвертичный амин, способный образовывать катион при нейтральных рН; 4) молекула должна иметь хотя бы один акцептор водородной связи и достаточно большую гидрофобную область. Предполагается, что молекула ингибитора (флавоноида), взаимодействуя с белком, образует несколько водородных и ионных связей, что приводит к нарушению третичной структуры молекулы белка.
В исследовании ингибиторов фактора лекарственной устойчивости рака молочной железы (BCRP) было показано, что молекула флавоноида предпочтительно должна содержать гидроксильную группу при атоме углерода 5, двойную связь между атомами 2 и 3, и метокси-группу при 3-м атоме углерода. Предполагается, что эта группа может выполнять функцию акцептора при образовании водородной связи с молекулой белка. Использование молекулярного моделирования для оценки соотношения структура-активность (QSAR) позволяет предсказывать формулы наиболее активных аналогов флавоноидов, способных ингибировать АВС-транспортеры (рис. 84).
Рис. 84. Аналоги флавоноидов, способные эффективно ингибировать транспортеры ABCG2. А, В - общие формулы предполагаемых ингибиторов. С - пример высокоэффективного ингибитора.
Эффективными ингибиторами АВС-транспортеров являются также ауроны. Их эффективность может быть выше аналогичных флавонов и халконов в подавлении АТФ-азной активности АВС-транспортеров. Это связано с тем, что бензофурановая часть молекул ауронов больше похожа на молекулу аденина, чем бензопираноновая часть молекулы флавонов (рис. 85). Кроме того, предполагается, что присутствие гидроксильной группы в положении 4 может мимикрировать под аминогруппу в соответствующей позиции аденина.
Рис. 85. Сравнение бензофурановой части молекулы аурона с адениловой частью молекулы АТФ.
2.5.11. Защита кожи от УФ-радиации
2.6.5.1. Строение кожных покровов
Кожа состоит из эпидермиса и дермы, которые разделены базальной мембраной (рис. 86). Верхний слой кожи - эпидермис постоянно обновляется благодаря делению клеток базального слоя, лежащего под эпидермисом. После деления дочерние клетки, кератиноциты, постепенно созревают, образуя сначала слой шиповатых клеток. Далее, продвигаясь к поверхности кожи, кератиноциты образуют зернистый слой. Оказавшись ближе к поверхности, кератиноциты погибают, превращаясь в корнеоциты рогового слоя. Корнеоциты не имеют цитоплазмы, но заполнены белком кератином. Роговой слой эпидермиса, образованный корнеоцитами, является основным барьером кожи, препятствующим проникновению веществ и патогенных организмов. Между корнеоцитами находятся пласты липидных бислоев, содержащих церамиды и сфингозины с длинными насыщенными углеводородными цепями, создающими барьер для проникновения веществ. Кроме того, важным барьером для проникновения веществ является базальная мембрана - тонкий слой, содержащий фибриллы коллагена, эластина и фибриллина.
Рис. 86. Схематическое изображение строения кожи. Для наглядности пропорции изменены. В коже, в отличие от представленной схемы, толщина эпидермиса в десятки раз меньше толщины дермы.
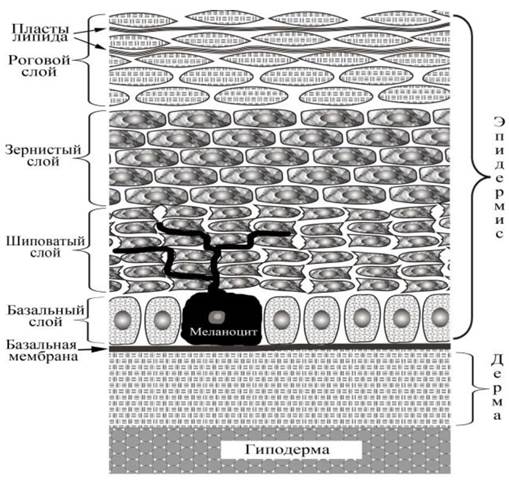
Под базальной мембраной находится собственно кожа - дерма. В базальном слое находятся также меланоциты, которые с помощью длинных отростков (дендритов) доставляют заполненные меланином меланосомы в промежутки между клетками вышележащих слоев эпидермиса, в результате чего образуются меланиновые гранулы, защищающие эпидермис от действия ультрафиолета.
Дерма обеспечивает такие механические свойства кожи, как прочность в сочетании с упругостью и растяжимостью, что достигается благодаря особой организации сети, состоящей из фибрилл коллагена и эластина. Пространство между фибриллами заполнено гелем из гликозаминогликанов (мукополисахаридов), в котором содержится большое количество воды, благодаря чему гель выполняет функцию амортизатора ударов. Кроме того, в дерме содержатся кровеносные и лимфатические сосуды, потовые железы, волосяные фолликулы и прикрепленные к ним мышечные волокна, нервные окончания, рецепторы давления (тельца Мейснера), рецепторы растяжения (окончания Руффини), рецепторы холода (колбы Краузе). Присутствуют также такие клеточные элементы, как тучные клетки (тканевые базофилы), фибробласты, Т-лимфоциты, макрофаги.
Под дермой располагается подкожная ткань гиподерма, которая является наиболее глубоко расположенной частью покровной ткани мезенхимального происхождения. Гиподерма состоит из рыхлой соединительной и жировой ткани, содержащей адипоциты. Кроме того, в гиподерме находятся фибробласты и макрофаги, кровеносные сосуды, нервные окончания и рецепторы давления (тельца Пачини).
2.6.5.2. Механизмы защитного действия флавоноидов от УФ- радиации
Длительное интенсивное воздействие ультрафиолетовой радиации на поверхность кожи приводит к развитию окислительного стресса, повреждению молекул ДНК и развитию воспалительных процессов. Облучение ультрафиолетом может стать причиной различных заболеваний кожи, среди которых следует упомянуть не только преждевременное старение, но также такие серьезные заболевания, как меланома и немеланомные формы рака. Ультрафиолетовые компоненты солнечного спектра можно условно разделить на три части: короткие волны, средние волны и длинные волны (табл. 16).
Таблица 16. Хактеристики УФ-диапазонов.
Обозначение УФ-диапазонов |
Длина волны, нм |
Характеристики |
(А) Длинные волны |
320-400 |
Составляет 90-95 % ультрафиолетового спектра. Его называют «старящим светом». Проникает на глубину до 1 мм. Может вызывать рак. Вызывает процесс перекисного окисления, образование свободных радикалов и синглетного кислорода, что может приводить к повреждению макромолекул, включая ДНК. Может подавлять иммунитет. |
(В) Средние волны |
290-320 |
Составляет 5 % солнечной УФ-радиации. Вызывает различные заболевания кожи. Проникает на 160-180 мкм через весь эпидермис до дермы. Может индуцировать окислительный стресс и повреждение ДНК. Является инициатором и промотором канцерогенеза. |
(С) Короткие волны |
200-290 |
Поглощается озоновым слоем и не доходит до поверхности земли. Может вызывать сильные повреждения различных молекул, включая ДНК. Проникает на глубину 60 - 80 мкм. |
Большинство полифенольных соединений растительного происхождения способно поглощать излучение в УФ-диапазоне и, следовательно, может выполнять функцию экрана (рис. 87). Действительно, экспериментально показано, что при нанесении на поверхность кожи экстрактов из растений существенно снижается реакция кожных покровов на облучение ультрафиолетовым светом. Однако защитное действие этих веществ не ограничивается только экранированием тканей от действия ультрафиолетовой части спектра. Защита осуществляется также благодаря действию на регуляторные системы клетки.
Рис. 87. Спектры поглощения: 1 - водного экстракта мать-и-мачехи (Tussilágo fárfara); 2 - рутина.
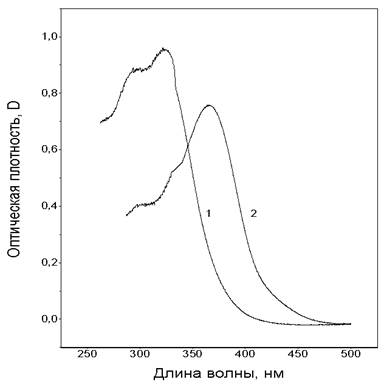
Значительное влияние на процессы старения кожи под действием УФ-радиации оказывает повышение экспрессии металлопротеаз, которые способны разрушать белки в межклеточном матриксе. В частности, происходит разрушение коллагена, нарушается процесс формирования новых фибрилл коллагена, в результате чего происходит нарушение механических свойств кожи и образование морщин. Некоторые флавоноиды, например, апигенин, лютеолин, аментофлавон способны подавлять экспрессию металлопротеиназ благодаря индуцированию входа катионов кальция в цитоплазму, в результате чего осуществляется влияние на кальций-зависимую сигнальную систему МАРК. Кроме того, некоторые катехины, включая EGCG, способны стабилизировать фибриллы коллагена и препятствовать разрушению фибрилл под действием коллагеназ. Было показано, что различные полифенольные соединения способны непосредственно взаимодействовать с гидрофобными сайтами коллагена. Это может способствовать ускорению формирования фибрилл коллагена из мономеров, как это было показано на примере действия таксифолина на динамику формирования фибрилл. Известно, что при нейтральной величине рН (в фосфатном буфере) молекулы коллагена образуют фибриллы, похожие на те, которые присутствуют в тканях. Было обнаружено, что в присутствии таксифолина процесс фибриллообразования существенно ускоряется. Под электронным микроскопом фибриллы, образованные в присутствии таксифолина, имеют большую упорядоченность и обнаруживают характерную для этого объекта периодическую полосатость (рис. 88).
Рис. 88. Влияние таксифолина на образование фибрилл коллагена в растворе молекул этого белка. А - изменение интенсивности рассеяния света вследствие образования фибрилл. Стрелкой указан момент введения раствора белка в ячейку. (1) - контрольный препарат коллагена; (2) - то же, в присутствии 0,001 % таксифолина; (3) - в присутствии 0,01 % таксифолина. Стрелкой указан момент введения раствора таксифолина. Б - электронная микрофотография пучков коллагена, образовавшихся в присутствии 0,01 % таксифолина. Б’ - отдельная нить коллагена, сформированного в присутствии таксифолина. Видна поперечная полосатость.
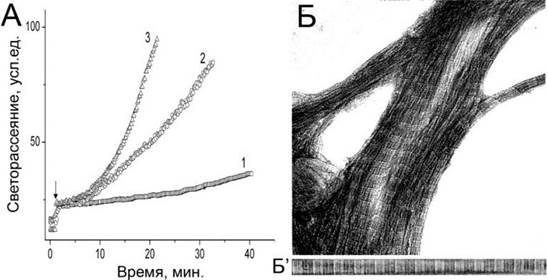
Кроме того, дифференциальная сканирующая микрокалориметрия свидетельствует о концентрационно-зависимом повышении термостабильности фибрилл, образовавшихся в присутствии таксифолина. Эти данные позволяют предположить, что таксифолин может повышать устойчивость кожи к действию повреждающих факторов благодаря ускорению формирования фибрилл коллагена и увеличению их стабильности. Дифференциальная сканирующая микрокалориметрия также показывает, что флавониды или их экстракты из растений способны защищать коллаген от действия ультрафиолетового облучения (рис. 89).
Рис. 89. Влияние УФ-облучения на термограммы коллагена, полученные с помощью дифференциальной сканирующей микрокалориметрии: (а) - контрольный образец коллагена плавится при 41°С. Облучение ультрафиолетом от ртутной лампы сверхвысокого давления СВД-120А в течение (б) - 30 сек и (в) - 2 мин дестабилизирует коллаген и снижает температуру плавления; (г) - экстракт мать- и-мачехи (0,04 %) и (д) - смесь экстрактов мать-и-мачехи (0,04 %) и алоэ (0,015 %) частично сохраняют термостабильность коллагена. Для термограмм (г) и (д) время УФ-облучения 2 мин.
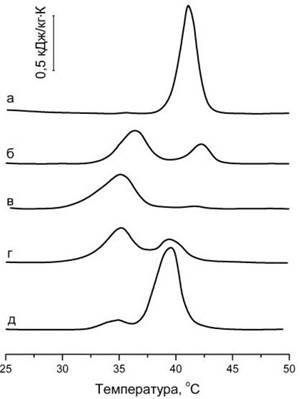
В экспериментах на кератиноцитах и на участках кожи, облученных ультрафиолетовым светом в области В-диапазона, было обнаружено, что одним из главных повреждающих факторов ультрафиолетового облучения является появление в цитоплазме активных форм кислорода. Однако, как было отмечено, энергии кванта электромагнитного излучения в диапазоне УФ-В недостаточно для инициирования столь интенсивных процессов окисления и накопления активных форм кислорода (ROS), которые в действительности наблюдаются в цитоплазме кератиноцитов при облучении. Было обнаружено, что появление ROS связано с активацией фактора NF-kB и последующей экспрессией NADPH-оксидазы и СОХ-2, активность которых является причиной накопления ROS в кератиноцитах. Активность циклооксигеназы в цитоплазме и накопление продуктов перекисного окисления липидов (ПОЛ) связаны с повышением концентрации катионов кальция в цитоплазме при облучении ультрафиолетом.
Антиоксиданты, повидимому, не способны защитить кожу от последствий УФ-В-облучения. Так, экспериментально было показано, что антиоксидант ионол был не эффективен в защите клеток, подвергнутых УФ-облучению, тогда как блокатор циклооксигеназы COX-2 аспирин снижал концентрацию ПОЛ в кератиноцитах. Вследствие того, что УФ-В- облучение индуцирует активность циклооксигеназы СОХ-2, в клетках кожи повышается концентрация простагландинов (PG), образующихся из арахидоновой кислоты. В результате этого развиваются процессы воспаления, наблюдается эдема, ускоряется пролиферация кератиноцитов, гиперплазия эпидермиса, накапливаются продукты окисления, что приводит к окислительному повреждению ДНК. Поэтому в результате хронического облучения накапливаются мутации, что приводит к злокачественному перерождению кератиноцитов и развитию канцерогенеза. Напротив, действие ингибиторов COX-2 или агентов, препятствующих экспрессии этого фермента, может существенно препятствовать канцерогенному перерождению клеток эпидермиса. Подавление экспрессии COX-2 и одновременно проведение курса УФ-терапии может быть эффективно в лечении некоторых форм кератоза (болезнь Дарье). Это заболевание связано с повышенной экспрессией Са2+-АТФ-азы саркоплазматического и эндоплазматического ретикулума, регулирующей концентрацию катионов кальция в миоцитах и некоторых других клетках, включая кератиноциты. Ультрафиолетовая радиация снижает экспрессию этого фермента, что облегчает течение заболевания, тогда как СОХ-2, напротив, существенно повышает экспрессию Са2+-АТФ-азы, что ухудшает состояние больных. Подавление экспрессии СОХ-2 при одновременной УФ-терапии может быть эффективно также в лечении эритемы.
Способность некоторых флавоноидов подавлять экспрессию СОХ-2 может лежать в основе механизмов защитного действия этих веществ против действия УФ-радиации, как это было показано на примере байкалеина и вогонина, гесперетина, магниферина и тангеритина. Возможно, что эта регуляция осуществляется через регуляторный путь МАРК, как это было показано на примере лютеолина. На примере метилированного флавонола 5,7-диметоксифлавона было показано, что регуляции могут подлежать не только COX, но и другие компоненты регуляторной цепи, например, PPAR, NF-kB, в результате чего наблюдается снижение концентрации провоспалительных цитокинов (IL-6, IL-8). Кроме того, наблюдается снижение экспрессии металлопротеаз, снижается концентрация компонентов окислительного стресса, подавляется активность компонентов воспаления через регуляторные пути NF-kB и MAPK. В итоге предотвращается старение кожи, связанное с действием УФ-радиации.
Флавоноиды могут влиять и на другие регуляторные системы клеток кожи. Недавно было обнаружено, что силибинин (silibinin) предотвращает повреждение эпидермиса после облучения УФ-В за счет активации супрессора опухолей, белка р53 (tumor suppressor protein 53), в результате чего наблюдается активация белка GADD45α (Growth arrest andDNA-damage-inducible protein), способствующего защите клеток в условиях стресса и повреждения ДНК. Флавон кризин (chrysin) защищает кератиноциты эпидермиса от повреждения облучением УФ-А и УФ-В, прежде всего, восстанавливая экспрессию аквапорина 3 (AQP-3), обеспечивающего нормализацию осмотического и солевого баланса клетки, нарушенного в результате облучения. В исследовании защитного действия эриодиктиола (eriodictyol) в отношении кератиноцитов было обнаружено, что этот флаванон действует через фосфатазо-зависимую модуляцию сигнальных путей p38 MAPK и Akt. Эриодиктиол способен непосредственно ассоциировать с соответствующими протеинкиназами, участвующими в фосфорилировании указанных компонентов сигнальной системы. Антоцианины ежевики защищают кератиноциты от УФ-радиации благодаря существенному повышению экспрессии актиоксидантных ферментов: каталазы, митохондриальной супероксид- дисмутазы и глутатионпероксидазы, предотвращая таким образом развитие окислительного стресса. Процианидины винограда также предотвращают продуцирование активных форм кислорода в клетках, но используя иной механизм - подавление экспрессии р38 (MAPK14) и JNK1/2 (MAPK8). Диметоксифлавон (5,7-dimetoxyflavone) защищает эпидермис, индуцируя меланогенез и увеличивая содержание меланина путем инициации транскрипции соответствующих генов меланоцитов через ц-АМФ-зависимый сигнальный путь. Метаболит соевого изофлавона даидзеина (daidzein) - 7,3’,4’-тригидрокси-изофлавон - предотвращает развитие рака кожи, индуцированного ультрафиолетом, посредством действия на АТФ-связывающие сайты протеинкиназ Cot и МКК4. Примечательно, что исходная молекула даидзеина не способна взаимодействовать с этими белками и не проявляет антиканцерогенной активности в этих условиях.
2.5.12. Бактерицидные свойства флавоноидов
В последние годы наблюдается рост числа бактериальных штаммов, устойчивых к антибиотикам, что создает дополнительные трудности в лечении многих заболеваний. Существует несколько путей решения этой проблемы, включая создание новых лекарственных препаратов или модификацию уже имеющихся, что дает возможность лишь кратковременной передышки. Перспективными являются подходы, предполагающие создание вспомогательных агентов, направленных на подавление механизмов бактериальной устойчивости, или агентов, способных повышать устойчивость организма человека к бактериальной инфекции. Для развития этих направлений большое значение имеет поиск природных продуктов с необходимыми свойствами. Растительные материалы, богатые полифенольными соединениями, используются для лечения бактериальных заболеваний в течение многих столетий. Некоторые из них обладают необходимыми способностями снижать вирулентные свойства патогенных штаммов или повышать защитные силы организма. Так, вещества, подавляющие рост бактерий при концентрациях менее 10 мкг/мл, представляют большой интерес для фармакологии. Однако некоторые фавоноиды, например, пандуратин А, способны подавлять рост бактерий в концентрации менее 0,1 мкг/мл, что было показано на Staphylococcus aureus(табл. 17).
Таблица 17. Десять наиболее активных антибактериальных флавоноидов.
Флавоноид |
Грам (+) |
Грам (-) |
Флавоноид |
Грам (+) |
Грам (-) |
Panduratin A |
0,06-2,0 |
- |
Sepicanin A |
1,2 |
- |
Isobavachalcone |
0,3-0,6 |
0,3-39 |
Isolupalbigenin |
1,6-3,1 |
- |
Bartericin A |
0,6-2,4 |
0,3-39 |
Flavone |
7,8-31,3 |
1,95-31,3 |
Scandenone |
0,5-0,8 |
2,0-32 |
3'-O-methyl-diplacol |
2,0-4,0 |
> 32 |
Kaempferolrhamnoside |
0,5-16 |
> 16 |
Licochalcone A |
2,0-8,0 |
- |
Примечание. Представлены минимальные концентрации веществ в мкг/мл, ингибирующие рост грамотрицательных и грамположительных бактерий.
Существует несколько теорий, объясняющих механизм антибактериального действия полифенольных соединений. Предполагается, что катехины способны повреждать плазматическую мембрану бактерий вследствие инициации продуцирования перекиси водорода клетками хозяина. Так, была показана антимикробная активность катехинов (0,5 мг/мл) в отношении штаммов актиномицетов и кандиды, связанная с продукцией перекиси водорода. Используя этот эффект, был создан бактерицидный гель, содержащий катехины. Однако данный механизм не универсален. Напротив, благодаря своим антиоксидантным свойствам, экстракты растений, содержащих полифенольные соединения, способны также защищать бактерии от действия перекиси водорода. Имеются также примеры независимого антиоксидантного и бактерицидного действия растительных полифенолов. Так, экстракт из ствола тропического растения Schotia latifolia, содержащий большое количество проантоцианидов и таннинов, обладает мощным антиоксидантным действием, в результате чего из среды эффективно удаляются такие агенты, как перекись водорода, окись азота, продукты окисления липидов. Несмотря на это, указанный экстракт проявлял также антибактериальную активность в отношении как грамотрицательных, так и грамположительных бактерий.
Имеются свидетельства того, что антибактериальная активность флавоноидов связана с повреждением плазматической мембраны бактерий, в результате чего происходит выход калия из цитоплазмы, как это было показано на примере галандина, бактерицидного флавоноида из прополиса. Нарушения в структуре мембран бактериальной стенки и лизис клеток, связанный с дезорганизацией липотейхоевых кислот в оболочке Staphylococcus aureus, наблюдались также при действии бактерицидного катехина зеленого чая EGCG.
Еще одной причиной бактериостатического и даже бактерицидного действия полифенолов может быть способность этих агентов инициировать агрегацию клеток и повреждение мембран. Аналогичное действие было обнаружено также на липосомах из фосфатидилхолина, обработанных EGCG. Другие катехины, обладающие меньшей бактерицидной активностью, не вызывали такого действия на клетки или липосомы. Агрегация липосом из различных фосфолипидов наблюдалась также при действии изофлавонов. Некоторые флавоноиды, например, кверцетин, катехин, таксифолин, способны инициировать агрегацию и даже медленное слияние мембран в присутствии катионов железа, которые могут образовывать мостики между двумя молекулами флавоноидов, «заякоренными» в соседних мембранах. Катионы кальция могут способствовать процессу адгезии мембран, поскольку они образуют мостики между фосфатными группами липидов. Агрегация клеток может приводить к подавлению их роста и гибели вследствие снижения доступа питательных веществ и накопления продуктов жизнедеятельности. Кроме того, в присутствии EGCG возможна агрегация не только клеток, но также отдельных белковых молекул, выделенных из бактерий, в результате чего наблюдается подавление их ферментативной активности.
Было обнаружено, что некоторые флавоноиды способны специфически взаимодействовать с определенными белками бактериальных клеток, вызывая нарушение их функционирования. Так, эпикатехин-галлат (ECG) способен проникать через оболочку Staphylococcus aureus и нарушать функционирование пенициллинсвязывающего белка, что повышает чувствительность пенициллин-устойчивых штаммов к антибиотикам пенициллинового ряда. Флавоноид галангин (galangin) из альпинии лекарственной (Alpiniaofficinarum) способен преодолевать устойчивость Staphylococcus aureus к антибиотикам, связанную с активностью Р-лактамазы, фермента, определяющего устойчивость бактерий к антибиотикам (пенициллины, цефалоспорины и др.). Аналогичной, хотя и менее выраженной активностью обладают также кверцетин и байкалеин.
Флавоноиды могут нарушать работу генетического аппарата бактериальных клеток. Так, катехины, особенно EGCG, способны ингибировать активность гиразы бактериальной ДНК, взаимодействуя с АТФ-связывающим сайтом этого белка. Высокая активность EGCG связана с тем, что бензопирановое кольцо этого катехина способно глубоко проникать в активный сайт гиразы. Соевые изофлавоны способны инактивировать топоизомеразы I и II в цитоплазме Staphylococcus aureus, что приводит к более чем двукратному снижению количества ДНК и РНК в клетке. Антибактериальная активность кверцетина и апигенина связана со способностью этих флавоноидов ингибировать D-аланил-D- аланин-лигазу (D-Ala-D-Ala-ligase) путем конкурентного взаимодействия с сайтом связывания ДНК этого фермента. Флавоноиды морин, силимарин (silymarin), байкалеин, силибинин (silibinin), римантадин (rimantadin, не путать с известным антивирусным агентом ремантадином), амантидин (amantidin) и эпикатехин способны ингибировать АТФ-синтазы F1F0 мембран E. coli, нарушая таким образом энергетику клетки.
Флавоноиды способны нарушать функционирование различных ферментов, участвующих в синтезе мембранных липидов бактерий. Так, экстракт полифенолов из листьев клена усеченного (Acer truncatum), произрастающего в Китае и Корее, ингибируют бета-оксоацил-протеин- редуктазу (FabG), участвующую в NADPH-зависимом синтезе жирных кислот у бактерий. Флавоноиды препятствуют взаимодействию NADPH с этим ферментом. В результате этого наблюдается сильный цитотоксический эффект не только в отношении грамположительных и грамотрицательных бактерий, но также некоторых грибков. Кверцетин, апигенин и сакуранетин (sakuranetin - флавонон, присутствующий в рисе) способны подавлять активность бета-гидроксиацил-переносящего белка (HpFabZ) из Helicobacter pylori благодаря гидрофобному взаимодействию с субстрат-связывающими сайтами этого белка, участвующего в синтезе липидов мембраны. Флавоноиды бутеин (butein), изоликвиртигенин (isoliquirtigenin) и фисетин (fisetin) подавляют рост различных бактерий, включая Mycobacterium tuberculosis, благодаря ингибированию дегидратазы Rv0636, участвующей в работе синтазы жирных кислот (FAS-II), необходимых для производства мембранных липидов в клетке. Флавоноиды нарингенин, эриодиктиол и таксифолин способны подавлять активность бета-кетоацил-переносящей синтазы (KAS), участвующей в биосинтезе жирных кислот бактерий. Благодаря этому указанные флавоноиды проявляют бактерицидное действие в отношении Enterococcus faecalis.