ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 1. ВАЖНЕЙШИЕ ФЛАВОНОИДЫ
1.4. Флавонолы
Флавонолы являются наиболее распространенными представителями флавоноидов в природе (рис. 10). Они присутствуют в различных овощах и фруктах. Их ежедневное потребление обычно составляет 20-50 мг. Молекулы флавонолов представлены как агликонами, так и разнообразными формами гликозидов, в которых гликозидная часть прикреплена к атому кислорода, преимущественно в положениях 3, 7, 3’, 4’. В состав гликозидов могут входить не только глюкоза и манноза, но также более редкие сахара, такие как аллоза, галактуроновая кислота, апиоза.
Рис. 10. Наиболее значимые флавонолы.
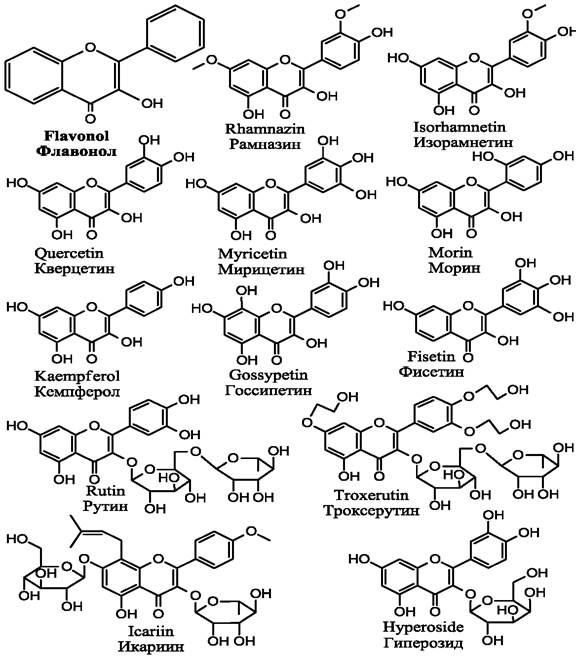
1.4.1. Кверцетин и рутин
Кверцетин и его гликозид рутин являются одними из наиболее известных и хорошо изученных флавонолов, которые широко распространены в растительном мире. Название «кверцетин» происходит от латинского quercus - дуб, в древесине и коре которого присутствует это вещество. Больше всего кверцетина содержится в чае (до 2500 мг/кг сухих листьев). В значительно меньших количествах он присутствует в яблоках, репчатом луке (особенно в красном), в красном винограде, цитрусовых, томатах, брокколи и др.
Считается, что кверцетин может оказывать положительное влияние на метаболизм, препятствуя развитию ожирения. Этот механизм связан с активацией апоптоза преадипоцитов, клеток-предшественников жировой ткани, препятствующего отложению жира в организме. Молекулярный механизм этого явления основан на повышении фосфорилирования аденозин- монофосфат-активируемой протеинкиназы и ее субстрата ацетил-СоА карбоксилазы, в результате чего происходит нарушение процессов регуляции пролиферации адипоцитов.
Считалось также, что кверцетин способен препятствовать развитию диабета, однако попытки воспрепятствовать падению чувствительности клеток к инсулину, развивающейся в процессе ожирения, потерпели неудачу. Таким образом, была поставлена под сомнение антидиабетическая активность кверцетина.
Было показано, как на животных моделях, так и в экспериментах на человеке, что кверцетин может проявлять противовоспалительное действие и препятствовать развитию атеросклероза. Он может также препятствовать пролиферации клеток опухолей, снижает экспрессию факторов риска сердечно-сосудистых заболеваний (SSA и фибриногена) и рассматривается как агент, способный подавлять развитие процессов атеросклероза. В экспериментах на животных было показано, что гликозид кверцетина quercetin-3-O-beta-D-glucuronide, полученный из гречишника или горца (Polygonum perfoliatum L.), обладает противовоспалительной и антивирусной активностью в отношении вируса гриппа А. В экспериментах на животных было показано, что кверцетин может быть эффективен при лечении астмы аллергической этиологии. Эмульсии, содержащие кверцетин, способны подавлять воспалительные и аллергические процессы в дыхательных путях мышей. Было обнаружено, что кверцетин способен связываться с рецепторами серотонина и конкурентно ингибировать влияние серотонина на воспалительные процессы.
В экспериментах на добровольцах было показано, что кверцетин способен положительно влиять на состояние пациентов, страдающих от воспалительного и окислительного стресса, но не оказывает заметного действия на здоровых людей. Метаболические трансформации кверцетина в организме человека могут существенно влиять на его активность. Так, было обнаружено, что кверцетин является активным ингибитором образования лейкотриена В4 в лейкоцитах, что может объяснять его антивоспалительную активность. Эта активность определяется наличием двойной связи между углеродами 2-3 в кольце С. Сульфатирование или метилирование гидроксильной группы углерода 3 снижает эту активность более чем на 50 %, тогда как гликозилирование этой группы полностью снимает активность кверцетина.
Кверцетин может проявлять антиканцерогенную активность, инициируя апоптоз клеток рака легких человека посредством индукции гена апоптоза Bax. Наблюдается подавление роста клеток рака мочевого пузыря человека за счет увеличения проводимости Са2+-активируемого калиевого канала (MaxiK channel), что приводит к гиперполяризации плазматичекой мембраны и тормозит клеточную пролиферацию. Высокая токсичность кверцетина в отношении некоторых видов раковых клеток проявляется на различных стадиях клеточного цикла. Кверцетин способен мимикрировать сигнал 17-β-эстрадиола, вызывая апоптоз клеток рака прямой кишки человека путем увеличения экспрессии онкосупрессорного белка PTEN. Кверцетин также способен влиять на экспрессию супрессора опухолей белка р53, вызывая гибель клеток опухоли. Показано, что через р53-зависимый механизм кверцетин способен останавливать деление клеток и инициировать процессы апоптоза, действуя на митохондрии. Остановка клеточного деления происходит путем активации каспазного сигнального каскада и осуществляется через сигнальные пути митохондрий. Известно, что клетки рака простаты обладают чрезвычайно высокой инвазивной активностью, что способствует быстрому метастазированию опухоли. В этом процессе участвует сериновая протеаза uPA. Было показано, что кверцетин подавляет экспрессию этой протеазы, а также ряда других белков, участвующих в активации метастазирования раковых клеток. Кверцетин способен ингибировать целый ряд протеинкиназ, участвующих в процессах канцерогенеза. Многочисленные исследования антиканцерогенной активности кверцетина, проведенные большей частью in vitro, свидетельствуют о том, что он не обнаруживает никакого токсического эффекта в отношении здоровых клеток. Так, на клетках опухоли груди показано, что кверцетин усиливает действие лекарственного препарата доксорубицина, тогда как токсическое действие
доксорубицина на здоровые клетки, наоборот, ослабляется в присутствии кверцетина. Для усиления действия кверцетина на опухоли желательно использовать высокие концентрации этого агента, однако он плохо растворим в воде. Существенного повышения растворимости можно достичь, используя мицеллярные наночастицы из полиэтиленгликоля и модифицированного капролактона.
Несмотря на многочисленные исследования действия кверцетина на животных и добровольцах, полномасштабных клинических испытаний, подтверждающих возможность использования кверцетина или его гликозидов в качестве лекарственных веществ, недостаточно. Американское агентство по контролю за продуктами питания и лекарствами (FDA) до настоящего времени не признало за кверцетином какого-либо лекарственного действия.
1.4.2. Мирицетин
Мирицетин присутствует в красном вине. Он является агонистом эстрогенов для рецепторов, присутствующих в клетках рака молочной железы и препятствует пролиферации клеток опухоли. Мирицетин увеличивает биодоступность тамоксифена, лекарственного вещества, также действующего на рецепторы гормонов клеток молочной железы. Таким образом объясняется, хотя бы отчасти, способность красного вина снижать риск развития рака молочной железы у женщин. В экспериментах на животных обнаружено, что мирицетин влияет на биодоступность некоторых лекарственных веществ, например, замедляет выведение из организма α- и β-адреноблокатора карведилола, используемого в лечении ряда сердечно-сосудистых заболеваний (ишемия миокарда, гипертония и др.). Этот эффект связан с подавлением активности некоторых форм цитохрома P450, ответственных за экскрецию ксенобиотиков.
Мирицетин не только снижает уровень глюкозы при диабете, но также оказывает защитное действие на почки у крыс с нефропатией, развившейся на фоне искусственно вызванного диабета. Мирицетин препятствует развитию гломерулосклероза и снижает содержание белка в моче. Фенольные соединения красного вина пицеатаннол и мирицетин способны индуцировать апоптоз культуры клеток лейкемии и гепатомы человека. Примечательно, что обнаружен синергизм в действии этих веществ. Благодаря наличию прямого ингибирующего действия на ряд протеинкиназ, мирицетин оказывает хемопротекторное влияние на развитие рака кожи, индуцированного действием ультрафиолета у мышей. Он также тормозит развитие ангиогенеза, индуцированного ультрафиолетовым облучением, и препятствует формированию морщин и снижению уровня коллагена в коже.
Мирицетин является мощным антиоксидантом. Он способен ингибировать повреждение ДНК и замедляет формирование радикалов гидроксила, инициированное пероксинитритом. Мирицетин препятствует развитию рака прямой кишки, инициируемого 1,2-диметилгидразином у экспериментальных животных. Это действие связано со способностью мирицетина защищать клетки от окислительного стресса и повреждения ДНК. Наблюдаемый эффект объясняется не только антиоксидантными свойствами самой молекулы мирицетина, но также способностью мирицетина активировать продукцию антиоксидативных энзимов, таких как каталаза, глутатионпероксидаза, а также стимулировать защитную функцию печени.
Имеются свидетельства антиканцерогенной активности мирицетина. Так, показано, что мирицетин способен не только инициировать гибель клеток рака поджелудочной железы в экспериментах in vitro, но также вызывает уменьшение размеров опухоли и препятствует развитию метастазирования у экспериментальных животных. Это действие, возможно, связано со способностью мирицетина снижать активность протеинкиназ PI3. Мирицетин препятствует пролиферации клеток гепатомы и инициирует остановку деления клеток в фазе G2/M. При этом наблюдается увеличение концентрации белков каскада р53/р21 и снижение активности циклинов комплекса B/Cdc2, что может служить объяснением остановки клеточного деления.
Мирицетин оказывает благотворное влияние на нервную систему. Обнаружено, что мирицетин может препятствовать фосфорилированию митоген-активирующих протеинкиназ (МАРК) и оказывает защитное действие на нервные клетки при действии токсинов, нарушающих окислительное фосфорилирование в митохондриях. Мирицетин является природным регулятором металл-зависимой агрегации амилоидных белков, участвующих в развитии болезни Альцгеймера. Мирицетин и кверцетин защищают нервные клетки мозга при ишемических повреждениях, приводящих к недостатку глюкозы и кислорода. В этих условиях обычно происходит накопление свободных радикалов и наблюдается набухание клеток. Указанные флавоноиды препятствуют развитию этих процессов, вероятно, благодаря тому, что они препятствуют повышению концентрации ионов кальция в цитоплазме.
1.4.3. Морин
Морин представляет собой вещество желтого цвета. Его получают из плодов декоративного растения маклюры оранжевой (Maclura pomifera), родиной которого являются южные и средние широты Северной Америки, культивируемого сейчас на всех континентах. Кроме того, морин присутствует в плодах тропического растения фустик (Maclura tinctoria), которые раньше использовались для окрашивания тканей в цвета хаки, а также в листьях гуаявы (Psidium guajava), фруктового растения, произрастающего в тропических районах Азии, Африки и Америки.
Исследования показали, что морин предположительно может использоваться в лечении остеоартрита, поскольку обладает сильным противовоспалительным действием. Морин снижает продукцию окиси азота путем ингибирования экспрессии NO-синтазы (iNO) и синтетазы простагландинов (COX-2). Морин препятствует образованию амилоида из амилоидного полипептида - амилина (IAPP), и разрушает уже сформированные амилоидные фибриллы в островках поджелудочной железы, которые возникают при диабете второго типа. Этим действием не обладают мирицетин, кемпферол или кверцетин. Морин является ингибитором киназы гликоген-синтазы 3β (GSK3β), ответственной за гиперфосфорилирование тау-белка в мозге человека. В результате избыточного фосфорилирования тау-белок образует клубки в нейронах (нейрофибриллярные клубки), вызывающие нейродегенеративные расстройства, называемые таупатиями. К их числу относятся болезнь Альцгеймера, прогрессирующий надъядерный паралич, болезнь Пика - заболевания, сопровождающиеся существенными ментальными расстройствами, слабоумием и нарушениями двигательной активности, наступающими в среднем и пожилом возрасте. Предполагается, что обнаруженная недавно способность морина препятствовать этим процессам in vitro, требует дальнейших исследований. Морин проявляет также нейропротекторную активность при заболеваниях Паркинсона. Действие морина связано не только со снижением уровня продуктов перекисного окисления в мозге, но и с подавлением явлений апоптоза. Морин выполняет гепатопротекторную функцию в отношении животных с алкогольной интоксикацией, снижает накопление продуктов перекисного окисления липидов, приводит к норме уровень билирубина и ряда других маркеров патологии печени. Морин улучшает функционирование почек и выведение уратов, что было показано на животных с экспериментальной гиперурикемией и ренальной дисфункцией. Морин защищает клетки от окислительного стресса, инициированного гамма-радиацией. Наблюдается не только общее снижение количества продуктов перекисного окисления, но также защита мембранных липидов и ДНК от повреждений, вызванных радиацией. Кроме того, благодаря ингибированию ряда протеинкиназ, морин снижает уровень апоптоза клеток при воспалительных процессах.
1.4.4. Кемпферол
Свое название кемпферол получил от декоративного цветкового растения кемпферии (Kaempferia galanga), относящегося к семейству имбирных. Кемпферол присутствует в очень многих растениях, употребляемых в пищу. К ним относятся различные луковичные (лук-порей, репчатый лук), хрен, полынь эстрагон, пекинская капуста, брюссельская капуста, зеленая кочанная капуста, горчица, брюква, брокколи, огурец, тыква, земляника (клубника), салат латук, яблоки, оливковое масло, петрушка, крыжовник, ежевика, малина, клюква, брусника, томаты, картофель, шпинат, виноград и многие др. Он присутствует также во многих лекарственных растениях. В значительных количествах кемпферол можно получать из семян чая, которые содержат несколько гликозидов кемпфе- рола. Агликон кемпферола получают путем энзиматического отщепления гликозидной части молекулы. Доклинические исследования показали, что кемпферол обладает большим спектром полезных свойств, которые в перспективе могут быть использованы в медицине.
Кемпферол инициирует апоптоз клеток рака яичников, благодаря активации супрессора опухоли белка р53 и белков апоптоза Bad и Bax. Он также индуцирует апоптоз клеток феохромоцитомы крыс благодаря подавлению активности NADPH-оксидазы и ингибированию сигнального пути NOX-JNK. Благодаря антиоксидантной активности кемпферол повышает сопротивляемость организма действию окислительного стресса в процессе развития канцерогенеза. Кемпферол снижает иммунный ответ дендритных клеток - лейкоцитов, ответственных за развитие иммунного ответа, и таким образом проявляет иммуносупрессорную активность. В ряду исследованных флавоноидов кемпферол проявлял наибольшую активность в снижении продукции цитокинов дендритными клетками. При этом подавлялась также активация тимоцитов. Предполагается, что кемпферол может быть использован в лечении хронических воспалительных и аутоиммунных заболеваний.
Антивоспалительное и антиаллергенное действие кемпферола может объясняться тем, что он может подавлять способность моноцитов производить хемокины - белковые аттрактанты для фагоцитов, регулирующие развитие иммунного ответа и воспалительного процесса в ответ на внедрение антигенов, в частности на присутствие липополисахаридов оболочек бактерий. Он также подавляет митоген-активируемые протеинкиназы (MAPC). В результате этого наблюдается подавление активности Т-хелперных клеток (Th1 и Th2).
Кемпферол препятствует развитию колитов у мышей в условиях эксперимента. При этом в кишечнике снижается содержание NO и ряда цитокинов, ответственных за воспалительные процессы. Кемпферол улучшает барьерные функции кишечного эпителия благодаря повышению экспрессии белков плотных контактов, а также способствует взаимодействию белков плотных контактов (ZO-1, ZO-2, окклюдина, клаудинов) с актином, входящим в состав клеточного цитоскелета, что снижает проницаемость эпителия и регистрируется по повышению электрического сопротивления.
Кемпферол-3-О-софорозид, обнаруженный в листьях горного женьшеня, обладает антиопухолевой, антиаллергической, антивоспалительной активностью. Эта активность связана со способностью подавлять высвобождение клетками иммунной системы белка HMGB1, регулирующего содержание цитокинов, ответственных за развитие воспалительных процессов.
Кемпферол препятствует развитию атеросклероза. В экспериментах на животных показано, что кемпферол уменьшает размеры атеросклеротических бляшек, улучшает процессы вазорелаксации. Это действие связано со способностью кемпферола снижать экспрессию провоспалительных цитокинов (остеопорин и относящийся к нему путь дифференциации - кластер 44).
Кемпферол способен защищать нейроны подкоркового ядра, называемого «черная субстанция», разрушение которого в условиях экспериментального воздействия нейротоксинами приводит к развитию болезни Паркинсона. При этом было обнаружено, что кемпферол восстанавливал до нормального уровня концентрацию допамина, повышал уровень супероксиддисмутазы и глютаматпероксидазы и снижал содержание малонового диальдегида - токсина, являющегося индикатором процессов перекисного окисления липидов. При этом существенно улучшалась координация движений животных.
Кемпферол защищает β-клетки поджелудочной железы от хронической гипергликемии как in vitro, так и непосредственно в островках поджелудочной железы экспериментальных животных. Действие проявляется при наномолярных концентрациях кемпферола (оптимум при 10 нМ). При этом восстанавливается до нормы экспрессия антиапоптозных белков Akt и Bcl-2. Более того, восстанавливается нормальный уровень внутриклеточного АТФ и цАМФ, который обычно снижен при указанной патологии. Таким образом, кемпферол возможно является природным антидиабетическим средством, способным защищать β-клетки поджелудочной железы, что может препятствовать развитию диабета второго типа. Как было показано в экспериментах на животных, кемпферол может проявлять защитное действие против ожирения и остеопороза благодаря способности регулировать процессы транскрипции генов, ответственных за дифференциацию проадипоцитов - клеток-предшественников жировой ткани. Одновременно наблюдалось снижение потери кальция костной тканью - главной причины остеопороза.
Кемпферол обладает активностью против вируса японского энцефалита (энцефалит В), распространяемого комарами в странах Южной Азии и характеризующегося высоким летальным исходом. Кемпферол способен связываться с определенными сайтами вирусной РНК, останавливая таким образом распространение инфекции.
Как и многие другие полифенольные соединения, кемпферол плохо растворим в воде, что затрудняет достижение высоких концентраций этого агента в крови. Для преодоления этого недостатка предлагается технология создания наночастиц кемпферола, что позволяет существенно повысить его концентрацию в водных растворах. При этом существенно возрастает антиоксидантная активность кемпферола.
1.4.5. Фисетин
Фисетин присутствует во многих растениях, которым он придает окраску желтого или красновато-желтого цвета. Он содержится в плодах манго (Mangifera indica), землянике или клубнике, чернике, а также в некоторых бобовых деревьях, произрастающих в Мексике и на юге США, например акации (Acacia greggii, Acacia berlandieri), гледичии (Gleditsiatriacanthos), бутии (Butea monosperma) произрастающих на юге Азии (Вьетнам, Пакистан, Таиланд, Индонезия), в хвойном дереве калитопсисе (Callitropsis nootkatensis), относящемся к семейству кипарисовых и произрастающем в Северной Америке, в дереве квебрахо, произрастающем в Южной Америке (Schinopsis lorentzii), в японском восковом дереве (Rhus succedanea), которое является одним из источников получения фисетина для нужд фармакологии.
Большое внимание фисетин привлекает как антиканцерогенный агент. Так, фисетин индуцирует апоптоз клеток HeLa рака шейки матки посредством активации регуляторного пути каспазы-8 и каспазы-3. В исследовании клеток рака молочной железы показано, что мишенью фисетина служат каспазы-7,-8 и -9. Фисетин активировал также белок р53, хотя апоптоз по этому пути ингибировался пан-каспазой z-VAD-fmk. В исследовании клеток рака простаты обнаружено, что мишенью фисетина был фактор некроза опухолей TRAIL, активация которого вызывала апоптоз клеток опухоли.
При действии на клетки рака легких фисетин оказывал влияние на несколько путей сигнализации, приводящих к гибели клеток: путь фосфатидилинозитол-3-киназы Akt, а также парамицин-чувствительный сигнальный путь mTOR. На клетках рака простаты фисетин также вызывал подавление сигнального пути mTOR и инактивацию пути фосфатидилинозитол-3-киназы Akt. При действии на клетки меланомы фисетин нарушал сигнализацию по пути Wnt/beta-catenin и, в результате этого, подавлял фактор транскрипции Mitf, что приводило к остановке клеточной пролиферации. При действии на клетки рака мочевого пузыря фисетин останавливал клеточное деление и инициировал апоптоз посредством активации р53 и ингибирования сигнального пути ядерного фактора транскрипции B-лимфоцитов (NF-kB), контролирующего экспрессию генов апоптоза, иммунного ответа, а также регулирующего цикл клеточного деления. Способность ингибировать NF-kB позволяет фисетину атаковать также хеморезистентные клетки рака поджелудочной железы. На клетках лейкемии наиболее эффективными были мирицетин и фисетин, которые ингибировали топоизомеразы I и II. При этом фисетин действовал как каталитический ингибитор обоих ферментов.
Фисетин проявляет противовоспалительное и антиаллергическое действие и, предположительно, может использоваться в лечении астмы. Как было показано в нескольких независимых исследованиях, действие фисетина связано со способностью подавлять активность NF-kB. В присутствии фисетина наблюдается снижение количества эозинофилов в легких, снижается содержание мукуса и активность NO-синтазы, что свидетельствует о подавлении воспалительных процессов в легких. В работе с иммунными клетками соединительной ткани мастоцитами («тучные клетки») также было обнаружено снижение их активности в присутствии фисетина, что связано с подавлением активности NF-kB и МАРК (митоген-активируемой протеинкиназы), регулирующих деление, дифференцировку и апоптоз клеток. Фисетин влиял на межклеточное взаимодействие и подавлял способность клеток НМС-1 активироваться при взаимодействии с мембранами активных Т -клеток, что препятствовало развитию иммунного ответа. Фисетин также способен снижать продукцию цитокинов воспаления: интерлейкинов TNF-α, хемоаттрактантов моноцитов МСР-1, фактора эндотелиального роста VEGF. Фисетин снижает фосфорилирование поверхностной сигнал-регулируемой киназы (ERK). При этом в экспериментах на животных существенно подавляется развитие процессов ревматоидного артрита.
В исследовании нейропротекторного действия фенольных соединений на животных с болезнью Паркинсона фисетин оказался неэффективным. Однако оказалось, что фисетин способен улучшать память. Было обнаружено, что фисетин индуцирует фосфорилирование элемент- связывающего белка CREB, активатора транскрипции, участвующего в таких процессах, как эмбриональное развитие, контроль роста и поддержание гомеостаза клеток. При этом наблюдалась потенциация гиппокампа мозга мышей. Животные лучше различали объекты, у них улучшалась долговременная память. Кроме того, фисетин способен действовать как антидепрессант. Под действием фисетина во фронтальной коре и гиппокампе увеличивается содержание серотонина и норадреналина, снижается активность моноаминоксидазы.
Фисетин способствует сохранению функций мозга у стареющих животных. Этот эффект достигается благодаря тому, что фисетин не только сам проявляет антиоксидантную активность, но также увеличивает концентрацию в мозге главного внутриклеточного антиоксиданта глутатиона. Он также защищает митохондрии от действия окислительного стресса, проявляет противовоспалительную активность в отношении клеток микроглии, снижает содержание продуктов окисления липидов за счет подавления активности 5-липоксигеназы, способной окислять полиненасыщенные липиды. В качестве антиоксиданта фисетин способен защищать мозг от повреждающего действия химических окислителей.
1.4.6. Изорамнетин
Изорамнетин присутствует лишь в некоторых растениях. Прежде всего, необходимо упомянуть, что изорамнетином богаты ягоды облепихи (Hippophae rhamnoides L.), которые в течение столетий использовались в лечении ишемических заболеваний и при нарушении кровообращения. Экстракты облепихи могут действовать также как иммуномодулирующее, антистрессовое, противораковое, антисептическое и ранозаживляющее средство. Изорамнетин присутствует также в луке (Allium cepa L.). Он содержится в винограде и присутствует в вине.
К растениям, содержащим изорамнетин, принадлежат некоторые виды маревых (род Chenopodium). Изорамнетин содержит горец перечный (Persicaria hydropiper), повсеместно растущий в странах Европы и Азии и широко используемый в медицине как противовоспалительное, кровоостанавливающее и ранозаживляющее средство. Кроме того, следует упомянуть крестовник (Senecio cineraria), солерос европейский (Salicornia herbacea), горичник Мариссона (Peucedanum Morissonii L.), произрастающий в Горном Алтае, Западной Сибири, Средней Азии, а также растущее в Мексике пряное растение, называемое мексиканским эстрагоном (Tagetus lucida), принадлежащее к семейству подсолнечниковых. Мексиканский эстрагон является психоделиком и оказывает галлюциногенное действие. В небольших количествах настой этого растения использовался как успокоительное и слабительное средство.
Изорамнетин проявляет антиканцерогенные свойства, инициируя апоптоз клеток миелоидной эритролейкемии. При этом наблюдается фрагментация ДНК и расщепление PARP-белков, участвующих в репарации ДНК. Кроме того, повышается активность каспаз - протеаз, участвующих в апоптозе. Изорамнетин подавляет развитие рака кожи, индуцированного фактором роста эпидермиса, поскольку подавляет активность циклооксигеназы-2, ответственной за превращение арахидоновой кислоты в эндопероксид простагландина Н2, что может приводить к подавлению воспалительных процессов. Кроме того, изорамнетин ингибирует митоз, подавляя активность киназ MAP и EPK. Главными мишенями изорамнетина являются киназа MEK и фосфоинозитид-3-киназа PI3-K. Изорамнетин ингибирует цитотоксическое действие клеток карциномы прямой кишки, а также препятствует пролиферации и вызывает апоптоз клеток опухоли.
Изорамнетин способен защищать здоровые клетки, например, кардиомиоциты, от повреждающего действия перекиси водорода, подавляя митохондриальные пути апоптоза. Указанное действие связано со снижением концентрации активных форм кислорода и, следовательно, с подавлением MAPK-зависимого пути апоптоза. Это позволяет считать изорамнетин перспективным агентом в лечении кардиомиопатий. Изорамнетин также защищает кардиомиоциты от повреждения в условиях экспериментальной ишемии. Это действие связано со снижением активности лактатдегидрогеназы и подавлением процессов апоптоза. Антиоксидантная активность изорамнетина связана также со способностью этого агента согласованно регулировать экспрессию различных компонентов клеточной защиты от окислительного стресса. Так, наблюдается повышение экспрессии супероксиддисмутазы, каталазы, глутатионредуктазы и гем-оксигеназы-1. Подавляется активность миелопероксидазы - генератора гипохлорной кислоты в клетке.
Изорамнетин, а также изокверцитрин из горца перечного (Persicaria hydropiper), способны ингибировать дифференциацию адипоцитов благодаря подавлению генов сигнального пути Wnt/beta-catenin в печени, что может быть использовано в лечении ожирения.