ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 1. ВАЖНЕЙШИЕ ФЛАВОНОИДЫ
1.5. Флаваноны
Флаваноны (рис. 11) способны к стереоизомерии, поскольку обладают одним хиральным центром, расположенным у атома углерода 2, и могут образовывать два энантиомера: S-(-) и R-(+) (рис. 12).
Рис. 11. Некоторые представители флаванонов.
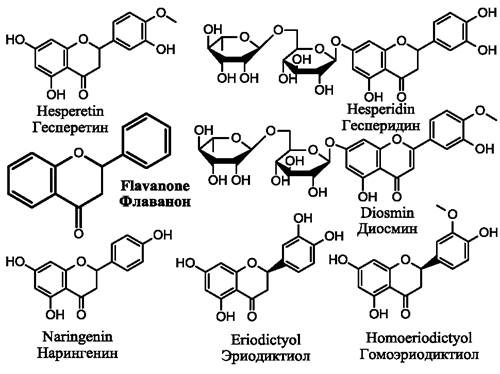
Рис. 12. Энантиомеры флаванонов.
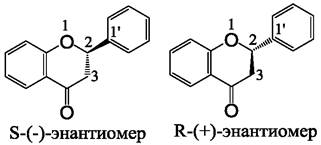
В настоящее время большинство коммерческих флаванонов представлены рацемической смесью энантиомеров. Исключение составляют эриодиктиол и гомоэриодиктиол, выпускаемые компанией «Fluka» (и некоторыми др.) в виде чистого S-(-)-энантиомера. Значение стереоизомерии в действии этих веществ на организм животных и человека пока еще мало изучено.
1.5.1. Гесперетин и гесперидин
Гесперетин и его гликозид гесперидин присутствуют в цитрусовых, в основном в пульпе (губчатой части корок) лимона (Citrus limon), померанца (Citrus aurantium, Linn.) (http://dic.academic.ru), мандарина (подвид: Citrus unshiu Mar.) и апельсина (Citrus sinensis). Другой гликозид гесперитин-7-рамнозид присутствует в кордии (Cordia obliqua), произрастающей в Южной Азии.
Пульпа цитрусовых содержит большое количество гесперидина и каротиноидов (β-криптоксантина), которые потенциально могут оказывать антиканцерогенное действие. Действительно, в экспериментах на животных было показано, что пульпа и соки мандарина могут защищать животных от химически индуцированных форм рака прямой кишки и легких. Наблюдалось также подавление экспрессии провоспалительных цитокинов и ферментов воспалительного процесса. Гесперетин был существенно более активен, чем апигенин и нарингенин в качестве возможного агента при лечении рака молочной железы. Предполагается, что его действие может быть основано на подавлении активности фермента ароматазы, участвующей в конвертировании тестостерона в эстрадиол, что может быть причиной развития канцерогенеза. Гесперидин также оказывал защиту печени и почек от окислительного стресса, возникающего в результате атаки свободными радикалами, накапливающимися в крови экспериментальных животных. При кормлении животных пищей, содержащей гесперидин, снижался уровень перекисного окисления липидов. В тканях повышался уровень АТФ и ферментов цикла трикарбоновых кислот.
Хотя в исследовании здоровых клеток наблюдалась защита от окислительного стресса, на клетках рака прямой кишки человека было показано, что гесперетин инициирует апоптоз, вызванный тем, что в клетках повышается содержание продуктов окисления липидов и белков. При этом активность внутриклеточных антиокидаз: супероксиддисмутазы, каталазы, глютатионпероксидазы, снижалась. Нарушается баланс прооксидантов/антиоксидантов в результате воздействия гесперетина на митохондриальный путь регуляции Bax. В течении суток гибло более 50 % раковых клеток при концентрации гесперитина 70 нМ, что свидетельствует о высокой антиканцерогенной активности этого агента в экспериментах in vitro. Гесперетин также вызывает апоптоз клеток карциномы в результате действия на мембранный рецептор Notch-1, в результате чего происходит подавление экспрессии фактора транскрипции (achaete-scute complex-like 1) и паратиреоидного секреторного белка хромогранина А, являющегося предшественником ряда пептидных гормонов эндокринной системы. Апоптоз усиливается также в результате индукции гесперетином супрессора опухолей, белка р53 и ингибирования фактора контроля транскрипции NF-kB. Кроме того, гесперидин возможно проявляет свое действие, используя ядерный
рецептор PPAR-gamma (PPAR-y), ответственный за регуляцию метаболизма жирных кислот и глюкозы. Через этот путь регуляции гесперидин, предположительно, может контролировать отложение жира в организме, препятствуя размножению адипоцитов.
Гесперидин способен защищать эпидермис от повреждающего действия ультрафиолетового излучения диапазона В. При этом наблюдалась способность гесперидина активировать экспрессию «стража генов», фактора транскрипции р53, благодаря чему активируется система репарации ДНК, поврежденной ультрафиолетом. Гесперидин оказывает также гепато- и нефропротективную активность у животных, находящихся под воздействием мощного аллергена ацетаминофена. При этом у животных наблюдалась нормализация экспрессии протеаз, участвующих в развитии воспалительных процессов, а также каспазы-1, каспазы-9, фактора транскрипции NF-kB, фермента, продуцирующего окись азота iNOS и белкового регулятора апоптоза BCL-2.
Гесперидин может служить в качестве антиастматического агента, в качестве агониста цитокинов Th, относящихся к интерлейкину 5, как известно, ответственному за развитие аллергических ринитов и астмы. При действии гесперидина наблюдалось подавление аккумуляции эозинофилов в легких, снижалось накопление эотоксина, продуцирование специфических иммуноглобулинов IgE. Способность гесперидина подавлять астматические процессы в легких экспериментальных животных наблюдалась еще в нескольких лабораториях. Было обнаружено, что гесперидин проявлял большую активность в подавлении астматических процессов, чем нарингенин или широко используемое противовоспалительное средство индометацин. При этом не наблюдалось токсического действия гесперидина.
Гесперидин способен оказывать седативное действие на нервную систему, посредством влияния на опиоидные рецепторы. При этом наблюдается избирательное подавление экстраклеточного сигнального пути через киназу ERK, регулирующую множество клеточных процессов, включая митоз и клеточный рост, а также участвующую в канцерогенезе и развитии вирусной инфекции. Гесперидин способен защищать нервную ткань от повреждений в условиях ишемических поражений. Так, в работах на животных с ишемией гиппокампа показано, что ежедневный прием гесперидина в количествах 100 мг/кг веса существенно улучшал память. При этом снижался уровень перекисного окисления липидов, снижалась концентрация нитритов, повышалось содержание антиоксидантов. Ключевым фактором действия гесперидина вероятно является регуляция содержания окиси азота в тканях. В условиях инсульта у экспериментальных животных было показано, что гесперидин снижал воспалительные процессы в нервной ткани. При этом наблюдалось повышение активности антиоксидантных ферментов: глютатион- пероксидазы, глютатионредуктазы, каталазы и супероксиддисмутазы. Кроме того, наблюдаемое снижение уровня свободных радикалов препятствовало развитию воспалительных процессов и повреждению нервной ткани. Совокупность полученных данных позволяет предполагать перспективность использования гесперидина в лечении нейродегенеративных болезней в качестве «медиатора выживания» нейронов.
Гесперидин оказывает положительное действие на сердечнососудистую систему человека. Только в течение 2011 г. было проведено несколько независимых клинических исследований действия, очищенного гесперидина и апельсинового сока на сердечно-сосудистую систему человека. Показано, что именно гесперидин является причиной оздоровительного действия апельсинового сока, потребление которого (500 мл/день в течение четырех недель) способно существенно снизить величину диастолического давления. При этом наблюдается улучшение профиля экспрессии генов лейкоцитов у здоровых добровольцев. В указанной работе изуали гены лейкоцитов, ответственные за хемотаксис, адгезию, инфильтрацию и метаболизм липидов. Аналогичное действие оказывал также препарат очищенного гесперидина.
Другое независимое клиническое исследование показало, что потребление апельсинового сока, так же как и потребление препарата гесперидина (500 мг/день, три недели) стимулировало продукцию окиси азота эндотелиальными клетками, что улучшало функционирование эндотелия и снижало уровень маркеров воспалительных процессов (сывороточный амилоидный белок А, С-реактивный белок, растворимый Е- селектин) в крови пациентов, страдающих нарушениями обмена веществ - метаболичеким синдромом, который, как известно, характеризуется избыточным весом, нарушениями сердечно-сосудистой системы и инсулинорезистентностью. При потреблении гесперидина увеличивалось фосфорилирование Src, Akt, AMP-киназ, а также эндотелиальной NO- синтазы, что приводило к активации синтеза NO.
Антивоспалительное действие гесперидина может быть связано с его способностью стимулировать продуцирование окиси азота эндотелиальными клетками. Предполагается, что гесперидин обладает васкулопротекторным действием и может использоваться при дисфункциях эндотелия. К аналогичному выводу пришли авторы еще одного исследования действия апельсинового сока и чистого гесперидина на здоровых добровольцев 50-65 лет, которое показало, что гесперидин или сок, потребляемые в течение четырех недель, существенно снижали величину диастолического давления. В другом клиническом исследовании было показано, что использование гесперидина (гликозида гесперетина) не обязательно, поскольку биодоступность гесперетина (агликона гисперидина) очень высока, что связано с его хорошей растворимостью в воде. Так, уже через час после орального потребления 150 мг гесперетина его концентрация в крови человека достигала 10,2 мкМ. При попадании в организм флавоноид гликозилировался или сульфатировался. Поэтому в плазме крови присутствовали его производные (hesperetin 7-O-beta-d-glucuronide, hesperetin 3'-O-beta-d-glucuronide, hesperetin sulfate). При этом даже единичного приема гесперетина было достаточно для проявления вазодилаторных эффектов у пациентов. На животных было показано, что именно в печени и аорте наблюдается накопление наибольшего количество гесперетина после его усиленного потребления в течение месяца.
Нельзя не упомянуть, что гесперидин препятствовал также развитию гиперхолестеринемии при диете, богатой холестерином, способствовал снижению веса животных, снижал содержание холестерина в сыворотке крови, препятствовал жировой дегенерации печени. При этом нормализовалась экспрессия ряда маркерных генов, например, маркера ишемии сердечной мышцы, белка, связывающего жирные кислоты в цитоплазме кардиомиоцитов - H-FABR.
1.5.2. Нарингенин
Нарингенин присутствует в грейпфрутах, апельсинах и в кожуре томатов. Клинические исследования показали, что биодоступность нарингенина довольно низка. Так, при потреблении свежих томатов нарингенин практически не усваивается, но при потреблении томатов после тепловой кулинарной обработки или в виде томатной пасты нарингенин попадает в кровь. Наилучшая биодоступность наблюдалась при употреблении сока грейпфрутов. При этом после потребления сока в количестве 8 мл/кг веса испытуемого концентрация нарингенина в крови может достигать 6 мкМ/л. В соке грейпфрутов присутствуют в основном гликозиды нарингенина: нарингенин-7-рамноглюкозид и нарингенин-7- глюкозид. Очищенный нарингенин, также, как и гесперетин, быстро попадает в кровь, и его концентрация в крови может достигать около 7 ммоль/литр после разового потребления 135 мг нарингенина. Известна высокая биодоступность нарингенин-7-О-гликозида, присутствующего в змееголовнике (Dracocephalum rupestre). Недавно были полечны рекомбинантные штаммы E. coli способные продуцировать гликозилированную форму нарингенина: 7-О-гликозил нарингенин, отличающийся повышенной растворимостью в воде и биодоступностью в сравнении с негликозилированным нарингенином. Существенного повышения биодоступности и усиления терапевтического действия нарингенина можно достичь, используя наночастицы для его транспортировки в крови.
Нарингенин проявляет выраженную антиканцерогенную активность. Так, он способен инициировать апоптоз клеток рака легких путем активации экспрессии рецептора цитокинов, а именно - фактора некроза опухолей (TNF), называемого «рецептором клеточной смерти», и соответствующего белкового лиганда TRAIL, инициирующего гибель клеток. Предполагается, что совместная обработка опухоли лигандом TRAIL и нарингенином может оказаться эффективным и безопасным способом подавления канцерогенеза резистентных клеток опухоли рака легких. В экспериментах на животных также было показано, что прием нарингенина с пищей существенно подавляет развитие метастазов в легких. На основе нарингенина недавно был синтезирован новый агент: 5-hydroxy-7,4'-diacetyloxyflavamne-N-phenyl hydrazone, также обладающий активностью в отношении клеток рака легких. Его активность связана с экспрессией лиганда Fas, являющегося одной из форм фактора некроза опухолей (TNF), активацией каспазного каскада и ингибированием соответствующего сигнального пути PI3K/Akt, что приводит к апоптозу клеток рака легких (non-small lung cancer cells). Таким образом, механизм действия этого агента, по-видимому, близок к механизму действия нарингенина. Аналогичный механизм инициации апоптоза нарингенином был обнаружен также в более ранних исследованиях клеток лейкемии человека.
Нарингенин способен инициировать апоптоз некоторых видов раковых клеток, стимулируемых эстрогенами, через иные пути клеточной сигнализации. Например, нарингенин вызывает быстрое отщепление пальмитиновой кислоты (депальмитирование) рецептора эстрадиола на поверхности клеток, что приводит к отсоединению этого рецептора от белка кавеолина, ответственного за эндоцитоз гормона. Кроме того, нарингенин активирует протеинкиназу р38, принадлежащую к семейству митоген-активирующих протеинкиназ MAPC, что вызывает апоптоз клеток опухоли.
Нарингенин способен также препятствовать пролиферации клеток глиомы - одной из форм рака мозга, влияя на белки апоптоза Bcl/Bax. Это ведет к высвобождению цитохрома с из митохондрий, активации сигнального пути Сх43, приводящего к активации каспазы-3 и каспазы-9, и к апоптозу клеток. Нарингенин, а также апигенин способны подавлять канцерогенез прямой кишки. Оба агента инициируют апоптоз. Кроме того, нарингенин способен снижать пролиферацию этих клеток. Было обнаружено также совместное действие нарингенина и альфа- токоферола на клетки рака простаты человека, где эти агенты вызывали апоптоз клеток, детальные механизмы которого еще предстоит исследовать.
Нарингенин может оказывать защитное действие на многие органы и функциональные системы человека. Он оказывает разностороннее благотворное влияние на сердечно-сосудистую систему. Например, обнаружено, что нарингенин может защищать сердечную мышцу от действия токсических веществ. Так, доксорубицин - антиканцерогенный препарат, широко используемый в химиотерапии, способен проявлять сильную кардиотоксичность за счет активации процессов перекисного окисления и апоптоза, что ограничивает его клиническое использование. Нарингенин-7-О-гликозид, полученный из змееголовника (Dracocephalum rupestre), способен защищать кардиомиоциты от токсического действия доксорубицина благодаря экспрессии генов антиоксидантных ферментов клетки. Экспрессия связана с активацией внутриклеточных сигнал- регулируемых киназ ERК-1/2 и транспорта в ядро фактора Nrf2. Выраженная защита сердечной мышцы от токсического действия доксорубицина проявляется при использовании комбинации нарингенина и р-кумариновой кислоты.
Нарингенин, так же, как и гесперетин, оказывает защитное действие на эндотелиальные клетки кровеносных сосудов за счет активации рецептора эстрогена, что приводит к увеличению содержания окиси азота в крови даже при сниженном содержании эстрогенов. Но действие этих агентов несколько различается. Нарингенин активирует как альфа-, так и бета-формы рецепторов эстрогена, тогда как гесперетин активирует предпочтительно альфа-рецептор эстрогенов, что позволяет повышать экспрессию синтазы окиси азота и концентрацию NO.
Нарингенин может приостанавливать развитие атеросклероза у животных, находящихся на так называемой «западной диете», которая характеризуется потреблением красного мяса, очищенных злаков, больших количеств углеводов и жиров. Указанная диета вызывает пятикратное увеличение содержания триглицеридов в крови и восьмикратное увеличение содержания холестерина. При этом наблюдается десятикратное увеличение количества атеросклеротических бляшек в аорте. Потребление нарингенина снижало содержание холестерина и триглицеридов в крови. При этом количество бляшек снижалось более чем на 50 %, содержание жиров в печени снижалось более чем на 80 %, нормализовалось содержание инсулина в крови и исчезали признаки ожирения. Нарингенин- халкон - производное нарингенина, присутствующее в томатах, способно нормализовать функционирование клеток жировой ткани адипоцитов, а также повышать продукцию гормона адипонектина, регулирующего метаболизм глюкозы и жирных кислот и препятствующего развитию инсулинорезистентности, ожирения и диабета. Флавоноиды цитрусовых гесперетин и нарингенин способны снижать выработку жировой тканью адипокинов - цитокинов воспалительных процессов (например, фактора некроза опухолей ТNf-α), которые способствуют высвобождению в кровь свободных жирных кислот, что приводит к инсулинорезистентности и развитию диабета второго типа. Эти флавоноиды переключают клеточный метаболизм на путь расщепления жиров, а также препятствуют продукции антилиполитических ферментов перилипина и РDE3B. Они также препятствовуют разрастанию адипоцитов, отложению в них жира. Напротив, они вызывают апоптоз преадипоцитов и уменьшение объема жировой ткани.
Нарингенин может быть эффективен в лечении диабета. У животных с экспериментально вызванным диабетом введение нарингенина в течение 21 -го дня вызвало существенные улучшения параметров крови, близкие к тем, которые были достигнуты в другой группе больных животных, получавших известный лекарственный препарат гликлазид — антидиабетический препарат второго поколения.
В эксперименте измеряли множество параметров крови. Кроме содержания глюкозы в крови, измеряли также гликозилированный гемоглобин, уровень инсулина, панкреатические антиоксидантные ферменты (супер- оксиддисмутаза, каталаза, глютатионпероксидаза, глютатион-S-трансфераза), а также неэнзиматические атиоксиданты (глютатион, аскорбиновая кислота, альфа-токоферол), продукты перекисного окисления (малоновый диальдегид), активность ферментов аминотрансферазы аланина и аспартата, щелочной фосфатазы, лактатдегидрогеназы. Было показано, что нарингенин так же эффективно, как лекарственный препарат гликлазид, проявлял антигипергликемическое и антиоксидантное действие, а также увеличивал содержание в крови ферментных и неферментных средств защиты организма от окислительного стресса и повышенного содержания глюкозы. Гистопатологические исследования показали способность нарингенина препятствовать развитию патологии поджелудочной железы. В другом исследовании было показано, что нарингенин и кверцетин проявляли кооперативное синергическое действие в защите организма животных от проявлений диабета. Они снижали уровень поврежденной ДНК в крови, печени и почках, а также уровень окислительного стресса, нормализовали гематологические параметры. Повышалась выживаемость животных до 100 %.
Антивоспалительная активность нарингенина позволяет защищать почки больных животных от развития диабетической нефропатии. Это связано с тем, что снижается уровень экспресии фактора некроза опухолей почек (фактор альфа), снижается продукция провоспалительных цитокинов: интерлейкина 1β, интерлейкина 6 и хемоаттрактанта моноцитов белка-1, участвующего в миграции моноцитов из крови и их дифференцировке в макрофаги в процессе развития хронических воспалений. Нарингенин препятствует также развитию фиброза соединительной ткани почек, поскольку снижает экспрессию коллагена IV типа, экспрессию фибронектина - гликопротеина, участвующего в прикреплении коллагена к поверхности клеток, а также экспрессию фактора роста, пролиферации и апоптоза клеток - полипептида TGF-β1.
Нарингенин подавляет воспалительные процессы в дыхательных путях у животных с экспериментально индуцированой астмой. Этот процесс связан с ингибированием активности транскрипционного фактора NF-kB, контролирующего экспрессию генов иммунного ответа и ответственного за развитие воспалительных процессов и аутоиммунных заболеваний. Одновременно снижается уровень некоторых интерлейкинов и иммуноглобулинов IgE, обуславливающих аллергические реакции. Нарингенин-халкон, присутствующий в кожуре томатов, также способен проявлять антиастматическую активность у животных благодаря ингибированию продукции цитокинов Th2, находящихся в T-хелперных лимфоцитах CD4+T.
Нарингенин ингибирует возникновение и распространение сигналов воспаления в нейроглии, что позволяет защищать мозг от воспалительных повреждений, ведущих к дегенерации нервной ткани. При сравнении большого числа флавоноидов (флавоны, флавонолы и антоцианидины) было показано, что нарингенин обладает наиболее выраженным действием. Это связано с его способностью к подавлению экспрессии синтазы окиси азота и снижению концентрации NO в глиальных клетках, ингибированию фосфорилирования митоген-активируемой протеинкиназы МАРК и, соответсвенно, находящегося в конце сигнальной цепи активатора транскрипции STAT-1, активность которого связана с регуляцией иммунотолерантности и канцерогенеза.
Нарингенин может препятствовать интоксикации некоторыми металлами, например, кадмием, свинцом, мышьяком. Кадмий довольно редкий металл, содержание которого в земной коре составляет 0,5 ppm, однако объемы его добычи в течение XX века возросли в несколько десятков тысяч раз и сейчас достигают 20 тыс. тонн в год. Интоксикация кадмием распространена отчасти в связи с неправильной утилизацией никель-кадмиевых аккумуляторов и некоторых других отходов электронной промышленности. Источниками загрязнения кадмием являются также промышленная добыча и переработка цинковых руд. Интоксикация парами кадмия происходит большей частью через легкие. Водорастворимые соли кадмия могут присутствовать в пищевых продуктах. Вначале отравление проявляется в виде лихорадки. При сильном отравлении могут развиваться пневмонии, легочная эдема, возможен смертельный исход. Свинец может вызывать дисфункции органов кровеносной системы, печени и почек. Наиболее чувствительной к интоксикации свинцом является нервная система. Отравление свинцом, присутствующим даже в очень низких концентрациях, приводит к снижению интеллекта и способности к обучению у детей. Несмотря на высокую токсичность мышьяка, его соли используются в европейской медицине уже много столетий, а в китайской медицине - около 5 тыс. лет. Токсичность арсенатов связана с их способностью инициировать окислительный стресс. Арсениты способны также влиять на сигнальную систему клеток, что может инициировать канцерогенез. Нарингенин может приостанавливать процессы окисления, инициированные этими металлами, и снижать негативные последствия окислительного стресса. Так, было обнаружено защитное действие нарингенина при повреждениях печени и почек кадмием. Аналогичное исследование было проведено с использованием свинца и мышьяка. Действие нарингенина было обусловлено не только антиоксидантными свойствами молекулы этого флавоноида и его способностью хелатировать металлы, но прежде всего, способностью нарингенина влиять на регуляторные системы клетки и активировать клеточные механизмы защиты. Наблюдалось повышение содержания в клетках антиоксидантных ферментов: супероксиддисмутазы, каталазы, глутатионпероксидазы, глутатион-S-трансферазы, глутатионредуктазы, глюкозо-6-фосфатдегидрогеназы, щелочной фосфатазы, лактат-
дегидрогеназы, аспартат-трансферазы и др. При этом нарингенин тормозил активность цитохрома Р450 - белка эндоплазматического ретикулума клеток печени и почек, одного из главных агентов детоксикации организма. Поскольку действие этого фермента связано с окислением токсичных органических веществ, торможение его активности могло снижать концентрацию продуктов окисления.
Нарингенин обладает антибактериальной и антивирусной активностью. Так, в условиях эксперимента была обнаружена способность нарингенина и гесперетина подавлять рост золотистого стафилококка (Staphylococcus aureus), устойчивого к антибиотику метициллину. Нарингенин, возможно, способен препятствовать развитию инфекции печени вирусом гепатита С - трудноизлечимой вирусной инфекции, поражающей 3 % человеческой популяции в мире. Исследования на гепатоцитах показали, что эффективность нарингенина в борьбе с вирусной инфекцией сравнима с эффективностью интерферона, хотя механизм его действия принципиально иной. Нарингенин не влияет на продуцирование вирусных белков в клетке, но препятствует сборке вирусных частиц. Для сборки, кроме вирусных белков, необходимо также наличие липидов клетки хозяина. Нарингенин влияет на способность вируса использовать липиды, что является причиной резкого снижения количества вирусных частиц. Возможно, что это связано с активацией нарингенином транскрипционного фактора PPAR-α - регулятора метаболизма липидов, инициирующего процессы β-окисления жирных кислот. Предполагается, что совместное действие нарингенина и стандартных антивирусных препаратов может оказаться эффективным в борьбе с инфекцией.
1.5.3. Эриодиктиол
Эриодиктиол обнаружен в типичном для Северной Америки травянистом растении Eriodictyon californicum. Эриодиктиол или его гликозиды присутствуют в различных фруктовых соках, в чае (Camellia sinensis), в цитрусовых, например, в лимоне (Citrus lemon), в томатах (Solánum lycopérsicum), в плодах шиповника (Rosa canina), в боярышнике (гибрид Crataegus х macrocarpa), в чабере (Satureja obovata Lag.) в семенах сосны сибирской (Pinus sibirica), в лубе лиственницы сибирской (Larix sibirica Ledeb.) и лиственницы Гмелина (Larix gmelinii Rupr.), в африканских растениях ройбосе (Aspalathus linearis) и в циклопии (Cyclopia genistoides), из которой получают напиток ханибуш, в травянистом растении Средиземноморья антирриниум (Antirrhinum majus), называющемся также «драконов цветок» (dragon flower).
Имеется сравнительно небольшое число работ, посвященных исследованиям физиологического действия эриодиктиола. Однако предполагается, что исследования этого флаванона чрезвычайно перспективны. Так, недавно было обнаружено, что эриодиктиол является супрессором активности RSK2-киназы и АМФ-зависимого транскрипционного фактора ATF1, ответственного за ускорение пролиферации и неопластической трансформации клеток рака. Эриодиктиол проявляет прооксидантную активность, что приводит к повреждению клеточной ДНК и гибели злокачественных клеток. Напротив, в нормальных клетках он оказывает защитное действие. Например, эриодиктиол проявляет антиоксидантное и антиапоптозное действие на кератиноциты, облученные ультрафиолетом. Ультрафиолет может подавлять активность протеинфосфатазы-2 (PP2A), которая регулирует активность митоген- активирующей протеинкиназы p38MAPK и протеинкиназы Akt, ответственных за апоптоз клеток.
Эриодиктиол способен подавлять реакцию макрофагов на присутствие липополисахаридов бактерий, являющихся мощными индукторами воспалительных процессов. Этот эффект достигается благодаря способности эриодиктиола восстанавливать активность PP2A, налаживать контроль сигнальных путей p38MARK и Akt, а также снижать концентрацию NO. Показано, что эриодиктиол повышает устойчивость клеток к окислительному стрессу, активируя систему внутриклеточной защиты от повреждений продуктами окисления. Активация системы защиты начинается с транслокации в ядро фактора транскрипции Nrf2, регулирующего экспрессию антиокислительных ферментов. В результате этого увеличивается экспрессия гемоксигеназы-1 и NAD(P)H: хинон-оксидоредуктазы, увеличивается концентрация внутриклеточного глютатиона, что приводит к резкому повышению выживаемости клеток.
Эриодиктиол, возможно, способен оказывать благоприятное влияние на сердечно-сосудистую систему, поскольку способен проявлять вазодилаторное действие. Например, он препятствует сужению сосудов, индуцируемому норадреналином, а также ингибирует реакцию сосудов на хлористый кальций и на форболовые эфиры.
1.5.4. Диосмин
Диосмин следует отнести к флавонам, но для фармацевтических целей его получают из флаванона гесперетина посредством химической модификации. Поэтому его часто называют «полусинтетический диосмин». Существуют также природные источники диосмина. Так, он присутствует в цитрусовых. Наиболее богаты диосмином незрелые плоды цитрона (Citrus medica), особенно сорта «пальцы Будды» (Budda’s finger), а также лимона (сорт Meyer). Предпочтительны зеленые плоды, тогда как зрелые, пригодные в пищу плоды не представляют фармакологического интереса, поскольку содержание диосмина в них существенно ниже. Диосмин содержится также в листьях южноафриканского растения бучу (Agatosma), в иссопе лекарственном (Hyssópus officinális), произрастающем повсеместно в Евразии и Африке.
Диосмин является основным действующим компонентом в таких популярных лекарственных препаратах, используемых для профилактики сосудистых заболеваний, как Флебодиа (активное вещество - полусинтетический диосмин), Детралекс (содержит микронизированный полусинтетический диосмин/гесперетин в соотношении 9:1), Дафлон (содержит смесь микронизированных флавоноидов, включая диосмин, полученный из лианы Сissus quadrangularis L., принадлежащей к семейству виноградовых). Указанные препараты рекомендуются при хронической венозной недостаточности, ломкости капилляров, геморрое. Лечение предполагает 1-2-кратный прием 500-600 мг флавоноидов в день от нескольких недель до многих месяцев. Проведенные в Европе пять больших клинических исследований действия диосмина (Детралекса) на пациентах с тяжелыми трофическими язвами вен показали, что указанный венотоник является адекватной и существенной добавкой к комплексной терапии тяжелой хронической венозной недостаточности.
Напротив, проведенные в 2010 г. клинические исследования Дафлона показали, что эффективность смеси флавоноидов Дафлон, полученных из лианы С. quadrangularis L., не отличалась от плацебо и не играла никакой роли в лечении ранних геморроидальных симптомов. В исследовании эффективности Дафлона при лечении геморроя также не было выявлено никакой положительной динамики в сравнении с контрольной группой больных, получавших плацебо. Однако имеются положительные результаты тестирования Дафлона, характеризующие этот препарат как эффективное и безопасное средство против различных геморроидальных симптомов, в лечении эдемы ног.
Хотя препарат Флебодиа выпускается компанией «Иннотек» (Франция), клинические исследования его действия проводились в России и некоторых странах Восточной Европы (Сербия, Болгария). Существует большое количество статей, опубликованных в отечественных журналах, посвященных результатам клинических наблюдений действия препарата Флебодиа при различных сосудистых заболеваниях (http://medi.ru/doc/a240900.htm). Имеются положительные результаты использования этого препарата в акушерстве и гинекологии, где он успешно применяется в лечении варикозного расширения вен малого таза, в лечении плацентарной недостаточности. Кроме того, Флебодиа применяется при лимфовенозной недостаточности, варикозной болезни нижних конечностей, в проктологии, в урологии, в неврологии и в онкологии.
Последствия длительного применения препаратов на основе диосмина мало изучены. Этот агент потенциально может проявлять нежелательное побочное действие. Так, описан единичный случай развития геморрагии (кровоизлияния) в желудочке мозга пожилой пациентки, принимавшей диосмин в течение нескольких лет. По мнению авторов статьи, возникновение геморрагии может быть связано с тем, что диосмин препятствует агрегации кровяных пластинок и усиливает сосудосуживающее действие норадреналина, что приводит к повышению внутрикапиллярного давления. Сочетание таких факторов, как повышенное давление и пониженная свертываемость крови может приводить к появлению геморрагий.
Как показывают эксперименты на животных, диосмин может оказывать разностороннее влияние на сердечно-сосудистую систему, нормализует кровяное давление, концентрацию окиси азота, повышая концентрацию антиоксидантов и снижая концентрацию продуктов перекисного окисления в крови. Диосмин снижает токсическое действие бактериальных липополисахаридов на эндотелиальные клетки аорты, а также на нервные клетки и на развитие нейродегенеративных заболеваний. Липополисахариды индуцируют апоптоз главным образом благодаря индуцированию фактора некроза опухолей ТNF-α. Диосмин оказывает защитное действие на клетки благодаря ингибированию продукции ТNF-α. При этом наблюдается также защита целостности молекулы ДНК, ингибируется активация каспазы-3. Таким образом, диосмин оказывает нейропротекторное и противовоспалительное действие на клетки нервной системы.
Исследования действия диосмина на животных и клеточных культурах показывают, что действие этого агента разнообразно, что позволяет предполагать возможность его применения в лечении многих заболеваний. Ряд исследований на животных показал, что диосмин способен подавлять развитие метастазов меланомы в легких. Антиинвазивная активность диосмина была сходна с действием α-интерферона, который чрезвычайно токсичен, в отличие от диосмина. Эти агенты действуют синергично, при этом концентрацию α-интерферона можно существенно снизить. Диосмин проявляет почти в два раза большую активность в подавлении деления раковых клеток в организме животных по сравнению с экстрактом из виноградных косточек или красным вином. Антиметастатическая активность диосмина была также выше, чем активность рутина или тангерина. Ингибирование диосмином пролиферации клеток карциномы печени и остановка деления клеток в фазе G2/М может происходить в результате активации белкового супрессора опухолей р53, что приводит к подавлению сигнального пути РI3К-Aкt-МDМ2. Комбинация диосмина и гесперетина была эффективна в подавлении деления клеток рака мочевого пузыря, рака прямой кишки, рака полости рта.
Диосмин потенциально способен оказывать благотворное влияние на больных диабетом. Он проявляет разностороннее действие, влияя на метаболизм углеводов. При ежедневном кормлении диосмином в дозе 100 мг/кг веса животного наблюдаются существенные изменения в крови: снижается гликозилирование гемоглобина, повышается содержание нормального гемоглобина и возрастает концентрация инсулина. Существенно возрастает активность ключевых ферментов печени -
гексокиназы и глюкозо-6-фосфатдегидрогеназы, тогда как активность глюкозо-6-фосфатазы и фруктозо-1,6-бис-фосфатазы снижается. При этом диосмин защищает организм от проявлений окислительного стресса, сопровождающего развитие заболевания. В крови повышается активность антиоксидантных ферментов: супероксиддисмутазы, каталазы, глютатионпероксидазы, глютатин-6-трансферазы, а также уровень антиоксидантных молекул: витамина С, витамина Е и восстановленного глютатиона.
Противовоспалительное действие гесперетина и диосмина было исследовано на животных с экспериментально индуцированным колитом. При этом в присутствии диосмина наблюдалось снижение концентрации продукта перекисного окисления липидов - малонового диальдегида, а также снижалась концентрация лейкотриена В4, участвующего в развитии воспалительных процессов. Гесперетин не оказывал подобного действия, но также как диосмин, повышал адсорбцию жидкости в толстой кишке, что было существенно при данном заболевании. Таким образом, диосмин и гесперетин способны предотвращать воспалительные процессы, вызванные колитом, при этом защита от окислительного стресса может играть существенную роль. Смесь гесперетина и диосмина (препарат Дафлон) может препятствовать развитию проктита, индуцированного радиацией, что также свидетельствует об антивоспалительном действии этих веществ при патологиях кишечника.