ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 1. ВАЖНЕЙШИЕ ФЛАВОНОИДЫ
1.6. Флаванонолы (дигидрофлавонолы)
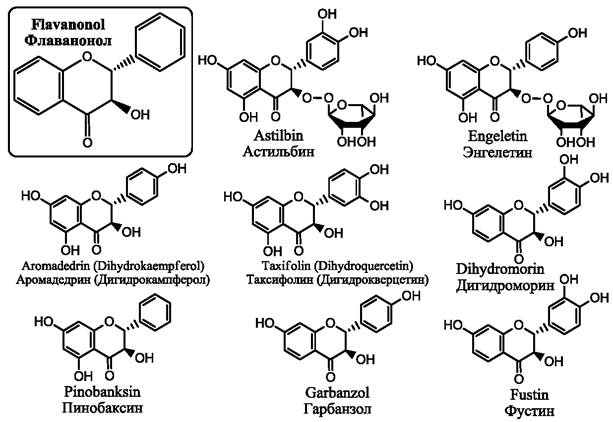
Флаванонолы (рис. 13) довольно широко распространены в природе. Они присутствуют в папоротниках, голосеменных и покрытосеменных растениях. Наибольшее число видов, содержащих флаванонолы, принадлежит бобовым, астровым, сосновым, тутовым и рутовым. Преимущественно они содержатся в древесине, коре, листьях или корнях растений.
Рис. 13. Наиболее известные флаванонолы
1.6.1. Таксифолин (дигидрокверцетин)
Таксифолин присутствует в лимонах, винограде, томатах, в яблоках, в красных сортах репчатого лука. Таксифолин присутствует в широко распространенном травянистом растении расторопша пятнистая (Silybum marianum). Он обнаружен также в плодах амазонской пальмы асаи (Euterpe oleracea), в хвойном растении, которое иногда называют японским кипарисом (Chamaecyparis obtuse). Кроме того, таксифолин может быть получен из (+)-катехина с использованием бактерий Burkholderia sp. KTC-1, обнаруженных недавно в торфе. В коре бразильского дерева Hymeneae martiana и бразильских кустарников Dimorphandra mollis, Erythroxylum gonocladum найден гликозид таксифолина астильбин. Астильбин присутствует в таких сортах красных вин как Мерло, Каберне совиньон. Хорошим источником получения астильбина могут служить корневища растения традиционной китайской медицины Smilax glabra. В России источником промышленного получения таксифолина является древесина лиственницы сибирской (Larix sibirica), лиственницы Гмелина (Larix gmelinii) или лиственницы даурской (Larix dahurica).
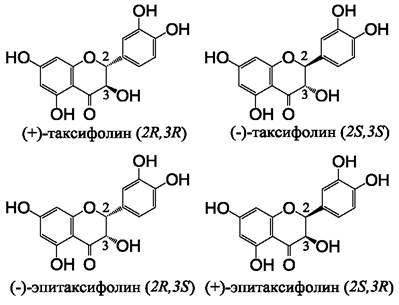
Флаванонолы обладают двумя хиральными центрами в положениях атомов углерода 2 и 3, вследствие чего могут образовывать четыре диастереоизомера, как это показано на примере молекулы таксифолина (рис. 14). Доступный в продаже таксифолин, обычно полученный из лиственницы, представлен 2R,3R-формой. Таксифолины, полученные из лимона, томатов, винограда содержат (+)-2S,3R-эпитаксифолин. Однако препараты таксифолина, полученные из иных природных источников, например, яблок или растения китайской медицины ту-фу-линг (Smilax glabra), могут содержать смесь из нескольких хиральных изомеров. Кроме того, процессу рацемизации флавоноидов (потере оптической активности вследствие образования смеси хиральных изомеров) могут способствовать повышенная температура, хранение препаратов при высокой влажности, изменение рН и другие факторы. Фармакологические свойства стереоизомеров могут отличаться, хотя этот аспект в настоящее время мало изучен, имеются данные о различиях фармакокинетики стереоизомеров таксифолина.
Рис. 14. Диастереоизомеры таксифолина. Аналогично катехинам, изомеризация этих молекул возможна вследствие отсутствия двойной связи между 2-м и 3-м атомами углерода.
Биодоступность таксифолина довольно низка. В экспериментах на крысах обнаружено, что в плазму крови попадает 0,17 % таксифолина, содержащегося в кишечнике. В экспериментах на клетках кишечного эпителия Сосо-2 показано, что в ограничении биодоступности таксифолина существенную роль могут играть белки множественной устойчивости к лекарствам - ABC-транспортеры: Р-гликопротеин и белок-2, ответственные за ограничение проникновения ксенобиотиков в организм. Предполагается, что вещества, ингибирующие активность ABC- транспортеров или снижающие их экспрессию, могли бы повысить биодоступность таксифолина. Вещества, способные повышать растворимость таксифолина в воде, например, циклодекстрины, также могут увеличивать его биодоступность. Растворение таксифолина в липиде может повысить его биодоступность до 36 %.
Исследовалась способность кверцетина и таксифолина индуцировать мутагенез. Для анализа использовали бактерии Salmonella typhimurium и Escherichia coli. Было обнаружено, что кверцетин способен вызывать мутагенез, хотя его активность снижалась в присутствии двухвалентного железа.
Действие таксифолина на клетки весьма разнообразно. Этот агент способен активировать ферментативную систему антиоксидантной защиты ARE (antioxidant responseelement), ингибировать цитохром Р450 и синтазу жирных кислот, оказывать влияние на транскрипцию TNF-α и NF-kB, влиять на метаболизм холестерина и регулировать содержание окиси азота в крови.
Таксифолин является ингибитором образования свободных радикалов, возникающих при перекисном окислении липидов, как это было показано на примере комплекса цитохрома с и кардиолипина в присутствии перекиси водорода. Антиоксидантные свойства астильбина связаны также со способностью ингибировать активность пероксидаз. Оригинальным решением является совместное использование таксифолина и липоевой кислоты для лечения тромбозов. Известно, что антиоксиданты могут препятствовать развитию тромбоэмболии глубоких вен. Липоевая кислота является мощным антиоксидантом, способным усиливать действие
других антиоксидантов. Поэтому ее иногда называют «антиоксидантом антиоксидантов». Было показано, что смесь липоевой кислоты и таксифолина (препарат липовертин) может обладать высокой активностью в лечении тромбоза вен, как это было показано в экспериментах на животных.
Эксперименты на животных и культурах клеток показывают, что таксифолин (дигидрокверцетин) и его гликозид астильбин обладают потенциальной способностью оказывать положительное действие на течение многих заболеваний. Хорошо известно действие дигидрокверцетина на сердечно-сосудистую систему. Препараты, содержащие дигидрокверцетин, способны улучшать реологические свойства крови и являются ингибиторами агрегации тромбоцитов. Их применяли также в лечении пациентов, страдающих ишемической болезнью сердца. В экспериментах на животных показано, что таксифолин при концентрации в крови 1мкг/л может облегчать течение ишемии мозга благодаря антиоксидантной активности, что связано с подавлением инфильтрации лейкоцитов, продуцирующих активные формы кислорода. При этом наблюдается снижение до нормального уровня активности ядерного транскрипционного фактора NF-kB, ингибируется экспрессия циклооксигеназы COX-2 и синтазы окиси азота iNOS, что может приводить к снижению продуцирования простагландинов и подавлению воспалительных процессов. Были проведены также исследования действия астильбина на течение ишемии почек и печени, в которых было показано снижение концентрации окиси азота и креатинина в крови, что свидетельствует о нормализации функции почек. Наблюдалось также снижение продукции хемоатрактанта моноцитов MCP-3, что приводит к снижению инфильтрации моноцитов.
В экспериментах на животных показано, что астильбин в концентрации 10 мкМ может нормализовать кровяное давление у гипертоников благодаря способности ингибировать фермент АСЕ (angiotensin converting enzyme), продуцирующий ангиотензин - пептидный гормон, вызывающий сужение сосудов и повышение кровяного давления. Кроме того, предполагается, что астильбин может препятствовать развитию атеросклероза, поскольку, он подавляет развитие гладкой мускулатуры аорты и препятствует инфильтрации клеток иммунной системы, ответственных за развитие воспалительных процессов и формирование атеросклеротических утолщений. Более того, астильбин является ингибитором 3-гидркси-3-метилглютарил-кофермент-А- редуктазы (HMG-CoA-редуктаза), которая участвует в синтезе холестерина. Этот фермент является мишенью лекарств статинов, снижающих уровень холестерина в крови. Исследования действия таксифолина на функции печени показали, что этот флавоноид, аналогично статинам, способен снижать секрецию аполипопротеина В, липопретеина низкой плотности, участвующего в переносе холестерина из печени в ткани других органов, что может приводить к развитию атеросклероза (так называемый «плохой холестерин»). При этом усиливается секреция аполипопротеина А1, липопротеина высокой плотности (так называемый «хороший холестерин»), участвующего в переносе холестерина из органов в печень и последующей экскреции. Предполагается, что в будущем таксифолин, астильбин или их производные смогут заменить современные статины и служить эффективными и безвредными средствами в борьбе с атеросклерозом.
Предполагается, что таксифолин и астильбин могут служить эффективными средствами в лечении заболеваний, связанных с нарушениями функционирования иммунной системы. Так, в исследовании на культуре Т-лимфоцитов (клетки Jurkat) было обнаружено, что астильбин может инициировать апоптоз Т-лимфоцитов, если их пролиферация предварительно была активирована фитогемагглютинином. Обработка активированных клеток иммунодепрессантом циклоспорином А снижала эффект астильбина. Напротив, обработка клеток гормональным стимулятором интерлейкином-2 приводила к существенному повышению их чувствительности к действию астильбина. Таким образом, наблюдалась избирательная способность астильбина нейтрализовать избыточную продукцию Т-лимфоцитов, инициированную действием гормонов или токсинов, тогда как астильбин не оказывал влияния на клетки при их нормальной пролиферации. Более того, астильбин препятствовал адгезии Т-лимфоцитов (клеток Jurkat) к поверхности клеток культуры эндотелия, инициированной действием таких токсинов, как конканавалин А или форболовые эфиры, но не препятствовал нормальной адгезии Т-лимфоцитов к поверхности этих клеток, если токсины отсутствовали. Адгезия не оказывала влияния на жизнеспособность клеток, поскольку астильбин препятствовал продуцированию Т-лимфоцитами фактора некроза опухолей TNF-α. Указанный механизм, вероятно, может играть существенную роль в защите печени от повреждающего действия токсинов.