Химия и биология белков - Ф. Гауровитц 1953
Гидролитическое расщепление белков
Определение скорости гидролиза
При гидролизе белка расщепление пептидных связей протекает согласно следующему уравнению:
![]()
О степени гидролитического расщепления белка можно поэтому судить, определяя число освободившихся карбоксильных или аминных групп или тех и других одновременно.
Увеличение числа карбоксильных групп можно обнаружить титрованием щелочью в присутствии формальдегида или этилового спирта. Формолтитрование было впервые предложено Зёренсеном [12], причем первоначально предполагалось, что в результате этой реакции образуются N-метиленовые соединения следующей формулы: RN = СН2. Хотя это предположение оказалось ошибочным (см. гл. VII), тем не менее следует считать, что формальдегид конденсируется с аминогруппами аминокислот, в результате чего аминогруппы теряют свои основные свойства. При взаимодействии аминокислот с формальдегидом, вероятнее всего, образуются моно- или диметильные соединения, соответствующие формуле R ∙ NH ∙ СН2ОН или R ∙ N(CH2OH)2 [13, 14]. Число карбоксильных групп в аминокислотах или белках можно определить также титрованием в этиловом спирте [15]. Спиртовое титрование оказывается возможным благодаря сдвигу величины рК для фенолфталеина, применяемого в качестве индикатора; в то время как изменение окраски фенолфталеина в водном растворе происходит вблизи pH 9, в спиртовом растворе это изменение имеет место при pH около 12 [16]. При этих высоких значениях pH аминокислоты проявляют кислые свойства, так как положительно заряженные группы NH3 превращаются в незаряженные NН2-группы, которые не могут нейтрализовать отрицательно заряженные группы СОО- (см. гл. V).
Ввиду того что аминокислоты представляют собой более слабые кислоты, чем пептиды (см. гл. V, табл. 6), гидролиз пептидов сопровождается некоторым уменьшением кислотности. Если в среде имеются углекислота и бикарбонат, то при гидролизе пептидов будет происходить поглощение углекислоты, величину которого можно измерить манометрически в аппарате Варбурга [17] по уменьшению давления углекислоты.
Классическим методом определения освобождающихся во время гидролиза свободных аминогрупп является метод Ван-Слайка [18]. Этот метод основан на способности свободных аминогрупп реагировать с азотистой кислотой с образованием газообразного азота по следующему уравнению:
![]()
В то время как d-аминогруппы аминокислот и концевые d-аминогруппы пептидов очень быстро реагируют с азотистой кислотой, ε-аминогруппы лизина реагируют очень медленно. При действии азотистой кислоты медленно разлагается с образованием азота также аммиак, который при гидролизе соляной кислотой отщепляется от амидных групп аспарагина и глутамина [18]. Объем образовавшегося азота можно измерить либо при атмосферном давлении, либо манометрически — при пониженном давлении [20]. Метод Ван-Слайка дает прекрасные результаты с большинством аминокислот и пептидов. Необходимо, однако, принимать в расчет, что сама азотистая кислота под действием сильно восстанавливающих веществ (например, цистеина) разлагается с образованием азота [21]. При определении азота глицина и его пептидов также получаются данные, превышающие теоретически вычисленные величины [22, 23].
Число аминогрупп, освобождающихся в процессе гидролиза, можно определить также титрованием аминокислоты в ацетоне соляной кислотой, используя в качестве индикатора нафтоловый красный [24], или титрованием аминокислот, растворенных в ледяной уксусной кислоте, хлорной кислотой, применяя в качестве индикатора яркий крезиловый синий [25].
В ходе гидролиза происходит исчезновение свободных молекул воды согласно следующему уравнению:
![]()
Реакция сопровождается уменьшением объема, которое можно измерить дилатометрически. Этот метод усовершенствован до такой степени, что при его помощи можно проследить скорость ферментативного гидролиза в одной капле реакционной смеси [26].
Все приведенные выше методы дают возможность проследить гидролитический распад белка по нарастанию числа аминных или карбоксильных групп, освобождающихся во время гидролиза, однако они не позволяют отличить свободные аминокислоты от пептидов. Подобное дифференцирование возможно при использование таких реагентов, которые взаимодействуют одновременно с карбоксильной и а-аминной группами аминокислоты. Наиболее важным реагентом этого типа является нингидрин (трикетогидринденгидрат). При нагревании водных растворов а-аминокислот с нингидрином происходит окислительное расщепление аминокислот с образованием соответствующего альдегида, углекислоты и аммиака.
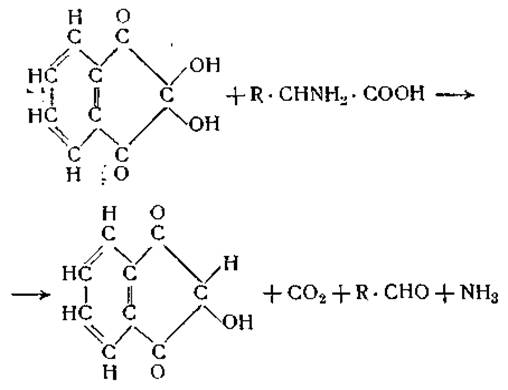
Образующийся альдегид немедленно конденсируется с восстановленным нингидрином. Продукт конденсации имеет синюю окраску, интенсивность которой можно измерить колориметрически [27]. Если нагревание с нингидрином ведется при pH 1—5, то методами газового анализа можно определить количество свободных аминокислот по количеству образовавшейся углекислоты. Ни белки, ни пептиды не реагируют с нингидрином при этих условиях [28].