Химия и биология белков - Ф. Гауровитц 1953
Гидролитическое расщепление белков
Фракционирование и изолирование аминокислот и пептидов
Методы фракционирования и изолирования всех аминокислот стали успешно разрабатываться только в последнее время. До этого времени удавалось более или менее точно разделить только отдельные группы аминокислот. Так, например, щелочные диаминокислоты — аргинин, лизин и гистидин — осаждались фосфорновольфрамовой кислотой и затем отделялись друг от друга осаждением сернокислым серебром при различных pH [30].
Главным методом разделения смесей моноаминокислот служил метод Фишера, основанный на фракционированной перегонке эфиров моноаминокислот [31].
По методу Фишера белок сначала гидролизуют соляной кислотой. При охлаждении гидролизата первой выкристаллизовывается нерастворимая солянокислая соль глутаминовой кислоты. После удаления этой соли избыток соляной кислоты отгоняют под уменьшенным давлением и остальные аминокислоты переводят р эфиры кипячением с абсолютным этиловым спиртом при пропускании газообразного хлористого водорода. По охлаждении раствора выкристаллизовывается нерастворимый сложный эфир глицина, который отделяется центрифугированием. Оставшиеся в растворе хлоргидраты эфиров аминокислот нейтрализуют основаниями (например, едким натрием или калием, карбонатом натрия или этилатом натрия). При фракционированной перегонке смеси сложных эфиров аминокислот под уменьшенным давлением получают следующие фракции:
фракция I (60°, 10 мм) —глицин, аланин, лейцин, пролин; фракция II (100°, 10 мм) — валин, лейцин, пролин; фракция III (100°, 0,5 мм) — лейцин, пролин; фракция IV (180°, 0,5 мм) — фенилаланин, глутаминовая кислота, аспарагиновая кислота, серин.
При перегонке происходят большие потери, вследствие чего этот способ не может служить количественным методом определения аминокислот. Следует, однако, указать, что при помощи именно этого метода удалось установить наличие в белках пептидных связей и определить аминокислотный состав белков. Трудности, связанные с перегонкой эфиров аминокислот, принудили искать другие, более простые методы разделения аминокислот. Ценные результаты были получены при помощи фракционного экстрагирования аминокислот из гидролизата бутанолом [32].
За последние несколько лет разработаны новые методы фракционирования белковых гидролизатов. Среди этих методов самое большое значение имеет метод хроматографического анализа, основанный на неодинаковой способности аминокислот адсорбироваться на поверхности того или иного адсорбента. Так аминодикарбоновые кислоты (аспарагиновая и глутаминовая) адсорбируются основными адсорбентами, например окисью алюминия [33, 34] или амберлитом IR-4 [35]. Глутаминовую кислоту можно затем извлечь из адсорбента разбавленной уксусной кислотой, причем аспарагиновая кислота при этих условиях не переходит в раствор. Эту последнюю аминокислоту можно, однако, легко извлечь 0,5 н. раствором едкого натрия [33]. Основные диаминокислоты адсорбируются на поверхности кислых адсорбентов, например кислой окиси алюминия [34], амберлита IR 100-Н, фенолформальдегидной смолы [36] или сульфонированных фенольных амберлитов [37]. В процессе извлечения оснований из адсорбентов кислотами происходит реактивирование смолы, которую снова можно использовать для адсорбции [38]. Из фильтрата, содержащего моноаминокислоты, можно удалите тирозин и фенилаланин, используя их способность адсорбироваться на животном угле [39]. Глицин, серин, треонин и цистеин адсорбируются кислой окисью алюминия после добавления к раствору формальдегида [40].
Синдж [41, 42] для разделения аминокислот использовал принцип распределения аминокислот между водой и органическими растворителями, не смешивающимися с водой, но частично в ней растворяющимися (например, бутанол, фенол или коллидин). Смеси аминокислот адсорбируются на крахмале [43, 44], силикагеле [45] или на полосах фильтровальной бумаги [46, 47], после чего через адсорбент пропускаются насыщенные водой органические растворители. Разделение аминокислот происходит благодаря различной скорости их извлечения растворителями из адсорбента. Дальнейшее разделение аминокислот может быть достигнуто путем последующего пропускания через адсорбент второго растворителя. Если в качестве твердой фазы употребляется фильтровальная бумага, то при пропускании через бумагу двух различных растворителей во взаимно перпендикулярных направлениях, аминокислоты после проявления нингидрином оказываются распределенными на бумаге в виде «пятен» (фиг. 2). Так как каждое пятно соответствует одной аминокислоте, то этим методом можно разделить все аминокислоты. Отношение скорости движения аминокислоты к скорости движения чистого растворителя характеризует определенную аминокислоту и является при равных условиях постоянной величиной. Она обозначается символом Rf. Интенсивность окраски пятна после реакции с нингидрином можно измерить спектрофотометрически, определяя пропускание света фильтровальной бумагой; этим способом можно производить количественное определение различных аминокислот [19].
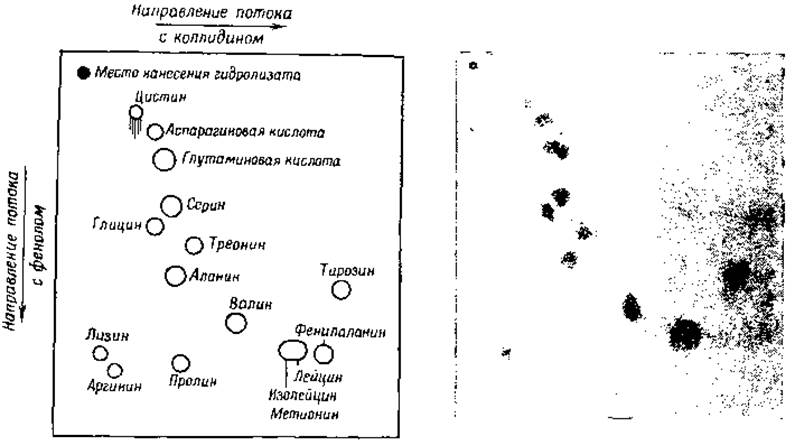
Фиг. 2. Двумерная хроматограмма гидролизата шерсти [29]. Первый растворитель коллидин, второй — фенол. Использовано 300 т белка.
Английские авторы при проявлении хроматограмм пропускают растворитель вниз по подвешенной бумаге. В последнее время предложена упрощенная модификация этого метода — так называемая «восходящая» хроматография [48]. Если в распределительной хроматографии используются радиоактивные производные аминокислот (например, n-иодфенилсульфонилпроизводные аминокислот, содержащие J131 или S35), то количество различных аминокислот можно определить по интенсивности излучения [149].
Метод распределительной хроматографии применяется не только для разделения аминокислот, но и для разделения производных аминокислот [45, 50], а также пептидов [51, 52]. Так, этим методом были получены денные результаты при разделении продуктов неполного гидролиза инсулина [53] и грамицидина [54]. Методом распределительной хроматографии было показано, что норвалин и норлейцин не являются составными частями белковой молекулы [29]. Выяснилось, что «норлейцин» представляет собой смесь d- и l-лейцина [55]. Отсутствие норвалина в гидролизате желатины было подтверждено спектроскопией по Раману [56]. Из списка природных аминокислот необходимо исключить также оксиглутаминовую кислоту, присутствие которой в казеине не было подтверждено хроматографическим методом [57]. Возможно, что так называемая фракция оксиглутаминовой кислоты представляет собой смесь аспарагиновой кислоты с другими веществами [58].
В настоящее время в результате применения новых методов исследования установлено, что в состав белковых молекул входят следующие аминокислоты: глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистин, цистеин, метионин, аспарагиновая кислота, глутаминовая кислота, аргинин, лизин, оксилизин, фенилаланин, тирозин, пролин, оксипролин, гистидин и триптофан. Ввиду того что количество азота этих аминокислот составляет в некоторых исследованных белках более 99% общего содержания азота, нет оснований предполагать наличие в этих белках заметных количеств каких-нибудь других еще не известных соединений. Эти данные, однако, нельзя обобщать и переносить на другие белки. Об этом свидетельствует хотя бы нахождение таких соединений, как аминоэтанол — в гидролизате грамицидина (см. гл. XV) — и диодтирозин и дибромтирозин — в гидролизате кораллов [59] и спонгина [60].