Химия и биология белков - Ф. Гауровитц 1953
Гидролитическое расщепление белков
Определение аминокислот в белках и белковых гидролизатах
Исходя из того, что в полипептидных цепях реактивные группы некоторых аминокислот остаются свободными, некоторые авторы предприняли попытки определить количественное содержание этих аминокислот непосредственно в белке по интенсивности цветных реакций. Эти попытки, однако, не имели достаточного основания, поскольку окраска, получаемая с белками, как правило, слабее окраски, получаемой с соответствующими белковыми гидролизатами. Это обусловлено, по всей вероятности, тем, что в белковой молекуле некоторые реактивные группы скрыты внутри глобулы и вследствие этого недоступны действию окрашивающего реагента (см. гл. VII). Поэтому для определения аминокислотного состава белка необходимо подвергнуть его полному гидролизу. Большинство аминокислот можно определить в кислотном гидролизате, однако некоторые аминокислоты обнаруживаются только после гидролиза белка гидроокисью бария (см. выше). Разделение смеси аминокислот представляет собой трудную задачу, так как аминокислоты являются амфолитами, растворимыми в воде и нерастворимыми в таких органических растворах, как спирт. Только иминокислоты пролин и оксипролин растворимы в этиловом спирте. Ввиду того что аминокислоты обладают сходными физико-химическими свойствами, их нельзя разделить фракционированием спиртом или нейтральными солями. Некоторые аминокислоты можно, однако, отделить путем осаждения их при соответствующих условиях. Например, растворимость цистина при нейтральной реакции и тирозина при слегка кислой реакции настолько мала, что при доведении реакции среды до соответствующего значения pH они почти полностью выпадают в осадок. Другие аминокислоты можно осадить специфическими реактивами. Однако ни один из этих методов не является полностью удовлетворительным в количественном отношении, так как все соответствующие осадки до известной степени растворимы.
Это затруднение пытались преодолеть, используя так называемый метод изотопного разведения [61]. Для того чтобы определить в гидролизате какую-нибудь аминокислоту, прибавляют к нему небольшое количество этой аминокислоты, меченной изотопом. Затем осаждают исследуемую аминокислоту каким-либо методом и производят определение содержания изотопа в осадке и в фильтрате. Исходя из того, что отношение концентрации изотопа в фильтрате (си.ф) к концентрации изотопа в осадке (си.о) равно отношению концентрации аминокислоты в фильтрате (са.ф) к концентрации аминокислоты в осадке (са.о), т. е. из того, что ![]() можно вычислить количество соответствующей аминокислоты, первоначально находившейся в гидролизате. Если через С0 обозначить содержание изотопа в прибавленной аминокислоте, а через СВ — в выделенной аминокислоте, то количество (В) аминокислоты, первоначально находившейся в гидролизате, определяется по формуле
можно вычислить количество соответствующей аминокислоты, первоначально находившейся в гидролизате. Если через С0 обозначить содержание изотопа в прибавленной аминокислоте, а через СВ — в выделенной аминокислоте, то количество (В) аминокислоты, первоначально находившейся в гидролизате, определяется по формуле
В = А(С0/СВ — 1),
где А — прибавленное количество меченой аминокислоты. Большое преимущество этого метода состоит в том, что не нужно проводить количественного выделения искомой аминокислоты в химически чистом виде. На точность метода не влияет также совместное осаждение других веществ, если только эти вещества не содержат изотопа, которым мы метим определяемую аминокислоту. Этот метод был применен для количественного определения следующих аминокислот: глицина, лейцина, аспарагиновой и глутаминовой кислот, фенилаланина, тирозина, аргинина и лизина [61]. Для метки аминокислот были использованы N15, С14, S35 и дейтерий. Работая с дейтерием, необходимо помнить, что при кипячении аминокислот с 20-процентной соляной кислотой атомы дейтерия в a-положении медленно обмениваются с атомами водорода [62]. Атомы дейтерия в ß- или у-положении при этих условиях стабильны [62].
Если выделенное соединение загрязнено элементом, используемым для изотопной метки, то метод изотопного разведения может дать значительную ошибку. Так, например, в опытах с аминокислотами, меченными N15, при совместном осаждении других аминокислот меняется отношение С0/СВ. Для того чтобы обойти эту трудность, было предложено все исследуемые аминокислоты превращать в изотопные производные и, добавляя большой избыток немеченого производного того же строения, отделять их затем от изотопных производных других аминокислот [63]. Так, например, белковый гидролизат обрабатывают n-иодфенилсульфонилхлоридом, содержащим J131. При этой реакции образуются n-иодфенилсульфонамидные производные аминокислот. Затем добавляется в качестве носителя большой избыток неизотопного n-иодфенилсульфонилглицина и измеряется содержание изотопа в выделенном образце n-иодфенилсульфонилглицина [63]. Метод дает новое мощное средство для количественного определения аминокислот в белковых гидролизатах.
Недавно Мур и Штейн [27] успешно провели количественное определение аминокислотного состава бычьего сывороточного альбумина и ß-лактоглобулина на колонке из крахмала. Соответствующие гидролизаты пропускали через колонку и извлекали аминокислоты сначала смесью нормального бутилового, нормального пропилового спирта и 0,1 н. соляной кислоты (1:2:1), а затем смесью пропилового спирта и 0,5 н. соляной кислоты (2:1). Таким путем эти авторы определили свыше 99% всех содержащихся в гидролизате аминокислот. Этот метод основан на том, что отдельные аминокислоты извлекаются из колонки с различной скоростью. Количество аминокислоты в небольших количествах различных фракций экстракта можно определить при помощи нингидриновой реакции. На основании полученных данных строится кривая (фиг. 3), по которой можно вычислить количество каждой аминокислоты в гидролизате. Каждая точка этой кривой указывает содержание отдельной аминокислоты в 0,5 мл элюата, определенное колориметрическим методом. Для приготовления гидролизата было использовано всего 2,5 мг альбумина бычьей сыворотки.
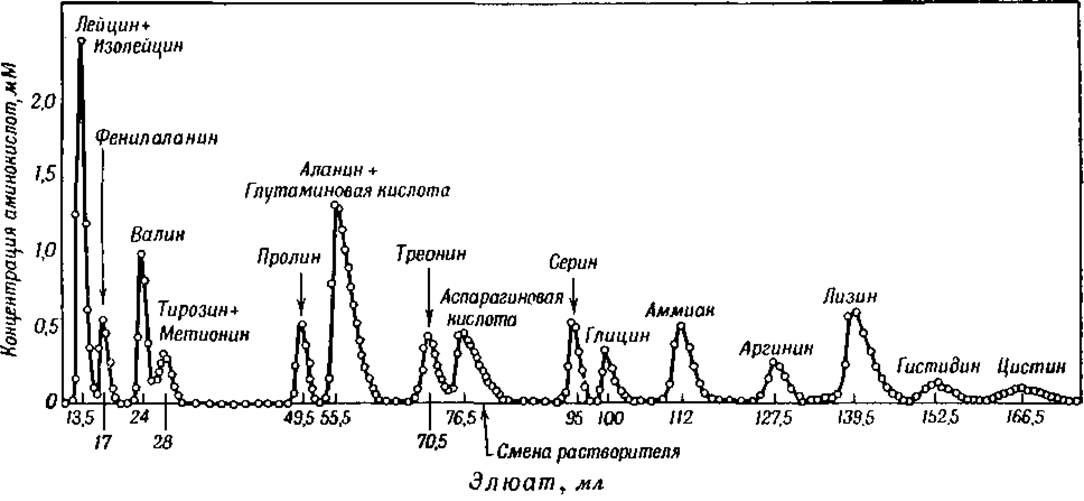
Фиг. 3. Хроматографическое разделение гидролизата сывороточного альбумина быка [27].
Другим новым методом количественного определения аминокислот является микробиологический метод. Для этой цели используются различные культуры молочнокислых бактерий, культура Leuconostoc mesenteroides и некоторые штаммы Neurospora. Интенсивность роста культуры определяется по мутности бактериальной суспензии, по количеству образующейся молочной кислоты или путем взвешивания мицелия [64—66]. Одну из модификаций микробиологического метода представляет метод определения аминокислот по количеству углекислоты, образующейся в результате ферментативного декарбоксилирования аминокислот бактериальными препаратами. Таким путем можно определить тирозин, гистидин, лизин и глутаминовую кислоту [67]1. Для количественного определения какой-нибудь аминокислоты микробы высеваются на синтетическую среду, содержащую все необходимые аминокислоты и факторы роста, за исключением исследуемой аминокислоты.
Интенсивность роста бактерий на этой среде сравнивается с интенсивностью роста бактерий на синтетических средах того же состава, но содержащих, кроме того, различные количества определяемой аминокислоты. Измеряя интенсивность роста бактерий при разных концентрациях определяемой аминокислоты, получают стандартную кривую, по которой и вычисляют содержание аминокислот в анализируемом материале [64].
Главное преимущество микробиологических методов заключается в их исключительной чувствительности. Другое очень важное преимущество этих методов состоит в том, что микробиологическое определение аминокислот требует ничтожного количества исследуемого материала: меньше 1 мг, иногда всего несколько микрограммов. Следует, однако, указать, что имеется и ряд затруднений при применении этих методов. Мы еще весьма мало знаем о том, как изменяется потребность бактерий в той или иной1 аминокислоте в зависимости от присутствия какой-либо другой аминокислоты. Поскольку аминокислоты, употребляемые в качестве стандартов для составления кривой, обычно содержат следы других аминокислот, невозможно исключить неспецифическую стимуляцию или торможение роста бактерий этими примесями. Поэтому к результатам микробиологических анализов необходимо относиться с известной осторожностью.
1 С. Р. Мардашевым в 1947 г. была выделена культура бактерий, обладающая специфической способностью декарбоксилировать аспарагиновую кислоту (С. Р. Мардашев, Микробиология, 16, 469, 1947). Из этой культуры удалось приготовить сухие препараты, которые дают возможность количественно определить содержание l-аспарагиновой кислоты в гидролизатах белков (С. Р. Мардашев и В. Н. Гладкова, Биохимия, 13, 315, 1948). В дальнейших исследованиях С. Р. Мардашеву и В. В. Мамаевой (С. Р. Мардашев и В. В. Мамаева, Биохимия, 15, 465, 1950) удалось разработать метод, позволяющий при помощи ферментативного декарбоксилирования определять аспарагиновую кислоту и аспарагин при одновременном их присутствии в растворе. — Прим. ред.
Новым методом идентификации аминокислот и их количественного определения является также спектрофотометрия в инфракрасном свете. Каждая аминокислота и каждая а-хлорокислота (получаемая при действии соляной и азотной кислот на аминокислоты) имеют характерную кривую поглощения в инфракрасном свете [68]. При помощи спектрофотометрии в инфракрасном свете было показано, что определение лейцина и изолейцина микробиологическим методом дает слишком высокие величины [69].
Аминокислоты, получающиеся в результате полного гидролиза белка, представляют собой оптически активные соединения (если гидролиз не сопровождается рацемизацией). Все выделенные из хорошо известных белков аминокислоты имеют одну и ту же конфигурацию, т. е. одинаковое пространственное расположение четырех радикалов у d-углеродного атома, хотя одни аминокислоты являются правовращающими, другие — левовращающими. Все аминокислоты, встречающиеся в природе, относятся к l-ряду. Их взаимная связь доказывается путем превращения в идентичные производные [70]. В некоторых алкалоидах спорыньи и бактериальных токсинах найдены оптические стереоизомеры этих «природных» аминокислот — «неприродные» d-аминокислоты (см. гл. XV) [70]. Глицин оптически неактивен, так как он не содержит в своей молекуле асимметрического углеродного атома.
Существует множество методов, служащих для определения индивидуальных аминокислот, причем некоторые из этих методов являются абсолютно специфическими. Ниже мы помещаем описание этих методов.
Определение глицина. Глицин (H2N ∙ СН2∙ СООН) дает нерастворимое соединение с К3[Сr(С2O4)3] ∙ 3Н2O (трехкалиевая соль триоксалатхромиата) [71]. Глицин можно определить и микробиологическим методом, используя в качестве чувствительных бактерий Leuconostoc mesenteroides [72]. Кроме того, глицин определяют также титрометрически. Метод состоит в следующем: глицин окисляют перманганатом, в результате чего образуется щавелевая кислота (СООН∙СООН), которую затем осаждают кальцием и определяют обычным титрометрическим путем [73]. Серин при этих условиях также дает щавелевую кислоту, поэтому необходимо предварительно провести определение серина.
Определение аланина. Аланин (I) превращается путем дезаминирования азотистой кислотой в молочную кислоту (СН3СНОН ∙ СООН); эта последняя окисляется в ацетальдегид, который определяется по цветной реакции [74]. Аланин можно осадить также при помощи нитраниловой кислоты [75]. Для микробиологического определения аланина используется Streptococcus faecalls [72]. При нагревании с нингидрином (см. выше) аланин превращается в ацетальдегид, который после перегонки с водяным паром можно определить титрованием [76].
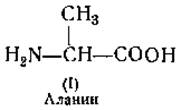
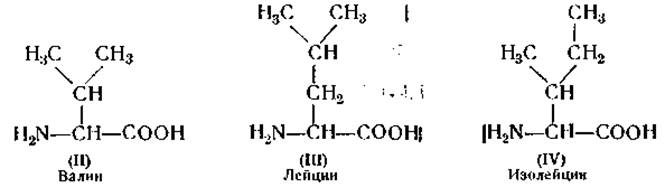
Определение валина, лейцина и изолейцина. При действии нингидрина на эти аминокислоты (II), (III) и (IV) также образуются летучие альдегиды, которые можно определить, как описано выше [76]. Количество каждой из трех указанных аминокислот можно определить также микробиологическим методом [64, 77]. Лейцин, в связи с его плохой растворимостью, можно определить методом изотопного разведения [61].
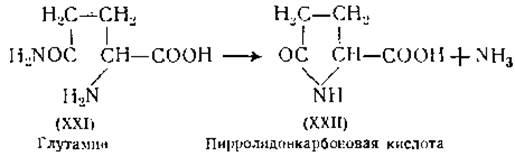
Определение аспарагиновой и глутаминовой кислот. Аспарагиновую (V) и глутаминовую (VI) кислоты можно осадить в виде кальциевых или бариевых солей из спиртового раствора [58, 78, 79]. Обе эти аминокислоты можно определить также микробиологическим методом1 [64, 72], а аспарагиновую кислоту, кроме того, — при помощи метода изотопного разведения [61]. Для определения глутаминовой кислоты было предложено несколько новых методов. Глутаминовая кислота при окислении хлорамином Т (СН3∙ С6Н4∙ SO2∙ NHCl) превращается в янтарную кислоту (СООН ∙ СН2∙ СН2∙ СООН); последняя под действием сукциноксидазы распадается до углекислоты, которая определяется манометрически [81]. Количество глутаминовой кислоты в белковом гидролизате можно определить по уменьшению количества аминоазота при нагревании гидролизата под давлением. При этих условиях глутаминовая кислота превращается в пирролидонкарбоновую кислоту [82], которая не имеет свободных аминогрупп. При нагревании глутаминовой кислоты с нингидрином образуется 3-формилпропионовая кислота, которая определяется колориметрически в виде динитрофенилгидразона [83]. В белковой молекуле аспарагиновая и глутаминовая кислоты присутствуют как в виде дикарбоновых кислот со свободными карбоксильными группами, так и в виде амидов этих кислот. Суммарное количество амидов можно определить по количеству освободившегося при кислотном гидролизе аммиака. Надежных методов определения в белке отдельно аспарагина и глутамина нет1.
1 Относительно определения аспарагиновой кислоты см. примечание на стр. 37. — Прим. ред.

В ферментных гидролизатах глутамин может быть определен путем нагревания нейтрализованного гидролизата до 100° [84]. Глутамин при этих условиях быстро гидролизуется и дает эквивалентное количество аммиака, аспарагин же не претерпевает никаких изменений [85].
Определение оксиаминокислот. При окислении оксиаминокислот йодной кислотой (HJO4) серин (VII) превращается в формальдегид, а треонин (VIII) — в ацетальдегид, причем освобождается эквивалентное количество аммиака [86]. По количеству отщепленного аммиака можно определить сумму оксиаминокислот. Аммиак образуется также при действии йодной кислоты на оксилизин — аминокислоту, найденную в заметных количествах только в желатине [87] (остальные белки содержат лишь следы оксилизина). Для определения оксилизина белковый гидролизат осаждается фосфорновольфрамовой кислотой, и получившийся осадок обрабатывается периодатом [87, 88].
Определение цистина. Цистин (X) можно определить, осаждая его фосфорновольфрамовой кислотой [89] или восстанавливая цистеин при помощи тиогликолевой кислоты [90]. Цистеин (IX) определяется затем колориметрически, по окраске с реактивом Фолина [91], или титрованием сульфгидрильных групп в присутствии окислителей, например иода [92], порфириндина [93] или железосинеродистого калия [94]. Образующийся железистосинеродистый калий определяется колориметрически по окраске, возникающей при его реакции с полуторахлористым железом (берлинская лазурь). Цистеин можно определить также электрометрическим титрованием сульфгидрильных групп азотнокислым серебром [95] или полярографически [96]. При обработке белков цианистым натрием или калием дисульфидные связи цистеина разрываются, причем сначала получаются соединения RSH + RSCH, которые затем образуют аминокислоту — лантионин (XI) [97, 98]. Лантионин может быть получен также под действием щелочей на цистин или на белки.
1 В работе С. Р. Мардашева и В. В. Мамаевой (С. Р. Мардашев и В. В. Мамаева, Биохимия, 15, 465, 1950) описан метод количественного определения аспарагина, который, по данным авторов, позволяет достаточно точно определять содержание аспарагина в различных животных объектах. В экстрактах печени, освобожденных от белков, авторы нашли 3,6 мг% аспарагина по отношению к весу свежего органа; в почках же содержание аспарагина равно 7,3 мг%. Определение аспарагина в ферментном гидролизате казеина показало, что около половины аспарагиновой кислоты, входящей в состав этого белка, находится в молекуле в виде аспарагина. — Прим. ред.
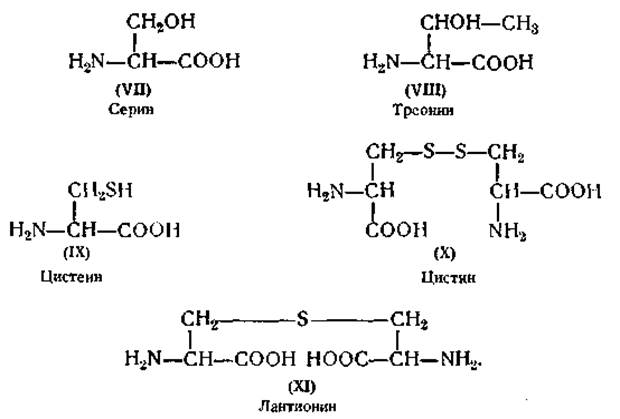
Определение метионина. Для количественного определения метионина (XII) выгодно использовать его способность образовывать йодистый метил при нагревании с иодистоводородной кислотой. Освобождающийся йодистый метил определяется титрованием [99]. Метионин дает красную окраску в кислом растворе с нитропруссидом [100]. Значительные количества метионина найдены в казеине.
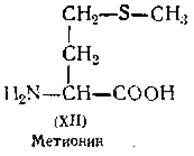
Определение аргинина. Аргинин (XIII) является представителем основных аминокислот, которые можно осадить из белкового гидролизата фосфориовольфрамовой кислотой или выделить при помощи электролиза [101]. Аргинин разрушается при нагревании со щелочами, причем на каждую молекулу аргинина освобождается две молекулы аммиака. Количество аммиака можно определить титрованием и по нему рассчитать количество первоначально присутствовавшего в испытуемом растворе аргинина. Фермент аргиназа гидролизует аргинин на орнитин и мочевину. Количество мочевины можно определить при помощи уреазы. Аргинин осаждается флавиановой кислотой (1-нафтол-2,4-динитро- 7-сульфокислота) [103]. Сакагуши показал, что аргинин дает с а-нафтолом и NaOCl очень чувствительную цветную реакцию [104]. Красная окраска, получающаяся при этой реакции, используется для колориметрического определения аргинина [105].
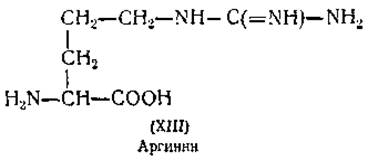
Определение лизина. Другая основная аминокислота — лизин (XIV) — отделяется от остальных основных аминокислот осаждением пикриновой кислотой. Для определения лизина были также использованы метод изотопного разведения [61] и микробиологические методы (Leuconosioc mesenteroldes или декарбоксилаза из бактерий) [106].
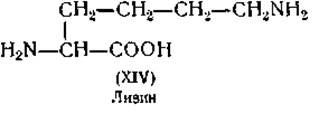
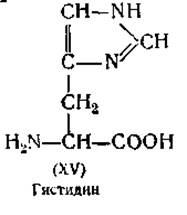
Определение гистидина. Третья основная аминокислота — гистидин (XV) — отделяется от других оснований в виде серебряной соли. Реакция гистидина с диазобензолсульфокислотой, дающая красное окрашивание, используется для его колориметрического определения [107].
Определение пролина и оксипролина. Иминокислоты — пролин (XVI) и оксипролин (XVII) — отличаются от остальных аминокислот своей необычайно высокой растворимостью в этиловом спирте. Пролин осаждается при добавлении соли Рейнеке (NH4Cr(CNS)4(NH3)2) [108] или роданиловой кислоты, т. е. тетратиоцианатдианилидохромовой кислоты [109]. Пролин можно определить микробиологическим методом при помощи Neurospora [72]. Для колориметрического определения оксипролин окисляется перекисью натрия, причем образуется вещество, дающее в кислом растворе с изатином красную окраску [110].
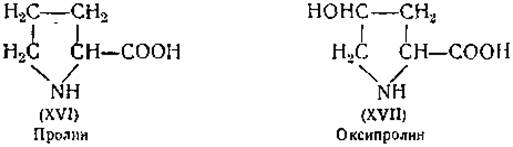
Определение триптофана. Триптофан (XVIII) из его раствора в серной кислоте осаждается сернокислой ртутью. Триптофан можно определить также спектрофотометрически, так как он дает интенсивную полосу поглощения в ультрафиолетовой части спектра [72]. Триптофан дает интенсивные цветные реакции со многими альдегидами, например с формальдегидом, диметиламинобензальдегидом или с глиоксалевой кислотой; эти реакции можно использовать для его колориметрического определения [111].
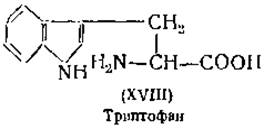
Определение фенилаланина. При обработке азотной кислотой фенилаланин (XIX) превращается в 3,4-динитробензойную кислоту, количество которой можно определить колориметрически [112]. При нитровании фенилаланина можно также получать динитрофенилаланин, который после восстановления цинковой пылью до диаминофенилаланина дает с нафтохинонсульфокислотой хорошо колориметрирующуюся окраску [113]. Для микробиологического определения фенилаланина используют Lactobacillus arabinosus. Фенилаланин можно осадить 2,5-дибромбензолсульфокислотой [114] и определить методом изотопного разведения [61].
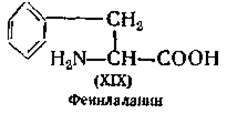
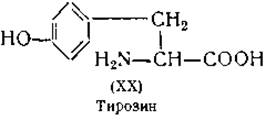
Определение тирозина. Растворимость тирозина (XX) в воде настолько мала, что он осаждается при нейтрализации белкового гидролизата. В связи с этим его можно определить методом изотопного разведения [61]. Различные цветные реакции тирозина также широко используются для его количественного определения. Наиболее часто применяются для этой цели: 1) диазореакция — красное окрашивание, образующееся при реакции тирозина с диазобензолсульфокислотой [115, 116]; 2) реакция Миллона — красное окрашивание, появляющееся в присутствии тирозина при прибавлении раствора ртути в азотной кислоте [117]; 3) синее окрашивание, появляющееся в результате восстанавливающего действия тирозина на смесь фосфорновольфрамовой и фосфорно- молибденовой кислот [118]. При обработке иодом в слабощелочном растворе тирозин иодируется. В результате иодирования получаются дииодтирозин и тироксин [119, 120]. Подобная же реакция наблюдается при обработке иодом белков [80].
Наконец, следует упомянуть еще об одном веществе, обнаруженном среди продуктов белкового гидролиза, а именно об аммиаке. Обычно считают, что аммиак получается исключительно в результате расщепления аспарагина и глутамина (XXI). Оба амида были обнаружены в ферментных белковых гидролизатах [121]. В то время как аспарагин устойчив в разведенных кислотах и в нейтральных водных растворах, глутамин при pH 2—6 и при нагревании до 100° образует аммиак и пирролидонкарбоновую кислоту (XXII) [122]. Различная устойчивость обоих амидов к кислотам может быть использована для раздельного определения аспарагина и глутамина в ферментных белковых гидролизатах [84, 123].