Химия и биология белков - Ф. Гауровитц 1953
Источники аминокислот для биосинтеза белка
Ферментативный гидролиз белка
Протеолитические ферменты были описаны в гл. XII. Из приведенных в этой главе данных видно, что многие ферменты могут быть выделены в очень чистом, кристаллическом виде. Функция тех протеолитических ферментов, которые находятся в желудочно-кишечном тракте, заключается в расщеплении введенных с пищей белков и превращении их в аминокислоты, которые подвергаются затем быстрому всасыванию. Протеолитические ферменты находятся также во всех клетках тела, где их присутствие обнаруживается явлениями автолиза, т. е. распада белков после гибели клеток. Такой распад происходит даже в строго стерильных условиях и, следовательно, не вызывается бактериями; он коренным образом отличается от гниения, которое часто сопровождается протеолизом. Протеолиз при гниении вызывается протеолитическими ферментами размножающихся бактерий, тогда как автолиз осущесталяется тканевыми ферментами, идентичными катепсину или близкими ему.
Протеолиз заключается в гидролитическом превращении соединений типа RCONHR' в RCOOH + H2NR' путем разрыва пептидных связей. Об интенсивности протеолиза судят по приросту карбоксильных и аминогрупп (см. гл. III). Гидролитическое расщепление пептидных связей, несомненно, входит в первую фазу протеолиза; остается, однако, неизвестным, ограничивается ли действие протеолитического фермента только этим разрывом или же в этой фазе происходят еще какие-то процессы. Это сомнение обусловлено аномальным понижением объема раствора, часто наблюдаемым в начальной фазе протеолиза [2]. Гидролиз пептидных связей сопровождается присоединением свободных молекул воды и должен приводить к уменьшению объема на 15—25 мл/моль (см. гл. III). В действительности же сокращение объема, найденное при гидролизе лактоглобулина, оказалось равным 50 мл/моль [2].
Физические свойства растворов белков также резко изменяются в начальной фазе протеолиза: снижается вязкость, и белки теряют способность свертываться при нагревании. Это, обычно, связано с превращением белка в пептиды, имеющие меньший молекулярный вес. Так, например, при переваривании яичного альбумина пепсином количество белка, теряющего способность свертываться при нагревании, пропорционально числу освобожденных аминогрупп [3]. С другой стороны, в начальной фазе гидролиза желатины или казеина трипсином не наблюдается прироста свободных аминогрупп [4] и, следовательно, резкое уменьшение вязкости не обусловлено разрывом пептидных связей. Возможно, что на этой стадии ферментного действия происходит распад каких-то очень слабых связей между отдельными группировками белковой молекулы. Поэтому можно было бы сказать, что фермент действует в качестве деполимеразы.
Ранее уже было указано, что многие глобулярные белки, устойчивые в нативном состоянии к действию протеолитических ферментов, после денатурации легко расщепляются этими ферментами. Так, например, денатурированный гемоглобин расщепляется папаином в 100 раз быстрее, чем нативный [5]. Нативный коллаген с трудом поддается действию трипсина, между тем как коллаген, подвергнутый нагреванию, легко гидролизуется [6]. Это же относится и к яичному альбумину или сывороточным глобулинам [7]. Сывороточный альбумин, который в водных растворах не расщепляется трипсином, гидролизуется этим ферментом при растворении в 30-процентном этиловом спирте [8]. Устойчивость нативных белков к действию протеолитических ферментов связана, вероятно, с отсутствием в этих белках точек, на которые могли бы действовать молекулы фермента. При денатурации же белковой молекулы происходит развертывание пептидных цепей, в результате чего структуры, необходимые для действия фермента, становятся доступными и протеолиз может быть осуществлен. Такими группами для трипсина являются боковые цепи аргинина или лизина, имеющие щелочной характер (см. стр. 293). В нативных белках эти группы скрыты внутри глобулы и потому недоступны для действия фермента; небольшие же ионы водорода могут проникать к этим группам, вследствие чего они титруются кислотами. Появление этих групп на поверхности развернутых денатурированных молекул объясняет не только гидролиз этих молекул трипсином, но и возникновение межмолекулярных солеобразных связей и образование нерастворимых коагулятов (см. стр. 154).
Если мы обозначим нативный белок через Н, а денатурированный через Д, то при добавлении протеолитического фермента равновесие Н ⇄ Д будет сдвинуто вправо, так как ферменты расщепляют в первую очередь денатурированный белок и этим стимулируют дальнейшее превращение Н в Д [9, 10]. Возможно, что первая фаза действия фермента заключается в ускорении превращения Н ⇄ Д и что фермент, таким образом, действует в качестве денатуразы.
Представление о том, что расщепление денатурированных белков облегчается появлением при денатурации развернутых пептидных цепей, подтверждается тем, что кератин шерсти становится доступным перевариванию после чисто механической его обработки; так, например, растертая в порошок шерсть в отличие от нативной расщепляется трипсином [11]. О том же свидетельствуют и опыты с мономолекулярными белковыми пленками, образующимися на поверхности раздела вода—воздух; такие растянутые пленки белка легко расщепляются протеолитическими ферментами, между тем как растворы тех же белков устойчивы к действию этих ферментов [12].
Способность денатурированных белков расщепляться протеолитическими ферментами с большей легкостью, чем расщепляются белки нативные, может показаться биологу несколько удивительной, поскольку все животные, за исключением человека, получают с пищей нативные белки. Не следует, впрочем, думать, что денатурирование белков в процессе варки способствует лучшему их расщеплению и усвоению. Дело в том, что и нативные белки при резко кислой реакции желудочного сока (pH 1—2) быстро денатурируются и уже в денатурированном виде подвергаются действию пепсина. Денатурация белков во время приготовления пищи имеет, однако, значение в тех патологических случаях, когда желудочный сок имеет не кислую, а нейтральную реакцию. В этих случаях денатурированный белок будет, бесспорно, расщепляться ферментами пищеварительного тракта быстрее, чем нативные белки [7].
Работы Бергмана и его сотрудников показали, что для ферментативного гидролиза пептидов необходимо наличие боковых цепей определенной структуры. Так, например, для протеолитического действия трипсина необходимо наличие в пептидах щелочных боковых цепей, пепсин же проявляет свое действие при наличии боковых цепей, содержащих ароматические или кислые аминокислоты. Ниже на примере тетрапептида тирозиллизилглутамилтирозина показаны отдельные группы, необходимые для действия различных ферментов [13].
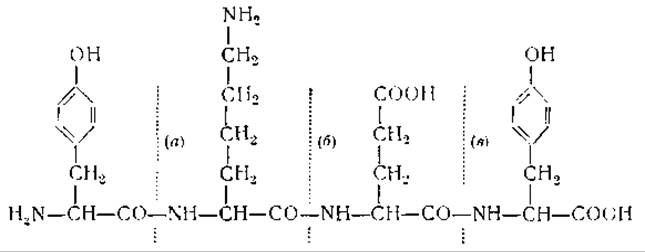
Связь (а) разрывается химотрипсином, так как ее СО-группа принадлежит ароматической аминокислоте — тирозину. Связь (б) расщепляется трипсином, который действует на пептидные связи, образованные карбоксильной группой основных аминокислот. Пепсин и карбоксипептидаза не могут расщеплять связей (а) и (б), однако они могут разорвать связь (в). Действие пепсина обусловлено тем, что группа NH у (в) принадлежит ароматической аминокислоте. Расщепление связи карбоксипептидазой зависит от смежной со связью конечной карбоксильной группы [14].
Как уже указывалось в гл. XII, действию ферментов способны подвергаться не только пептидные связи. Гидролитический распад может происходить, например, и тогда, когда пептидная связь заменяется эфирной. Пока еще остается неизвестным, как глубоко можно изменить структуру пептидов, подлежащих расщеплению, не нарушая при этом действия протеолитических ферментов. Небольшие вариации, влияющие лишь на скорость ферментного гидролиза, конечно, возможны; так, например, при pH 4 пепсин способен расщеплять не только карбобензоксиглутамилтирозин, но также, в известной мере, цистеилтирозин или тирозилцистеин [15]. Для окончательного выяснения вопроса о пределах специфичности различных протеолитических ферментов должна быть еще проведена большая экспериментальная работа [16].
Другой нерешенной проблемой, имеющей большое значение, является вопрос о структуре промежуточных продуктов, образующихся при расщеплении белков протеолитическими ферментами. Можно себе представить два пути этого расщепления: 1) последовательное отщепление аминокислот в точке, на которую непосредственно воздействует фермент, и как результат этого ступенчатое укорочение пептидной цепи, образующей белковую молекулу, вплоть до полного ее распада на аминокислоты; 2) расщепление белковых молекул сначала на крупные обломки, затем на более мелкие части и, наконец, на аминокислоты. Можно также представить себе, что расщепление белков протеолитическими ферментами осуществляется одновременно по обоим путям или же по какому-либо промежуточному пути. Выяснение механизма протеолиза важно не только с теоретической, но и с биологической и физиологической точек зрения. Если протеолиз протекает по первому пути, то белок непосредственно превращается в аминокислоты и лишь на короткий срок образуется небольшое количество промежуточных полипептидов. Если же белки расщепляются на крупные обломки, то образование значительного их количества должно вызвать заметные изменения осмотического давления и других физикохимических свойств клеточной среды.
Еще работы Кюне (1885), а также Гофмейстера и его сотрудников показали, что при действии на белки ферментных смесей желудочного или панкреатического сока образуется ряд промежуточных продуктов, получивших название альбумоз и пептонов. Первые высаливаются при насыщении сернокислым аммонием, но не свертываются при нагревании, вторые же не высаливаются и не свертываются при нагревании. Эти вещества не являются однородными, а представляют смесь высших и низших полипептидов, а также некоторых аминокислот, например цистина и тирозина, которые тоже выпадают в осадок при высаливании альбумоз. Хотя работы, посвященные изучению альбумоз и пептонов, в настоящее время имеют только исторический интерес, дальнейшее исследование промежуточных продуктов гидролиза белков имеет очень большое значение, так как оно представляет собой один из наиболее удобных экспериментальных путей для выяснения структуры самого белка.
Немногие попытки, предпринятые до настоящего времени для выяснения механизма ферментативного распада белка, не дали однозначных результатов. При действии пепсина на яичный альбумин около 35% белка превращается в пептиды с молекулярным весом ниже 1 000, 25%—в пептиды с молекулярным весом в пределах 1 000—10 000, 10%—в обломки с молекулярным весом в пределах 10 000—30 000 и 30% — в еще более крупные обломки [3]. С другой стороны, при действии пепсина на яичный альбумин, растворенный в уксусной кислоте, образуются лишь небольшие пептиды с молекулярным весом около 1 000 и совершенно не образуются промежуточные соединения с молекулярным весом от 1 000 до 44 000 [17]. В данном случае протеолиз можно сравнить со взрывом, при котором большая молекула распадается сразу на множество мелких соединений без накопления промежуточных продуктов. Другими словами, в этом случае происходит быстрое расщепление ограниченного числа пептидных связей, а не медленное расщепление многих.
Расщепление типа «все или ничего» наблюдалось также при действии кристаллического трипсина на кристаллический сывороточный альбумин или глобулин или при гидролизе пепсином сывороточного альбумина или фибрина [18].
При действии неочищенного препарата панкреатина на казеин или другие белки образуется большое количество свободных аминокислот, при действии же на казеин кристаллического трипсина свободных аминокислот не образуется [19]. При гидролизе фибрина пепсином также освобождаются свободные аминокислоты [18]. Из этих противоречивых сообщений вытекает, что течение протеолитического процесса зависит как от применяемого фермента, так и от характера субстрата, причем мы до сих пор еще очень мало знаем о закономерностях, определяющих течение этого процесса. Нет уверенности и в том, что протеолитические ферменты способны расщеплять какие-либо пептидные связи, кроме тех, которые соединяют друг с другом l-аминокислоты; существование d-пептидазы было постулировано [20, 21], но не было достаточно убедительно доказано [22].
Выше уже указывалось, что для действия некоторых пептидаз необходимо присутствие двухвалентных ионов металлов. Катепсин и папаин активируются добавлением цианидов и сульфидов. Возможно, что восстановленный глютатион или другие сходные с ним восстанавливающие вещества необходимы для процесса автолиза клеток [23].
Протеолитический распад иногда зависит от присутствия веществ, функционирующих в качестве косубстратов. Так, например, глициланилид, который не расщепляется папаином, подвергается распаду при добавлении ацетилфенилаланилглицина в качестве косубстрата. Объяснение этого удивительного явления заключается в том, что добавленный косубстрат образует промежуточное соединение — ацетилфенилаланилглицилглициланилид, которое затем расщепляется на неизмененный косубстрат, анилин и глицин [24].
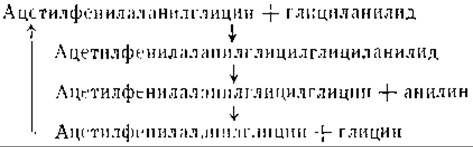
Такая последовательность реакций показывает, что протеолиз и синтез белка часто тесно связаны друг с другом и что, по крайней мере, в некоторых случаях гидролитический распад включает промежуточный синтез более крупных молекул. Необходимо, однако, помнить, что расщепление пептидов не обязательно означает гидролиз пептидов и что пептиды могут быть окислены непосредственно без образования свободных аминокислот. Возможность такой формы распада подтверждается наличием почти во всех органах дегидропептидаз [25]. Эти дегидропептидазы катализируют гидролиз дегидрированных пептидов:
![]()
Продуктами реакции являются аммиак, а-кетокислота и аминокислота или пептид. Необходимо отметить, что дегидропептиды гидролизуются экстрактами органов быстрее, чем пептиды [25], и что они также расщепляются ферментами панкреатического сока [26, 27]. Эти факты позволяют предположить, что окисление белков и пептидов может иногда происходить без гидролитического расщепления пептидной связи или может этому расщеплению предшествовать.