Химия и биология белков - Ф. Гауровитц 1953
Источники аминокислот для биосинтеза белка
Эндогенное образование заменимых аминокислот
Основные пути эндогенного превращения аминокислот, остававшиеся до сравнительно недавнего времени неясными, были изучены при помощи соединений, меченных изотопами азота и углерода. Главнейшие результаты этих исследований показаны в схеме 1. Из этой схемы видно, что основными предшественниками эндогенных аминокислот являются пировиноградная, щавелевоуксусная и a-кетоглутаровая кислоты. Эти три кетокислоти представляют собой продукты окисления, образующиеся в процессах межуточного обмена углеводов, жиров и белков. Уже сравнительно давно было установлено, что кетоглутаровая кислота окисляется в янтарную, которая затем легко превращается в щавелевоуксусную и пировиноградную. Позднее в опытах с применением меченой углекислоты было показано, что и обратные реакции могут иметь место: пировиноградная кислота, присоединяя углекислоту, образует щавелевоуксусную кислоту [60], а янтарная кислота при этой же реакции переходит в a-кетоглутаровую [61].
Аланин, аспарагиновая и глутаминовая кислоты образуются путем аминирования указанных трех n-кетокислот. Начальной реакцией во всех трех случаях является аминирование a-кетоглутаровой кислоты (а) с образованием глутаминовой кислоты1. Азот, необходимый для этой реакции, получается при дезаминировании других азотистых соединений (для этой же цели могут использоваться аммонийные соли, вводимые с пищей) [62]. Аминогруппа глутаминовой кислоты может быть затем перенесена на пировиноградную или щавелевоуксусную кислоты, причем образуются аланин и аспарагиновая кислота [63, 64]. Первоначально предполагалось, что и другие аминокислоты, помимо глутаминовой кислоты, могут образовываться при аминировании соответствующих кетокислот. Это, однако, оказалось невозможным. Аминоферазы, имеющиеся в тканях, катализируют только реакцию (а), т. е. аминирование а-кетоглутаровой кислоты, и реакции (б) и (в), т. е. образование аланина и аспарагиновой кислоты из глутаминовой путем переаминирования. Иными словами, источником для построения углеродного скелета аланина и аспарагиновой кислоты служат соответственно пировиноградная и щавелевоуксусная кислоты, между тем как источником азота является глутаминовая кислота [63].
1 Совершенно непонятно, откуда автор взял положение о том, что начальной реакцией процесса аминирования всегда является образование глутаминовой кислоты. В работах Небера, Кребса, Капланского, Крицман и других (А. Е. Браунштейн, Биохимия аминокислотного обмена, Москва, 1949) было показано, что в срезах печени и почек происходит прямое аминирование пировиноградной, щавелевоуксусной и кетоглутаровой кислот, причем пировиноградная кислота обычно аминируется быстрее, чем другие указанные кетокислоти. Есть, конечно, все основания считать, что образующиеся при аминировании пировиноградной и щавелевоуксусной кислот аланин и аспарагиновая кислота быстро подвергаются процессу переаминирования с кетоглутаровой кислотой, в результате чего образуется глутаминовая кислота. Нет, однако, никаких доказательств тому, что первоначально всегда образуется глутаминовая кислота, которая путем переаминирования дает аспарагиновую кислоту и аланин.
Автор совершенно неправильно ссылается на работы Грина и его сотрудников, которые якобы показали, что аминоферазы катализируют процесс аминирования кетокислот. В упомянутой книге А. Е. Браунштейна, которому принадлежит открытие процесса переаминирования, указывается (стр. 59), что природа ферментов, обусловливающих аминирование кетокислот, до сих пор еще не выяснена, и пока нет никаких доказательств того, что аминоферазы участвуют в этом процессе. Неверно также положение автора о том, что аминоферазы катализируют процесс переаминирования только между глутаминовой кислотой и пировиноградной и щавелевоуксусной кислотами. В настоящее время установлено, что большинство аминокислот, в том числе и ароматические кислоты, могут подвергаться процессу переаминирования.—Прим. ред.
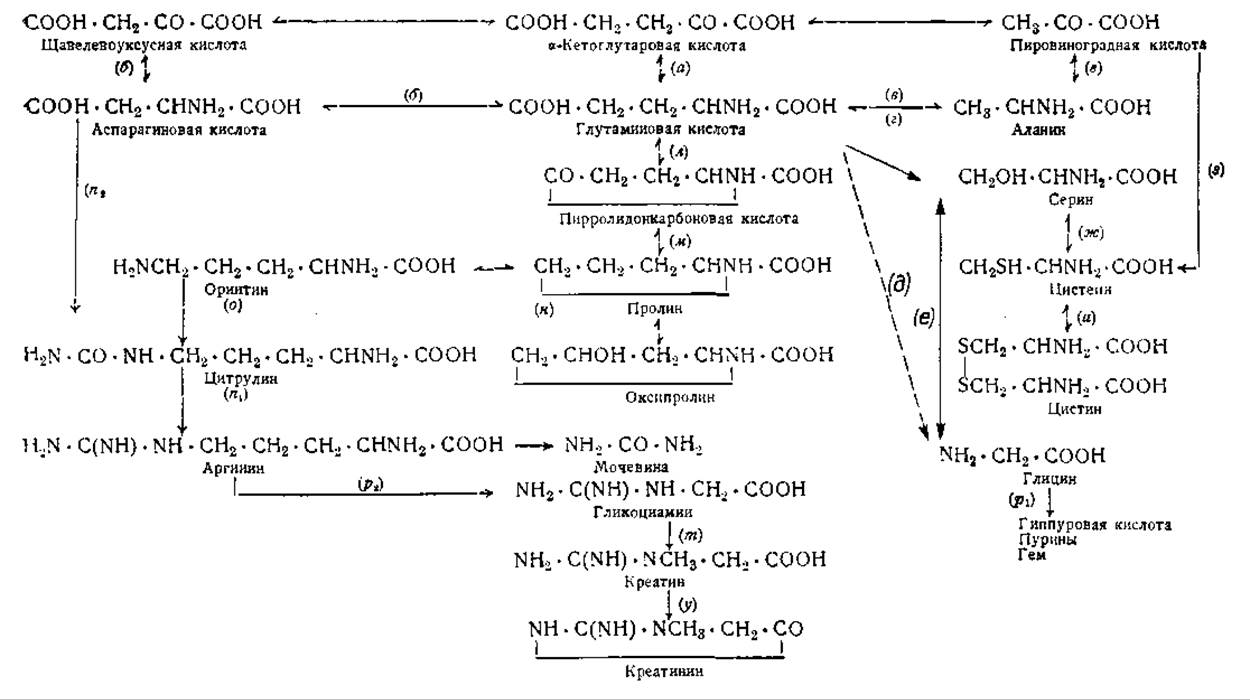
Схема 1
Исключительная роль глутаминовой кислоты ясна из нижней части схемы 1. Глутаминовая кислота не только поставляет азот для образования аланина и аспарагиновой кислоты, но является также источником для построения углеродного скелета пролина, оксипролина, глицина, серина, цистина, цистеина и аргинина. Она, действительно, является предшественником всех заменимых аминокислот1.
Серин образуется в гомогенатах печени из глицина путем реакции (е). Опыты с мечеными глицином и муравьиной кислотой доказали, что третий углеродный атом серина происходит из муравьиной кислоты и что он присоединен к й-углеродному атому глицина [65, 66]:
NH2CH2C13OOH + НС14ООН → С14Н2ОН ∙ CHNH3∙ С13ООН.
1 Положение автора о том, что глутаминовая кислота является источником для образования в организме животных всех заменимых кислот, является совершенно необоснованным. В 1949 г. работами А. Е. Браунштейна и Г. Я. Виленкиной было показано, что в печени и почках имеется специальная ферментная система — глициногеназа, катализирующая образование глицииа из серина, треонина и других ß-оксиаминокислот (А. Е. Браунштейи и Г. Я. Виленкина, ДАН СССР, 64, 243, 1949; 80, 639, 1951).
Этим путем, вероятно, происходит в основном образование глицина в организме животных, и нет никаких убедительных данных о непосредственном образовании глицина из глутаминовой кислоты. Поскольку серин образуется из глицина и муравьиной кислоты (W. Sakami, J. Biol. Chem., 176, 995, 1948; 187, 369, 1950), нет никаких оснований считать, что глутаминовая кислота является непосредственным источником также и для образования этой аминокислоты. То же относится и к образованию цистеина, в котором участвуют метионин и серин. Нет также доказательств того, что орнитин образуется в организме исключительно из пролина. Работы Стеттен и Шенгеймера, на которые ссылается автор, свидетельствуют лишь о том, что при введении в организм пролина, меченного N15, последний может быть обнаружен в орнитине и аргинине. Каким путем, однако, происходит этот перенос — до сих пор еще не ясно. — Прим. ред.
Сейчас еще не ясно, может ли серин образовываться путем реакции (г), т. е. путем прямого окисления глутаминовой кислоты [67], или ж є сначала должен произойти распад глутаминовой кислоты с образованием глицина (реакция д), из которого затем и образуется серин1. Реакция (е) является, безусловно, обратимой, так как глицин образуется из серина [67]. Серин является также предшественником цистеина, который образуется из серина и гомоцистеина в гомогенатах печени путем реакции (ж) [68].
Гомоцистеин CH2SH ∙ СН2∙ CHNH2∙ СООН образуется при дсметилировании метионина. Сера, необходимая для образования цистина и цистеина, доставляется, очевидно, метионином. Образование цистина зависит, таким образом, от наличия достаточных количеств метионина. При использовании метионина, меченного S35 и С13, было показано, что цистеину принадлежит только атом серы метионина, но не его углеродные атомы [69]. В качестве промежуточного продукта реакции образуется цистатионин [70, 71]:
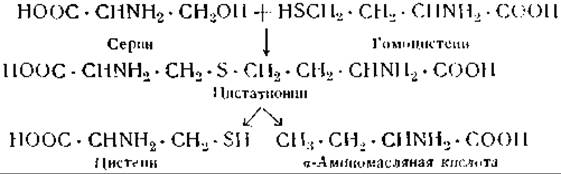
При распаде цистатионина образуется цистеин и а-аминомасляная кислота. Последняя найдена в моче у людей, получавших с пищей большие количества метионина [72]. Цистеин образуется также из пировиноградной кислоты по реакции (з), что было доказано при помощи сульфида, меченного S35 [73]. Цистеин легко дегидрируется, образуя цистин (реакция и); эта реакция обратима, и поэтому можно считать, что цистин и цистеин в межуточном обмене превращаются друг в друга.
Глицин, образование которого из глутаминовой кислоты непосредственно (реакция д) или через серин (реакция г и е) уже обсуждалось выше, используется в синтезе гиппуровой кислоты и выполняет важную роль в качестве предшественника пуринов и сложной циклической системы порфиринов. Опыты с меченым глицином показали, что 4-й и 5-й углеродные атомы пуринового кольца происходят из глицина (74, 75], а не из мочевины [76], как это предполагалось ранее.
1 См. примечание к стр. 374. — Прим. ред.
Участие глицина в синтезе гема было доказано при инкубировании глицина, меченного N15 и С14, с серповидными эритроцитами, образующимися у человека при особой форме анемии, или с ядерными эритроцитами птиц [77, 78]. Пиррольное кольцо порфирина образуется, по всей вероятности, при конденсации глицина с ß-кетоальдегидом [79]. Порфирины можно получить in vitro при конденсации глицина с ацетоуксусным альдегидом СН3 ∙ СО ∙ СН2∙ СОН [79]. Опыты с мечеными аминокислотами показали, что ни пролин, ни глутаминовая кислота не являются предшественниками порфиринов [81], и, следовательно, представление о том, что пролин является исходным веществом в синтезе пиррольных колец, должно быть отброшено. Порфириновая часть гемоглобина, введенная интраперитонеально, не используется для образования новых молекул гемоглобина. Организм осуществляет полный синтез порфирина из глицина и не использует для этой цели порфирин, введенный с пищей или парентерально [79, 82].
Пролин, оксипролин и орнитин легко образуются из глутаминовой кислоты, как это было показано при помощи аминокислот, меченных N15 и дейтерием [83]. Первым промежуточным продуктом является, вероятно, пирролидонкарбоновая кислота, легко образующаяся in vitro при нагревании глутаминовой кислоты и обнаруженная в моче у крыс, получавших большие количества глутаминовой кислоты с пищей [84]. Реакция (л), вероятно, сопровождается реакцией (м) — восстановлением пирролидонкарбоновой кислоты в пролин (пирролидинкарбоновую кислоту). При скармливании крысам пролина, меченного N15 и дейтерием, из него образуются оксипролин, орнитин и глутаминовая кислота [83]. Образование орнитина из пролина представляет собой реакцию, при которой происходит распад пиррольного кольца с присоединением аммиака [85]. Реакция (н) обратима: пролин образуется из орнитина при отщеплении аммиака [85]. Обратимость реакций (м) и (н) подтверждается также образованием дейтероглутаминовой кислоты из дейтероорнитина [86].
В левом нижнем углу схемы 1 показан цикл мочевины. Уже давно известно, что аргинин расщепляется ферментом аргиназой на орнитин и мочевину. Кребс [87] доказал также, что именно этим путем происходит образование мочевины в живом организме. Он обнаружил, что предшественником аргинина является орнитин и что цитрулин образуется в качестве промежуточного продукта [88]. Карбаминовая группа цитрулина (—CONH2) образуется из карбамилглутаминовой кислоты НООС ∙ СН2∙ СН2∙ CH (NH ∙ CONH2) ∙ СООН, которая, в свою очередь, происходит из глутаминовой кислоты [89]. Полагают, что поставщиком аммиака для синтеза цитрулина является глутаминовая кислота. Ратнер [90] показала, однако, что единственным источником аммиака, необходимого для образования аргинина из цитрулина, является аспарагиновая кислота (реакции n1 и n2). Аргинин не может быть синтезирован путем непосредственного аминирования а-кето-β-гуанидовалериановой кислоты [85]. Образование мочевины из аргинина было подтверждено опытами, в которых меченый аргинин вводился животным; при этом было обнаружено, что азот мочевины происходит из гуанидиновой группы аргинина [91—93].
На схеме 1 показано также образование креатина и креатинина из их предшественников. Непосредственным предшественником креатина является гуанидинуксусная кислота, называемая также гликоциамином. В экстрактах из почек она образуется из аргинина и глицина [85, 94], причем аргинин дает гуанидиновую группировку (реакция р2), присоединяющуюся к аминоуксусной группе глицина (реакция рІ). Гликоциамин метилируется в срезах печени в присутствии метионина [95]. Передача метальной группы метионином убедительно показана в опытах с метионином, меченным дейтерием в метальной группе CD3 [96]. Метилирование гликоциамина (реакция т) представляет собой аэробную реакцию, которая не может быть осуществлена в гомогенатах печени, так как она требует наличия неповрежденных клеток [95].
Креатинин мочи образуется исключительно из креатина, что было доказано при помощи изотопного азота [97]. Реакция (у) является необратимой: креатин не может быть образован из креатинина. Возможно, что непосредственным предшественником креатинина является фосфокреатин, так как это фосфорилированное соединение спонтанно превращается в креатин при 37° [98].
Из схемы 1 видно, что только три аминокислоты — аланин и аспарагиновая и глутаминовая кислоты — образуются путем аминирования соответствующих a-кето кислот. Обратная реакция, дезаминирование аминокислот с образованием a-кетокислот, является первой ступенью распада природных аминокислот. Соответствующие a-кетокислоты были выделены в виде динитрофенилгидразонов [99]. Окислительное дезаминирование аминокислот происходит в срезах печени и почек. Не только природные l-аминокислоты, но и d-аминокислоты дезаминируются с образованием a-кетокислот [100]. Так как a-кетокислоты превращаются, как это показано на схеме, в l-аминокислоты, то неудивительно, что некоторые d-аминокислоты, как, например, d-фенилаланин, d-триптофан или d-гистидин, так же хорошо используются крысами, как и природные l-аминокислоты [101]. Организм человека, однако, не может использовать перечисленные d-аминокислоты; лишь d-лизин и d-орнитин подвергаются нормальному превращению у людей [102]. Превращение d-аминокислот в l-аминокислоты путем дезаминирования и последующего реаминирования называют стереохимической конверсией неприродных аминокислот в природные [103]. d-Аминокислоты были найдены в бактериальных токсинах, грамицидине и тироцидине. Кегль [104] обнаружил d-глутаминовую кислоту в гидролизате белка опухоли и предположил, что она является характерным компонентом этого белка. Это предположение не подтвердилось, так как оказалось, что d-глутаминовая кислота образуется вторично, путем рацемизации [105—106]. Ферменты, дезаминирующие l-аминокислоты, более чувствительны к ядам и, следовательно, легче разрушаются, чем дезаминазы d-аминокислот [100].
Некоторые авторы считают, что промежуточными соединениями при взаимном превращении a-амино- и a-кетокислот являются ацетилированные аминокислоты [107]:
R ∙ СО ∙ СООН ⇄ R ∙ CH(NH ∙ СО ∙ СН3) ∙ СООН R ∙ CHNH2∙ СООН.
Образование ацетилированиых аминокислот было показано в срезах печени при добавлении дейтероацетата [108].