Химия и биология белков - Ф. Гауровитц 1953
Источники аминокислот для биосинтеза белка
Незаменимые аминокислоты
Ранее уже упоминалось, что метионин является источником метальных групп и серы. Метальные группы метионина используются для синтеза креатина и холина, а сера — для образования цистина и цистеина. В этих реакциях метионин может быть, однако, замещен соответствующим a-кетосоединением, тиометил-a-кетомасляной кислотой, которая в организме превращается в метионин [109]. Метионин образуется также из гомоцистеина и холина. Повидимому, реакция «метионин⇄холин» обратима [110].
Валин (СН3)2∙ СН ∙ CHNH2∙ СООН, лейцин (СН3)2 ∙ СН ∙ СН2∙ CHNH2∙ СООН и изолейцин (СН3)(С2Н5)СН ∙ CHNH2∙ СООН являются незаменимыми аминокислотами, так как их разветвленная углеродная цепь не может образовываться в организме животных [32—35]. Точно так же не могут образовываться циклические структуры тирозина и фенилаланина. При помощи дейтероаминокислот было, однако, показано, что небольшие количества тирозина могут образовываться в организме из фенилаланина [111]. Тирозин и фенилаланин являются незаменимыми предшественниками адреналина и гормона шитовидной железы. Тирозин, повидимому, необходим для созревания ретикулоцитов [112], которое зависит от галлахрома, производного индола, образующегося, в свою очередь, из тирозина. Другие индолпроизводные образуются из триптофана, который является также предшественником никотиновой кислоты или никотинамида [113]. Гистидин незаменим для собак и крыс, но может синтезироваться в организме человека. Путь образования имидазольного кольца в организме до сих пор неизвестен; возможно, что предшественником его является формамидиноглутаровая кислота, которая образуется из гистидина при действии гистидазы [114]:
![]()
Валин, лейцин, изолейцин, тирозин, фенилаланин, треонин, метионин, гистидин и триптофан хотя и незаменимы для организма, но могут быть замещены у некоторых животных своими стереоизомерами (d-аминокислотами) или соответствующими a-кетокислотами [101]. d-Аминокислоты дезаминируются с образованием соответствующих a-кетокислот, которые при реаминировании превращаются в l-аминокислоты. При внутривенном введении больших количеств d-аминокислот наступает, однако, быстрая гибель животных. Предполагается, что d-аминокислоты, конкурируя с l-аминокислотами, тормозят действие оксидазы l-аминокислот, что приводит к блокированию нормального дыхательного процесса [116]. Тот факт, что многие незаменимые аминокислоты могут быть замещены a-кето- или d-аминокислотами, показывает, что у большинства из них незаменимой частью является их углеродный скелет.
Лизин, последняя из числа незаменимых аминокислот, ведет себя в этом отношении совершенно отлично от других аминокислот. Лизин не образуется ни из соответствующей а-кетокислоты, ни из d-лизина [115]. Дезаминирование лизина в отличие от дезаминирования других аминокислот является необратимой реакцией. У лизина в отличие от всех остальных аминокислот не наблюдается включения изотопного азота при введении N15 в виде аммиака или аминокислоты [117].
Эти особенности обмена лизина зависят от того, что его ε-аминогруппа менее стабильна, чем а-аминогруппа, и что лизин в печени быстро превращается в а-аминоадипиновую кислоту [118]:
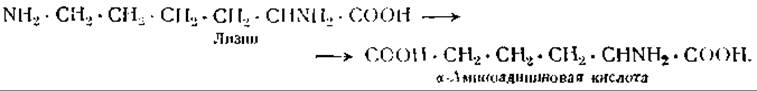
ε-Аминогруппа лизина в молекуле белка также является неустойчивой и разрушается при нагревании белка выше 150°. Питательная ценность белка, подвергнутого действию такой высокой температуры, снижается по сравнению с питательной ценностью нативного белка или белка, подвергнутого кипячению при 100° [119].