Химия и биология белков - Ф. Гауровитц 1953
Электрохимия белков
Электрофорез белков
Первоначально электрофорезом пользовались для определения изоэлектрической точки белков и их подвижности при различных значениях pH. Аппарат состоял из простой U-образной трубки, в которую помещали раствор испытуемого белка, забуференного до определенного pH. Безбелковый раствор того же буфера осторожно наслаивали на белковый раствор. Оба колена U-образной трубки соединяли с неполяризующимися электродами и наблюдали за движением границы белок—буфер под действием постоянного тока при напряжении около 100 в (фиг. 12) [67, 68].
Для того чтобы концентрация солей в обоих растворах была одинаковой, белковый раствор должен быть подвергнут диализу против буферного раствора. Трудности в создании четкой границы были успешно преодолены при помощи применения U-образной кюветы (фиг. 13), состоящей из трех секций, каждая из которых путем скольжения двух горизонтальных плоскостей может смещаться по отношению к другой. Белковый буферный раствор помещают в средний с катодной стороны и нижний отделы, в то время как средний с анодной стороны и верхний отделы кюветы заполняют чистым буферным раствором.
Движение границы между белком и буфером в средней части кюветы можно наблюдать непосредственно только в том случае, если испытуемый белковый раствор окрашен, как, например, растворы гемоглобина или гемоцианина. Для регистрации движения неокрашенных белков была использована фотография в ультрафиолете (известно, что все белки поглощают ультрафиолетовый свет). Это потребовало замены стеклянных кювет кварцевыми.
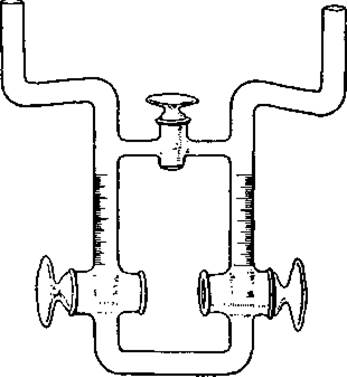
Фиг. 12. U-образная трубка для электрофореза [69].
Затруднения, связанные с невозможностью видеть границу, в конце концов были преодолены при помощи остроумного метода, введенного Тизелиусом [70]. Он воспользовался для этой цели разницей в преломлении света белковым раствором в буфере и буфером, не содержащим белка. Показатель преломления буферного раствора значительно возрастает при добавлении белка, причем прирост показателя преломления приближенно составляет 0,0018—0,0019 на 1 г белка в 100 мл раствора [71]. Поскольку показатель преломления может быть измерен с высокой точностью, малые изменения в концентрации белка, вызывающие вполне измеримое увеличение показателя преломления, могут быть легко учтены. Прирост показателя преломления лишь слегка варьирует от белка к белку. Его величина для 1 г яичного альбумина в 100 мл раствора составляет 0,001876, для сывороточного альбумина быка — 0,001901 и для сывороточного альбумина человека—0,001887 [72].
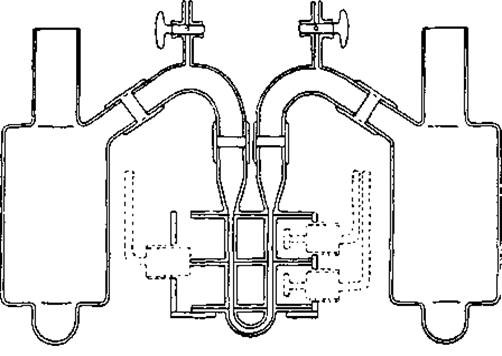
Фиг. 13. Электрофоретическая кювета [70].
В силу более высокого показателя преломления белкового слоя свет, проходя через границу, отклонится в направлении белкового раствора, т. е. вниз. При соответствующем оптическом устройстве разница в преломлении может быть обнаружена в виде тени на матовом экране или на фотографической пластинке. Появление темных полос, вызванное различиями в преломлении, называют явлением Тёплера. Так как показатель преломления пропорционален концентрации белка, то угол отклонения светового потока, проходящего через границу, с увеличением концентрации белка будет возрастать.
В настоящее время два различных принципа положены в основу автоматической регистрации движения белковой границы. В устройстве, сконструированном Лонгсвортом и Мак-Иннесом [73], максимально отклоненный свет преграждается диафрагмой 3 (острие ножа), движущейся вверх наперерез световому потоку (фиг, 14). Это вызывает появление на фотографической пластинке 4 темной полосы 5, которая и определяет положение белковой границы. Если фотоснимки сделать через определенные промежутки времени, смещение границы будет зарегистрировано и окажется возможным рассчитать подвижность белка. Любое колено U-образной кюветы может быть использовано для этой цели; поскольку обе границы будут смещаться в направлении одного и того же электрода, одна из них будет опускаться, а другая подниматься. Измеряется движение обеих границ, так что результат получают как по восходящей, так и по нисходящей диаграммам. Если перед фотопластинкой поместить темный экран с узкой вертикальной щелью, то получатся снимки, подобные тем, которые воспроизведены на фиг. 15.
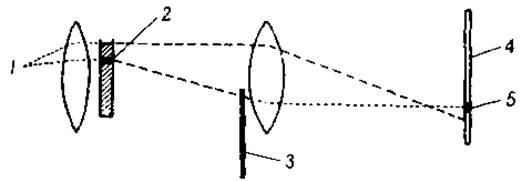
Фиг. 14. Схема регистрации границы при электрофорезе по Лонгсворту [64].
1 — источник света; 2 — белковая граница; 3 — диафрагма; 4 — фотографическая пластинка; 5 — темная полоса.
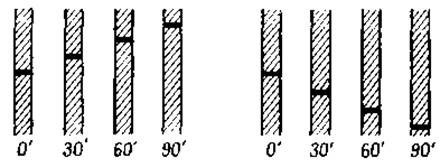
Фиг. 15. Диаграмма восходящей (слева) и нисходящей (справа) границ раствора гомогенного белка при наблюдении через 30-минутные интервалы.
Граница между белковым раствором и буфером не является геометрической плоскостью в строгом смысле слова; скорее ее можно охарактеризовать как узкую зону с показателем преломления, изменяющимся от показателя преломления белкового раствора в буфере до показателя преломления чистого буферного раствора. Если мы обозначим высоту колена U-образной кюветы через h (в миллиметрах) и показатель преломления раствора через n, то градиент преломления, т. е. увеличение или уменьшение преломления на единицу высоты, будет выражаться отношением дифференциалов dn/dh. Ясно, что градиент преломления будет равен нулю в чистых растворах (и белковом и безбелковом), а максимальная его величина совпадет с положением границы. Эта величина будет тем выше, чем больше концентрация белка в растворе. Интенсивность почернения на протяжении темной полосы зависит от величины градиента преломления, в связи с чем максимум затемнения будет соответствовать максимальному градиенту преломления, другими словами — максимальному градиенту концентрации белка.
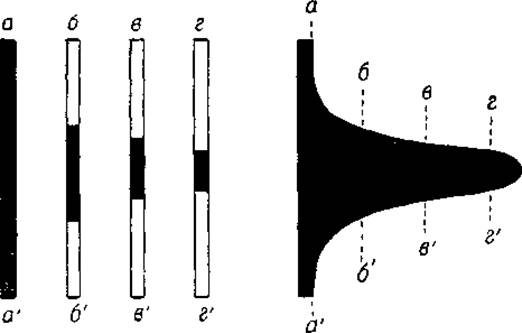
Фиг. 16. Теневой феномен, аа', бб', вв' и гг' — темные полосы при различных положениях диафрагмы.
Из сказанного ясно, что ширина темной полосы (фиг. 14 и 15) зависит от положения диафрагмы, которая отсекает оклоненный свет (фиг. 14). Чем выше поднята диафрагма, тем шире будет темная полоса.
Однако значительная ширина этой полосы препятствует точному определению положения границы. С другой стороны, границы с более низким градиентом преломления могут быть обнаружены только при более высоком положении диафрагмы, и, чтобы уловить их, необходимо поднять диафрагму (фиг. 14). В электрофоретическом аппарате Лонгсворта движение диафрагмы вверх сочетается с движением фотографической пластинки 4 в сторону, в результате чего вместо серии отдельных снимков получается непрерывная электрофоретическая диаграмма (фиг. 16)1.
1 Оригинальный, сравнительно простой и удобный в работе аппарат для электрофореза был сконструирован Г. Б. Троицким (Биохимия, 16, 592, 1951). — Прим. ред.
Раствор, содержащий только один вид белка, образует одну темную полосу; если же раствор содержит два или более вида белков с различной подвижностью, то по ходу электрофореза выявятся соответственно две или более полос. В последнем случае единая граница наблюдается лишь в момент времени t = 0, т. е. до включения тока. Под влиянием постоянного тока различные белки будут двигаться с различной скоростью, в связи с чем возникнет несколько зон изменяющегося преломления. Единственная темная полоса, представленная на фиг. 16, заменится в этом случае несколькими горизонтальными темными полосами.
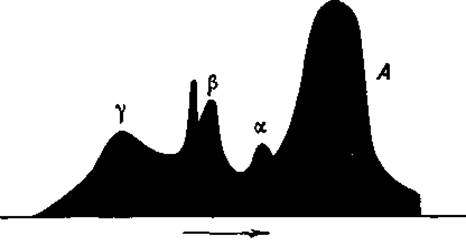
Фиг. 17. Электрофоретическая диаграмма нормальной сыворотки человека (нисходящая граница).
Наиболее часто исследуются электрофоретически смеси белков нормальной и патологической сывороток крови. Диаграммы восходящей и нисходящей границ обычно изображают в горизонтальном положении, т. е. повернутыми на 90°. Восходящая и нисходящая диаграммы представляют зеркальное изображение одна другой, но все же небольшие различия между ними всегда имеются. Обычно приводят только нисходящую границу (фиг. 17).
При pH 7,35, присущем нормальной сыворотке крови, а также при более высоких значениях pH, все белки сыворотки представляют собой анионы и, следовательно, движутся в одном и том же направлении, указанном стрелкой на фиг. 17. Сывороточный альбумин, изоэлектрическая точка которого лежит при pH 4,6, движется к аноду с наибольшей скоростью, в то время как глобулины, изоэлектрические точки которых лежат между pH 5 и 6, перемещаются с меньшими скоростями. Максимумы на кривой, изображенной на фиг. 17, указывают положение отдельных границ в момент, когда был сделан снимок. Высота кривой определяется градиентом преломления, т. е. величиной dn/dh, в то время как площадь, заключенная под каждым из пиков на кривой, отвечает концентрации белка, образовавшего данную границу.
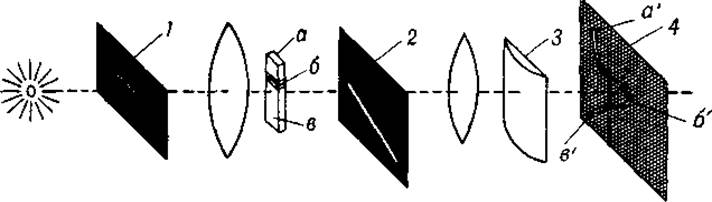
Фиг. 18. Схема регистрации границы при электрофорезе с цилиндрической линзой.
1 — горизонтальная щель; 2 — наклонная щель; 5 — цилиндрическая линза; 4 — матовый экран. а' и в' — проекции оптически однородного раствора, помещенного в точках а и в; б' — проекция границы б.
Как уже указывалось, метод регистрации границ Лонгсворта сменил первоначальный способ последовательной серии фотографий при различных положениях диафрагмы 3 (см. фиг. 14). При дальнейшем усовершенствовании метода оказалось возможным обойтись без сложного механизма, требовавшегося для синхронного смещения диафрагмы 3 в вертикальном и пластинки 4 в латеральном направлениях. Это было достигнуто благодаря остроумной модификации метода, разработанной Фильпотом [74] и Свенссоном [75]. Усовершенствование заключается в применении наклонной щели и цилиндрической линзы (фиг. 18). Раствор в вертикальной U-образной кювете освещается горизонтальным пучком света, вырезанным горизонтальной щелью 1, которую можно рассматривать как источник света. Пучок света проходит через раствор и затем через наклонную щель 2 второго экрана. Если в растворе, находящемся в кювете, нет никакой границы, то горизонтальный пучок света не отклонится и на матовом экране возникнет вертикальное изображение кюветы. Узкий участок плоского пучка света пройдет через наклонную щель, и на матовом экране 4 появится светлая вертикальная полоса а'b'. Если же в U-образной кювете имеется граница, пучок света, прошедший через нее, отклонится вниз, так что участок отклоненного пучка света, который пройдет через щель 2, окажется смещенным вправо. Цилиндрическая линза 3, ось которой расположена вертикально, фокусирует свет лишь по горизонтали, но не по вертикали, в связи с чем изображение отклоненного пучка света появится на экране 4 в виде бокового выступа б'.
Фиг. 19 передает картину, видимую на матовом экране или на заменяющей его фотографической пластинке. Изображение представляет собой светлую полосу на темном фоне. В первоначальном методе Фильпота, где вместо щели использовались два лезвия ножа, получалась картина, напоминающая ту, которая изображена на фиг. 19. Большое преимущество метода Фильпота — Свенссона состоит в том, что можно визуально следить за ходом электрофореза, наблюдая диаграмму, проектируемую на матовый экран 4 (см. фиг. 18), и фотографировать ее через подходящие промежутки Бремени.
При помощи электрофореза удобно определять изоэлектрические точки белков. Из величин подвижности при различных значениях pH может быть рассчитана «валентность» белковых ионов. «Валентность» белка естественно равна нулю в изоэлектрической точке. «Валентность» яичного альбумина в нейтральном растворе равна приблизительно 10—12, а сывороточного альбумина—16—17 [63].

Фиг. 19. Электрофоретическая диаграмма сыворотки крови, полученная по методу Свенссона.
При помощи электрофоретического исследования было обнаружено, что сывороточный глобулин, который рассматривался как однородный белок, является смесью, по меньшей мере, трех глобулинов, названных a-, ß- и у-глобулинами [76]. Таким же путем было установлено, что кристаллический ß-лактоглобулин [77, 78], кристаллический сывороточный альбумин [79] и кристаллический яичный альбумин [80, 81] являются смесями более чем двух белковых компонентов, которые могут быть разделены электрофоретически в их изоэлектрической точке или при других значениях pH [82].
Электрофорез используется как для аналитического разделения белков, так и для препаративного выделения чистых белковых фракций; так как U-образная кювета, применяемая для электрофоретического анализа, оказалась слишком мала для последней задачи, то для препаративных целей она была соответствующим образом видоизменена [83, 84].
Хотя электрофорез является прекрасным средством для определения изоэлектрических точек, подвижностей и однородности белков, все же при количественной интерпретации результатов возникает ряд трудностей. Эти затруднения частично обусловлены тем обстоятельством, что белковая граница подвергается диффузии, даже когда ток не проходит через раствор. В результате диффузии и тепловой конвекции граница постепенно размывается. Влияния тепловой конвекции можно избежать, работая при низкой температуре. Электрофорез проводят обычно при 4° (температура, при которой вода обладает максимальной плотностью). Другим более серьезным затруднением является то, что движение белковых молекул может приводить к химическим реакциям на границе, например к образованию солеобразных соединений между более кислыми и менее кислыми белками или между белками и ионами буфера [85]. Если такие реакции действительно происходят, то наблюдаемое при электрофорезе поведение границы будет характеризовать уже не белок как таковой, но образовавшийся белковый комплекс [86].
Поскольку характер электрофоретических диаграмм зависит от показателя преломления растворов, результаты электрофореза сильно зависят от всех факторов, которые могут повлиять на преломление. В белковом растворе преломление обусловлено в основном концентрацией белка, но в некоторой степени оно зависит и от ионов буфера.
Электрофоретическое движение белковых частиц, несомненно, определяется их электрическим зарядом, т. е. ионизированными группами белковой молекулы. Возникает вопрос, только ли ионные группы, расположенные на поверхности глобулярных белковых частиц, обусловливают это движение или же ионные группы, спрятанные внутрь белковой частицы, также принимают в этом участие? В опытах с различными клетками и бактериями было показано, что их электрофоретическое поведение определяется поверхностным слоем. Кроме того, было установлено в некоторых случаях, что кварцевые частицы, покрытые слоем адсорбированного белка, электрофоретически ведут себя таким же образом, как белок, из которого образован их поверхностный слой [87]. Из сказанного следует, что подвижность белковых частиц определяется потенциалом их поверхности. Поскольку этот потенциал выявляется только во время движения частицы или окружающего раствора в электрическом поле, его называют электрокинетическим потенциалом или ζ-потенциалом. Его величина определяется путем электрофореза, или, если мы имеем дело с белковыми мембранами, путем электроосмоса, или, наконец, измерением потенциалов течения. Последние возникают в результате продавливания раствора через поры белковой мембраны. При исследовании величины ζ-потенциала покрытой белком поверхности, например, покрытых адсорбированным белком стеклянных капилляров, все три метода дают одинаковые результаты. Это подтверждает предположение о том, что электрофоретическое поведение белков обусловлено их электрокинетическим потенциалом.
ζ-Потенциал, согласно теории Гун, свойственен диффузной ионной атмосфере, окружающей белковую молекулу и образующейся вследствие того, что каждая ионизированная группа белка притягивает один или несколько ионов противоположного знака. Толщина двойного слоя зависит от ионной силы раствора, согласно [89] формуле
![]()
где d — толщина двойного слоя, μ — ионная сила раствора. Если А и С — молярные концентрации, а и с — валентности аниона и катиона, то ионная сила раствора будет равна
![]()
Из этой формулы следует, что ионная сила 0,01M раствора хлористого натрия составит (0,01 + 0,01)/2 = 0,01, а ионная сила 0,01M хлористого кальция будет равна (0,02 + 0,04)/2 = 0,03. Толщина двойного слоя при растворении белка в этих растворителях составит, согласно приведенному выше уравнению, соответственно 30 и 18 Å.
Исходя из электрофоретических данных, пытались рассчитать действительный заряд белковой молекулы. Так как размеры и форма белковой молекулы точно неизвестны, можно было надеяться получить лишь приближенные результаты. Оказалось, однако, что найденные таким путем цифры удивительно хорошо совпали с числом зарядов, рассчитанным из кривых электрометрического титрования [45, 90] (см. табл. 8).