Химия и биология белков - Ф. Гауровитц 1953
Взаимодействие белков с водой
Гидратация
Под гидратацией понимают взаимодействие молекул воды с молекулами сухого или растворенного вещества. В живом организме веществами, связывающими воду, являются главным образом белки, а так как вода является универсальной средой для биологических реакций, то большое значение гидратации белков не требует особых доказательств. Литература по этому вопросу содержит много противоречивых данных. Это объясняется тем, что гидратация сухих и растворенных белков исследовалась многими авторами и притом различными методами. Так, например, одни авторы изучали гидратацию «сухого» белка, понимая под ним воздушносухой препарат, другие же при исследовании этого процесса использовали действительно сухие, не содержащие воды препараты. Хорошо известно, что сухие белки связывают воду, даже находясь на воздухе нормальной влажности, и если не учитывать этого обстоятельства, то можно допустить серьезные ошибки.
Явление гидратации обусловлено полярными свойствами молекул воды. Электронная формула воды показывает, что центр тяжести отрицательно заряженных электронов ближе к атому кислорода, чем к положительно заряженным ядрам водородных атомов (фиг. 20). С другой стороны, центр тяжести положительных зарядов ближе к атомам водорода. Такие молекулы, у которых центры тяжести положительных и отрицательных зарядов не совпадают, называются полярными молекулами или диполями. На фиг. 21 видно, что диполи всегда притягиваются ионами. В первой фазе процесса ион притягивает противоположно заряженный полюс и с такой же силой отталкивает одноименно заряженный полюс; во второй фазе притяжение сильнее, чем отталкивание, так как притягиваемый полюс расположен к иону ближе, чем отталкиваемый. Эти же факторы обусловливают притяжение между двумя диполями (фиг. 22).
Силы, действующие между диполями, при больших расстояниях менее эффективны, чем силы, действующие между ионом и диполем; однако именно они обеспечивают взаимную ассоциацию молекул воды. Действием этих же сил объясняется более высокая температура кипения воды по сравнению с температурой кипения веществ, построенных аналогично, таких, как H2S или H2Se.
В основе явления гидратации лежит связывание диполей воды нонами или ионными группами, диполями или полярными группами. Гидратироваться способны как твердые, так и растворенные вещества. Иногда при этом образуются гидраты определенного стехиометрического состава. Хорошо известным примером является гидратация сульфата меди. Безводный сульфат меди притягивает воду из воздуха и переходит в гидратную форму CuSO4∙ 5Н2O.
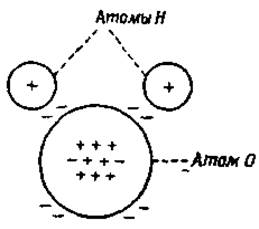
Фиг. 20. Электронная формула воды.
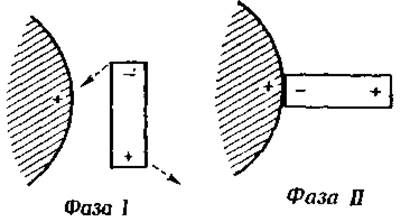
Фиг. 21. Взаимное притяжение диполя и положительно заряженной ионной группировки.
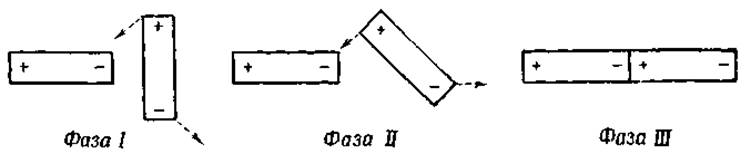
Фиг. 22. Ассоциация диполей.
При связывании между собой компонентов какого-либо соединения частично теряется их способность свободно передвигаться. В результате этого объем гидратированной молекулы всегда меньше суммы объемов компонентов; другими словами, гидратация сопровождается уменьшением общего объема. Это уменьшение может быть определено путем измерения объема до и после реакции. Более точно его можно определить, измеряя плотность D, т. е. вес 1 мл в граммах. Величина, обратная плотности, т. е. объем, занимаемый 1 г вещества, называется удельным объемом, Vуд. = 1/D.
Для того чтобы лучше представить себе взаимоотношения между отдельными факторами, оказывающими влияние на процесс гидратации, рассмотрим те изменения в объеме, которые наблюдаются при гидратации сульфата меди. Плотность безводного сульфата меди равна 3,58, а его удельный объем составляет 1/3,58 = 0,28; плотность пентагидрата (CuSO4∙ 5H2О) равна 2,29, а его удельный объем равен 1/2,29 = 0,436. Отсюда объем 1 моля безводного сульфата меди (м. в. 159,6) равен 159,6∙0,28 = 44,5 мл; объем 5 молей воды составляет 5∙18 мл = 90 мл. Общий объем, занимаемый 1 молем безводного сульфата меди и 5 молями воды, должен составить 44,5 + 90 = 134,5 мл. Однако в действительности объем, занимаемый 1 молем пентагидрата, равен 249,7∙0,436 = 109 мл (где 249,7 — молекулярный вес пентагидрата). Уменьшение объема при соединении 1 моля сульфата меди с 5 молями воды равно 134,5 — 109 = 25,5 мл.
При попытке определить истинные объемы, занимаемые молекулами сульфата меди и молекулами воды, возникает ряд затруднений. Поясним это на примере. Мы можем предположить, что уменьшение общего объема при образовании пентагидрата произошло за счет уменьшения объема безводного сульфата меди. Тогда мы можем вычесть величину, на которую уменьшился общий объем, из объема, который занимает безводный сульфат меди, и получим кажущийся объем, равный 44,5 — 25,5 = 19 мл на 1 моль сульфата меди. Можно также вычесть величину, на которую уменьшился общий объем, из объема, который занимают 5 молей воды, и допустить, что их объем сократился на 25,5 мл, т. е. с 90 мл до 64,5 мл, так что кажущийся молярный объем воды будет равен 64,5/5 = 12,9 вместо 18 мл на 1 моль, а ее кажущаяся плотность составит 18/12,9 = 1,4 г на 1 мл. Ясно, однако, что ни одно из этих двух допущений не является правильным. В действительности уменьшение объема происходит вследствие того, что все компоненты CuSO4∙ 5Н2O — молекулы воды, ионы меди и ионы сульфата — теряют способность свободно передвигаться в пространстве во всех трех измерениях.
В химии белка мы часто встречаемся с необходимостью определить либо степень гидратации сухих белков в атмосфере водяного пара, либо степень гидратации белков, растворенных в больших количествах воды. В обоих случаях общий объем системы белок—вода будет меньше суммы объемов сухого белка и добавленной воды. Так как небольшие изменения объема системы измерить трудно, то обычно определяют изменения плотности, которые могут быть очень точно измерены при помощи пикнометра. Если плотность системы белок—вода обозначить через D, а удельный объем, т. е. объем, занимаемый 1 г системы, через Vyд., то Vуд. будет равен 1/D. Плотность белковых растворов определяют взвешиванием в пикнометре с точно известным объемом V. Если вес раствора обозначить через Р, а объем пикнометра — через V, то плотность раствора будет D = у,![]()
Из изложенного видно, что определение плотности белковых растворов не представляет особых затруднений. Трудности возникают, однако, при измерении плотности сухих белков или влажных белковых препаратов. Многие белки при высушивании денатурируются, что делает невозможным использование этих препаратов для исследования гидратации. Это затруднение можно было бы преодолеть, определив предварительно плотность влажных кристаллов или раствора белка, а затем уже высушив белок. Однако при этом остается основная трудность, связанная с определением плотности сухого или влажного белка. Один из методов, применяемых для этой цели, состоит в том, что исследуемый белок помещают в пикнометр, взвешивают его, а затем наполняют пикнометр жидкостью известной плотности. Разумеется, такой заполняющей жидкостью не может служить вода, так как вода будет увеличивать степень гидратации; нельзя применять также этанол, ацетон и эфир, так как они способны притягивать воду и, следовательно, будут уменьшать степень гидратации. Обычно используют для этой цели бензол, бромбензол и другие гидрофобные жидкости. Но даже и при этом условии полученные результаты не вполне удовлетворительны, так как, во-первых, на поверхности раздела вода—растворитель имеет место денатурация белка, а во-вторых, небольшое количество воды все же растворяется в этих растворителях. Кроме того, при суспендировании сухого белка в органической жидкости появляются маленькие пузырьки воздуха, снижающие точность определения.
Другой метод, используемый для определения плотности, основан на измерении скорости оседания белковых частиц в водных растворах солей различной плотности [1]. Интерпретация полученных этим методом результатов усложняется тем, что белки соединяются не только с водой, но также и с солями (см. гл. V). Получение этим методом величины плотностей относятся в действительности к гидратированным белково-солевым соединениям, а не к гидратированным белкам.
Этих немногих замечаний достаточно, чтобы показать, с какими большими экспериментальными трудностями приходится сталкиваться при определении плотности сухих или гидратированных белков. Во многих случаях затруднение представляет и интерпретация полученных результатов. В связи с невозможностью определить количества гидратированного белка и свободной воды в системе белок—вода было введено специальное термодинамическое понятие частичного удельного объема, к определению которого обычно и прибегают.
Рассмотрим систему, состоящую из nБ молей белка и nВ молей воды. Общий объем системы V мы можем рассматривать как сумму объемов двух компонентов, образующих систему. Предположим, что 1 моль белка занимает объем vБ, а 1 моль воды — объем ![]() Тогда общий объем будет
Тогда общий объем будет
![]()
называют частичными молярными объемами. Поскольку молекулярный вес белков не всегда известен, частичные молярные объемы ![]() часто заменяются частичными удельными объемами
часто заменяются частичными удельными объемами ![]()
Их отношение к Vуд. определяется уравнением
![]()
где gб и gв — количества белка и воды соответственно в 1 г смеси. Очевидно, gб+gв = 1 г. Уравнение (1) содержит только два неизвестных ![]() так как Vуд, gб, gв могут быть определены. Величина этих неизвестных может быть найдена, если варьировать отношение компонентов в системе белок — вода (=gб/gв) и нанести на график зависимость Vyд. от g6. В результате получается кривая, показывающая, что частичный удельный объем белка зависит от его концентрации. Чтобы найти приблизительное значение
так как Vуд, gб, gв могут быть определены. Величина этих неизвестных может быть найдена, если варьировать отношение компонентов в системе белок — вода (=gб/gв) и нанести на график зависимость Vyд. от g6. В результате получается кривая, показывающая, что частичный удельный объем белка зависит от его концентрации. Чтобы найти приблизительное значение ![]() нужно определить тангенс угла наклона этой кривой [2].
нужно определить тангенс угла наклона этой кривой [2].
Другой, менее точный прием основан на произвольном допущении, которое предполагает что частичный удельный объем воды остается неизменным и vб всегда равен 1,0. Тогда уравнение (1) принимает более упрощенный вид:
![]()
где (vб)к.б — кажущийся удельный объем белка.
Необходимо подчеркнуть, что ни частичный удельный объем ![]() ни кажущийся удельный объем (vб)к.б не показывают действительного объема, занимаемого белком в системе белок — вода. При получении этих данных было сделано допущение, что объем системы белок—вода равен сумме объемов водной и белковой фаз, следовательно, не было принято в расчет наличие гидратированных белковых молекул. Поэтому мы не в праве вычислять степень гидратации из
ни кажущийся удельный объем (vб)к.б не показывают действительного объема, занимаемого белком в системе белок — вода. При получении этих данных было сделано допущение, что объем системы белок—вода равен сумме объемов водной и белковой фаз, следовательно, не было принято в расчет наличие гидратированных белковых молекул. Поэтому мы не в праве вычислять степень гидратации из ![]() или (vб)к.,б. Тем не менее результаты, полученные этим способом, имеют значение для оценки результатов, полученных другими методами, и для вычисления молекулярного веса белков по скорости оседания в ультрацентрифуге (см. гл. IV).
или (vб)к.,б. Тем не менее результаты, полученные этим способом, имеют значение для оценки результатов, полученных другими методами, и для вычисления молекулярного веса белков по скорости оседания в ультрацентрифуге (см. гл. IV).